不同分期前列腺癌组织中AKR1C3的表达
2018-11-28阚秀芳
李 倩,赵 刚,阚秀芳
(长春市第二医院,吉林 长春130021)
前列腺癌(prostate cancer,PCa)的发病率在男性恶性肿瘤中居第二位,是男性肿瘤相关性死亡的主要原因[1]。雄激素(androgen)和雄激素受体(androgen receptor,AR)通路激活在前列腺癌的发生、发展中具有重要作用。 因此,以降低血清雄激素水平和拮抗AR为目的的雄激素剥夺疗法(androgen deprivation therapy,ADT)是治疗转移性前列腺癌的主要手段,该疗法能够使80%-90%的患者缓解并提高总体生存率。但经过12-18个月的ADT后,超过80%的患者会进展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[2,3]。CRPC患者的总体生存率平均仅为23-37个月[4]。
前列腺癌发展成 CRPC的原因是雄激素通路的再活化。一方面是由于AR过表达、突变、变异体和翻译后修饰,导致AR信号非配体依赖性激活;另一方面是由于肿瘤自身获得合成雄激素的能力,其中睾酮(testosterone,T)与二氢睾酮(dihydrotestosterone,DHT)可有力促进前列腺癌细胞生长、增殖和转移。醛酮降解酶家族1成员3(aldo-keto reductase family 1 member 3,AKR1C3)是前列腺癌细胞自身合成睾酮与二氢睾酮的关键酶。体外实验发现,上调前列腺癌细胞内的AKR1C3表达可适应T/DHT剥夺[5];在PC-3细胞系中过表达AKR1C3可促进血管生成并增强细胞侵袭性[6]。然而,AKR1C3的表达水平与前列腺癌进展之间的关系尚不明确。本研究使用46例人前列腺穿刺组织样本,检测其AKR1C3表达水平,并分析AKR1C3表达水平与前列腺癌Gleason评分之间的关系,探究AKR1C3是否可作为评价前列腺癌进程的指标。
1 材料与方法
1.1 组织样本来源
选用的前列腺良性病变4例及前列腺癌42例样本来自于2010-2016年间长春市第二医院,所有患者之前均未接受过前列腺癌根治性切除手术、化学治疗、放射治疗以及激素治疗等。其中前列腺癌为腺癌,样本的Gleason评分大于等于6。所用前列腺癌样本的临床资料见表1。2位经验丰富的泌尿外科病理学家负责本项目所用标本的病理学诊断。
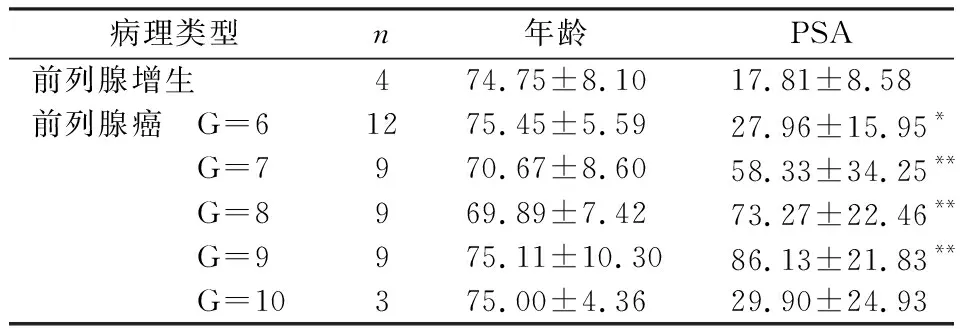
表1 前列腺癌样本临床资料
与良性增生比较,*P<0.05,**P<0.01
1.2 试剂
鼠抗AKR1C3单克隆抗体购自Abcam,二步法免疫组化用二抗及DAB显色试剂盒为北京中杉生物公司产品。
1.3 免疫组织化学染色
前列腺组织标本经10%福尔马林固定后,常规石蜡包埋,切成4 m的薄片,70℃烘烤过夜。切片经二甲苯脱蜡后经分级乙醇水化,切片置于0.5% H2O2中孵育10 min以灭活内源性过氧化物酶,于含10 mM柠檬酸缓冲液(pH 6.0)的高压锅中120℃加热15 min修复抗原,用pH 7.6的0.1 M PBS洗片5 min,与含10%山羊血清共同孵育以封闭非特异性抗原。将切片与1∶00稀释的鼠抗AKR1C3单克隆抗体于4℃孵育过夜。PBS洗片后,与生物素化的山羊抗-鼠二抗室温孵育1 h。PBS洗片10 min后,切片与DAB-H2O2底物室温孵育6 min。蒸馏水洗片,苏木精复染。然后将切片脱水,树脂封片。阴性对照组中,以磷酸缓冲液替代一抗。
1.4 结果判定
AKR1C3的阳性表达表现为棕色的细胞质和/或细胞核染色。每张组织切片中随机选取5个AKR1C3阳性区域(400×,放大率)。以IPP 6.0软件对阳性细胞的密度值进行评定,结果以平均光密度值(MOD)表示。
1.5 统计分析
所有结果均经SPSS 17.0 软件处理。单因素方差分析评价组间平均差异,数据结果以平均值±标准差的形式记录。斯皮尔曼R值测试变量之间的联系。P<0.05为统计学差异显著。
2 结果
2.1 AKR1C3在人前列腺增生样本中的表达
在本研究中,我们通过免疫组化技术对人前列腺样本(前列腺良性增生、前列腺癌)中的AKR1C3进行染色,组织切片中免疫组化棕色染色部分为 AKR1C3阳性。磷酸盐缓冲液对照组细胞为阴性染色,正常腺上皮组织与前列腺良性增生组织内可见散在的免疫组化阳性染色(图1),而前列腺癌组织的细胞质内可见广泛阳性染色(图2)。而且前列腺良性增生与前列腺癌组织内AKR1C3的表达分布存在差异。在前列腺良性增生组织内,AKR1C3阳性细胞多集中于基质,而在恶性前列腺癌组织,上皮细胞内AKR1C3阳性细胞比例增加。而且在前列腺癌细胞内,随着Gleason评分的增高,AKR1C3表达也增强。这一结果提示,AKR1C3的表达水平与前列腺癌和Gleason评分紧密相关。
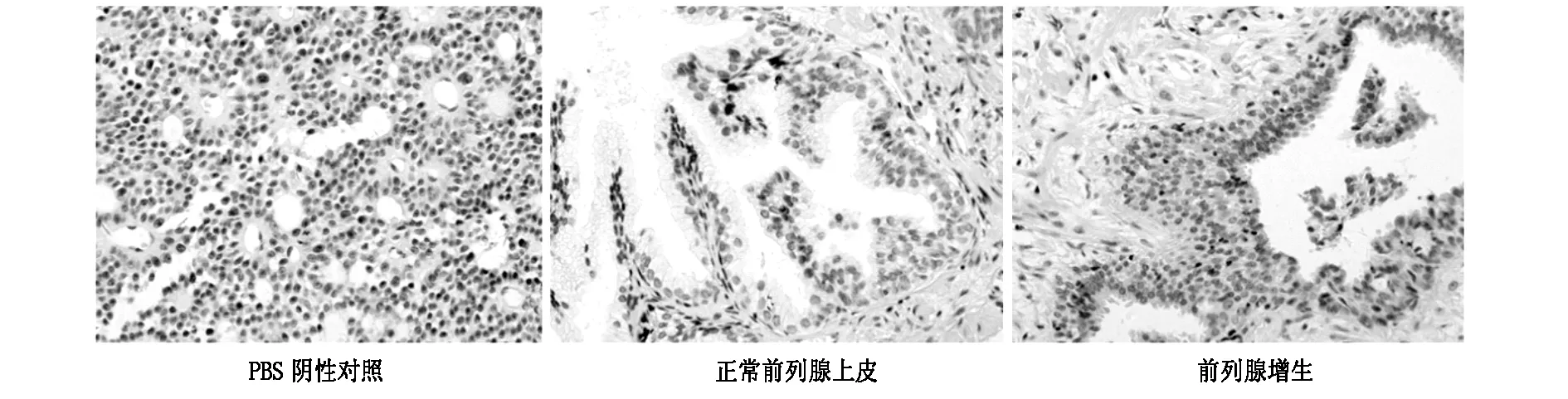
图1 正常前列腺上皮及前列腺增生组织中AKR1C3的表达
2.2 AKR1C3与前列腺癌穿刺样本临床病理特征之间的关系
Gleason评分是评价前列腺癌进展的重要指标,因此我们分析AKR1C3表达水平与Gleason评分之间的关系。数据显示,随着Gleason评分的升高,AKR1C3的表达水平(MOD值)逐渐升高,差异具有显著统计学差异(rs= 0.325,P=0.031)。这一结果提示,AKR1C3可反映前列腺癌的临床病理特征与进展(表2)。
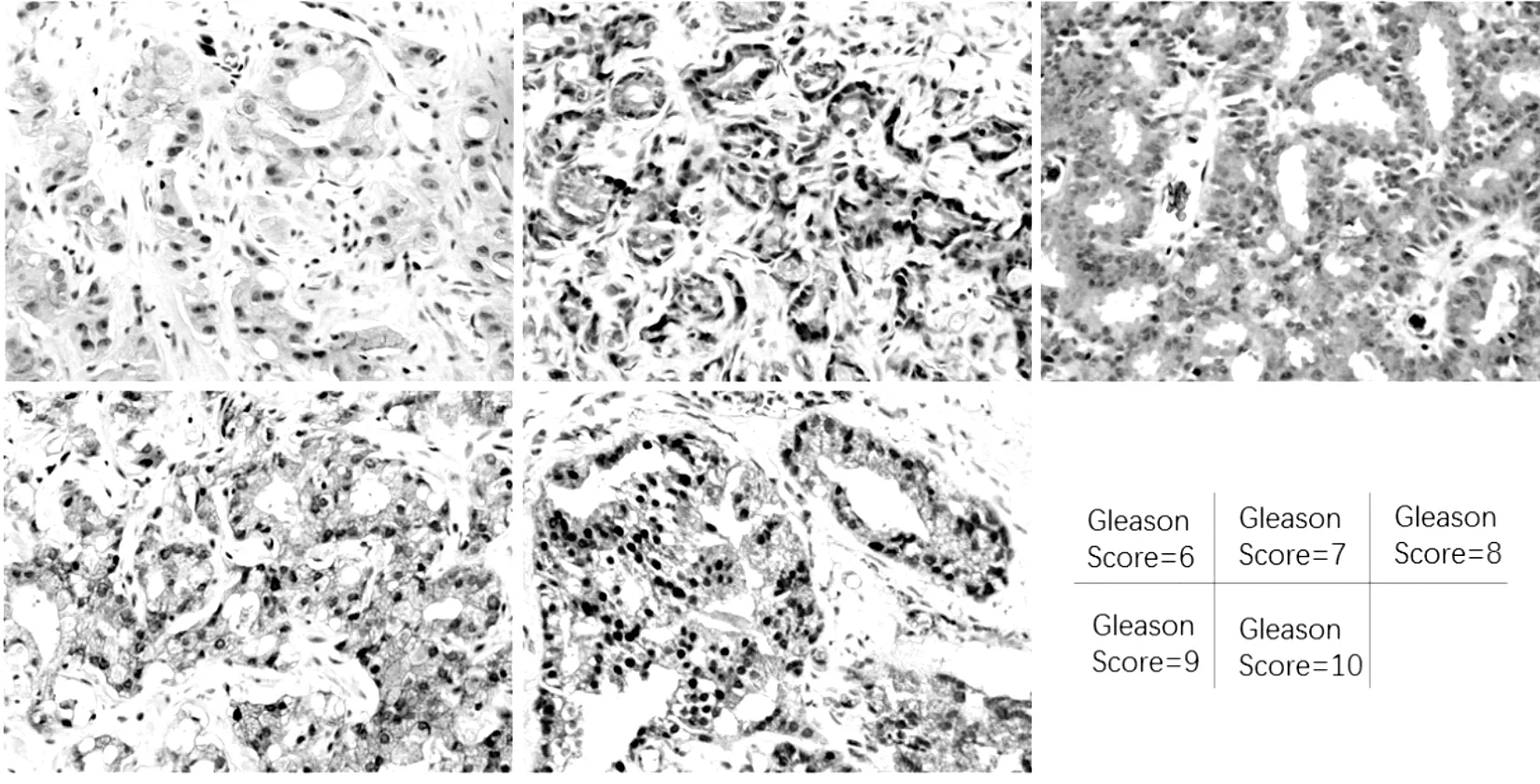
图2 前列腺癌组织中AKR1C3的表达
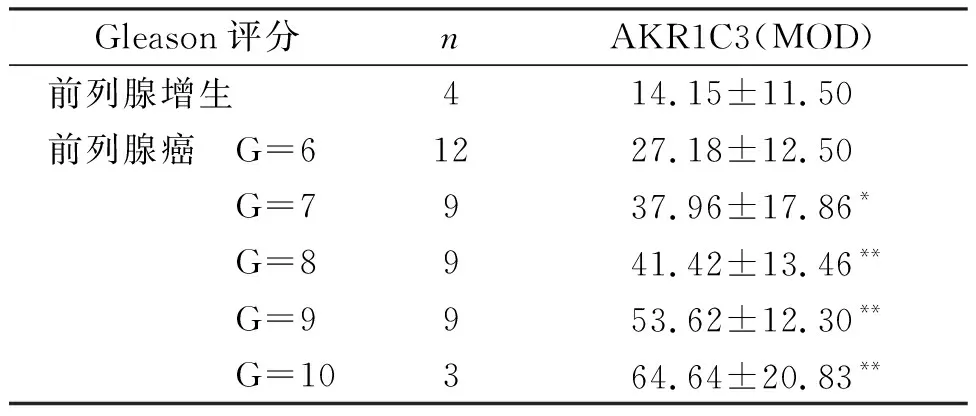
Gleason评分nAKR1C3(MOD) 前列腺增生414.15±11.50前列腺癌 G=61227.18±12.50 G=7937.96±17.86* G=8941.42±13.46** G=9953.62±12.30** G=10364.64±20.83**
与良性增生比较,*P<0.05,**P<0.01
3 讨论
目前关于前列腺癌进展的机制尚未阐明,但是雄激素信号通路再活化的两个机制已被广泛关注[7]。一是通过AR的过表达或突变,激活AR信号通路[8,9];二是肿瘤细胞利用胆固醇从头合成雄激素或加快肾上腺皮质激素的转化,进而激活AR信号通路[10,11]。有研究发现,ADT可诱导肿瘤内激素代谢酶活性上调,尤其是生成雄激素的关键酶AKR1C3。与正常前列腺组织和原位癌相比,骨转移癌和CRPC肿瘤样本中AKR1C3表达均显著增加[12]。而且AKR1C3表达增加与雄激素水平降低、去雄激素培养后前列腺癌细胞向干细胞转化密切相关[9],提示AKR1C3过表达可能是前列腺癌由激素依赖性向CRPC转化、前列腺癌中肿瘤干细胞调控复发的适应性变化。然而,AKR1C3表达水平与前列腺癌进展之间的关系尚不清楚。
在正常前列腺组织,基质细胞分泌的表皮生长因子(EGF)、纤维母细胞生长因子(FGF)和神经生长因子(NGF)等维持上皮细胞的生长与分化[13]。在前列腺上皮细胞恶性转化的过程中,恶变的上皮细胞适应性地获得雄激素自分泌能力,以维持肿瘤细胞自身的生长。在前列腺癌向去势抵抗性前列腺癌(CRPC)进展的过程中,AKR1C3作为关键酶,可催化Δ4-二酮和脱氢表雄酮(DHEA)转变为睾酮,5α-双氢睾酮(5α-DHT)转变为3α-二醇与雄烯二酮。在这一过程中,与合成双氢睾酮(DHT)相比,AKR1C3更倾向于通过旁路途径合成睾酮[14]。这些研究提示,AKR1C3过表达可能是维持肿瘤细胞发生发展的适应性改变。
为了验证这一假说,在本研究中,我们利用免疫组化染色的方法检测不同Gleason评分的前列腺癌穿刺样本中AKR1C3的表达水平,发现随着Gleason评分的提高,AKR1C3的表达水平逐渐升高,提示AKR1C3的过表达水平与前列腺癌的恶性程度紧密相关。而且前列腺癌与良性病变组织中,AKR1C3的表达分布存在差异。在前列腺良性增生组织内,AKR1C3表达主要集中在基质细胞,在Gleason评分>6的恶性前列腺癌组织内,AKR1C3的表达主要集中于上皮细胞。 这一结果提示,AKR1C3可成为评价前列腺癌进展的分子标志。
