骨桥蛋白与喉鳞状细胞癌发生及侵袭转移相关的Meta分析
2018-11-23关兵王茂华于爱民戴炳译严齐施淑君何庆庆
关兵 王茂华 于爱民 戴炳译 严齐 施淑君 何庆庆
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是临床上最常见的头颈部恶性肿瘤之一,其发病率逐年升高,特别是晚期喉癌患者的生存率较低,而导致其预后较差的原因为肿瘤的侵袭和转移,因此,揭示肿瘤侵袭和转移的机制,早期发现与喉癌侵袭转移相关的标志物,对于判断患者的预后和选择合理有效的治疗方案具有重要意义[1]。骨桥蛋白(osteopontin,OPN)是1979年首次由Senger等[2]发现的一种与恶性转化相关的磷酸化蛋白,近年来,多项研究表明,它与多种恶性肿瘤的发生、侵袭、转移密切相关。本研究拟通过对检索到的采用免疫组化检测OPN在喉鳞状细胞癌中表达的相关文献进行Meta分析,以探讨OPN表达与喉鳞状细胞癌发生、侵袭转移的关系及其临床意义。
1 资料与方法
1.1文献检索策略 通过计算机检索2005年1月~2017年12月Pubmed、Web of science、Embase、Cochrane Library、维普、中国知网及万方等数据库中骨桥蛋白与喉鳞状细胞癌发生、侵袭转移的相关研究文献,检索关键词为 “喉鳞状细胞癌”、“骨桥蛋白”、“Laryngeal squamous cellcarcinoma”、“osteopontin”,末次检索时间为2018年3月29日。
1.2文献纳入与排除标准 纳入标准:①研究对象为经临床手术及术后病理确诊的LSCC患者,且必须是病例对照研究;②采用免疫组化方法检测OPN;③存在多个期刊重复报道时,选用最新且样本量最大的文献;④文献需提供详细的OPN与临床病理特征关系的研究资料。排除标准:①剔除非论著文献,如:综述等;②剔除无对照组、检验方法非免疫组化、治疗方法采用或合并放化疗的文献;③剔除非中文、英文发表的文献;④剔除文献质量差、重复报告、未提供原始数据的文献。
1.3文献质量评价 本研究所纳入的是病例对照的文献,因此采用Newcastle-Ottawa Scale(NOS量表)[3]从研究对象选择、组间可比性、暴露因素的测量3个方面对文献进行质量评价,若得分≥5分,表示纳入文献质量较高,可被纳入Meta分析;若得分<5分,则表示纳入文献质量差,应被剔除。
1.4统计学方法 采用RevMan5.3统计软件对原始研究数据进行分析。用OR和95%CI来评价OPN和LSCC及其病理特征的关系。采用卡方检验对各研究的异质性进行评估,若无异质性(P>0.05),采用固定效应模型;若存在异质性(P<0.05),则采用随机效应模型。对异质性来源进行敏感性分析,并采用倒漏斗图评价文献潜在的发表偏倚。
2 结果
2.1文献检索结果 通过数据库检索关键词后初得到文献113篇,剔除重复文献及其他不符合标准的文献后得到21篇文献,其中中文16篇,英文5篇。经仔细阅读全文,剔除未提供详细原始数据的文献,最终纳入15篇文献[4~18],其中,LSCC组共有787例,对照组共有453例,筛选流程见图1,纳入文献的发表年份、病例数、病例特征及质量评分见表1;其中14篇文献对喉癌组和正常对照组、淋巴结转移组和无淋巴结转移组、中低分化组和高分化组、临床分期III/IV组和I/II组进行比较,9篇文献对男性组和女性组进行比较,9篇文献对年龄≥60岁组和年龄<60岁组进行比较,7篇文献对声门组和非声门组进行比较。

图1 文献筛选流程示意图

表1 纳入文献发表年份、病例数、病例特征及质量评价得分
注:A表示肿瘤发生(喉癌组织VS正常组织);B表示淋巴结转移(有VS无);C表示临床分期(Ⅲ/Ⅳ VS I/II);D表示组织分化程度(中低分化VS高分化);E表示性别(男性VS女性);F表示年龄(≥60岁VS<60岁);G表示肿瘤部位(声门VS非声门)。
2.2文献异质性检验 对各研究进行异质性检验,肿瘤发生、淋巴结转移、临床分期、组织分化程度、年龄、性别、肿瘤部位与OPN表达关系的研究均采用固定效应模型(异质性检验P值均>0.05)。
2.3喉癌发生与OPN表达的关系 喉癌组787例中检出OPN阳性558例(70.90%,558/787),正常对照组453例中检出OPN阳性84例(18.54%,84/453),合并OR为12.44,95%CI为9.13~16.95,合并效应量的检验结果Z=15.97,P<0.00 001,喉癌组OPN表达阳性率明显高于对照组,表明喉癌的发生与OPN的表达水平密切相关(图2)。

图2 喉癌组与正常对照组OPN表达水平对比的森林图
2.4淋巴结转移组与无淋巴结转移组OPN表达的关系 淋巴结转移组326例中检出OPN阳性287例(88.04%,287/326),无淋巴结转移组441例中检出OPN阳性265例(60.09%,265/441),合并OR为4.92,95%CI为3.32~7.31,合并效应量的检验结果Z=7.90,P<0.00 001,淋巴结转移组OPN表达阳性率明显高于无淋巴结转移组,表明OPN的表达水平与肿瘤的侵袭转移密切相关(图3)。
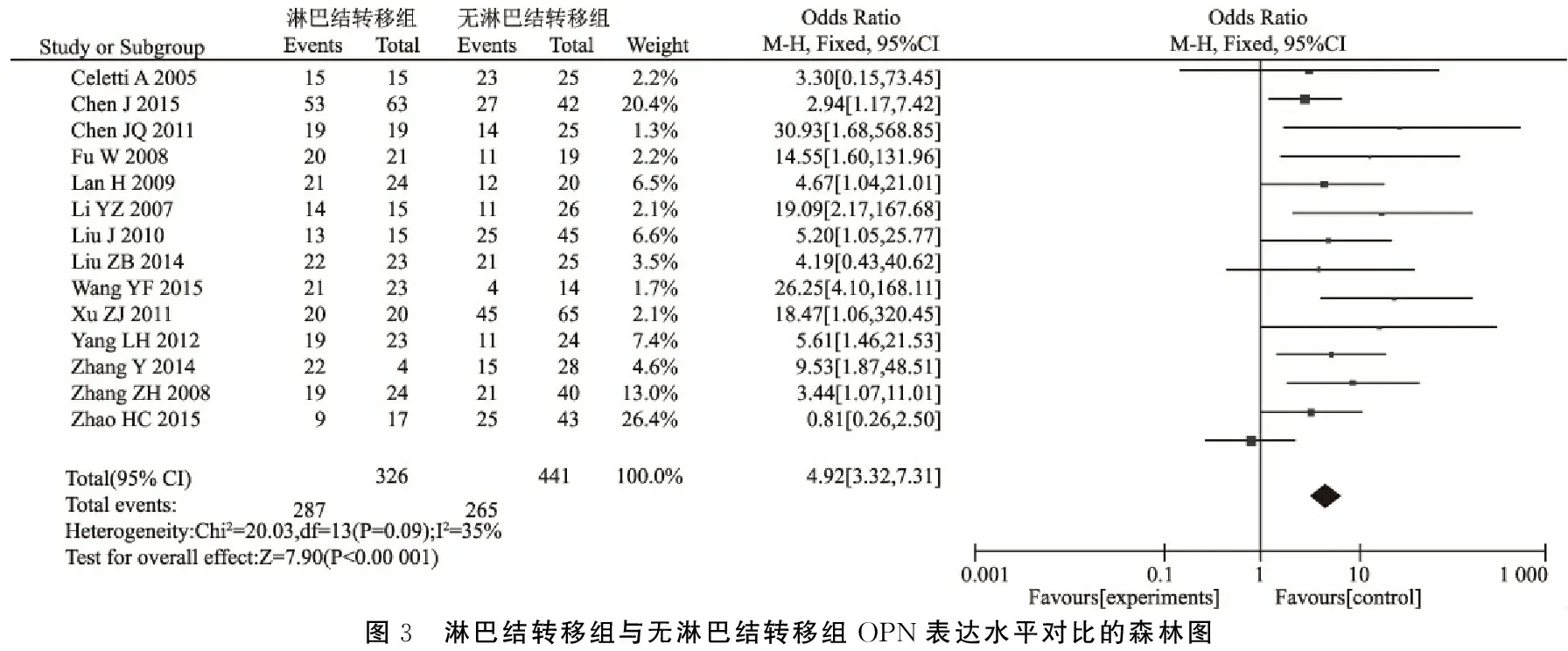
图3 淋巴结转移组与无淋巴结转移组OPN表达水平对比的森林图
2.5中低分化组与高分化组OPN表达的关系 中低分化组420例中检出OPN阳性348例(82.86%,348/420),高分化组365例中检出OPN阳性220例(60.27%,220/365),合并OR为3.39,95%CI为2.37~4.86。合并效应量的检验结果Z=6.69,P<0.00 001,中低分化组OPN表达阳性率明显高于高分化组,表明OPN的表达水平与肿瘤组织的恶性程度密切相关(图4)。

图4 中低分化组与高分化组OPN表达水平对比的森林图
2.6临床分期Ⅲ/Ⅳ期组与I/Ⅱ期组OPN表达的关系 Ⅲ/Ⅳ组400例中检出OPN阳性338例(84.50%,338/400),I/Ⅱ组385例中检出OPN阳性230例(59.74%,230/385),合并OR为4.67,95%CI为3.21~6.79。合并效应量的检验结果Z=8.06,P<0.00 001,Ⅲ/Ⅳ期组OPN表达阳性率明显高于I/Ⅱ期组,表明OPN的表达水平与肿瘤的发展及预后密切相关(图5)。

图5 临床分期Ⅲ/Ⅳ期组与I/Ⅱ期组OPN表达水平对比的森林图
2.7男性组与女性组OPN表达的关系 男性组419例中检出OPN阳性304例(72.55%,304/419),女性组70例中检出OPN阳性49例(70.0%,49/70),合并OR为1.01,95%CI为0.57~1.77。合并效应量的检验结果Z=0.03,P=0.98>0.05,男性组OPN表达阳性率与女性组无明显差异,表明OPN的表达水平与性别无关(图6)。

图6 男性组与女性组OPN表达水平对比的森林图
2.8声门组与非声门组OPN表达的关系 声门组252例中检出OPN阳性196例(77.78%,196/252),非声门组150例中检出OPN阳性105例(70.0%,105/150),合并OR为1.48,95%CI为0.93~2.38。合并效应量的检验结果Z=1.64,P=0.10>0.05,声门组OPN表达阳性率与非声门组无明显差异,表明OPN的表达水平与肿瘤的部位无关(图7)。

图7 声门组与非声门组OPN表达水平对比的森林图
2.9年龄≥60岁组与年龄<60岁组OPN表达的关系 年龄≥60岁组310例中检出OPN阳性223例(71.93%,223/310),年龄<60岁组179例中检出OPN阳性130例(72.63%,130/179),合并OR为0.93,95%CI为0.61~1.43。合并效应量的检验结果Z=0.32,P=0.75>0.05,年龄≥60岁组OPN表达阳性率与年龄<60岁组无明显差异,表明OPN的表达水平与年龄无关(图8)。

图8 年龄≥60岁组与年龄<60岁组OPN表达水平对比的森林图
2.10敏感性分析及发表偏倚的评估 采用改变效应模型、去除比重最高及最低项3种方法对上述Meta分析的结果进行敏感性分析(表2),重新进行Meta分析后,可见,P值较稳定且均大于0.05,所以上述Meta分析的结论并未发生改变,提示Meta分析稳定性好,结论较可靠。
采用倒漏斗图对上述Meta分析纳入文献的潜在发表偏倚进行评估(图9),漏斗图两侧图形基本对称,说明入选文献未发现潜在的发表偏倚。

图9 纳入文献潜在发表偏倚评估的倒漏斗图

表2 Meta分析各项指标的敏感性分析
3 讨论
骨桥蛋白(osteopontin,OPN)是一种分泌型多功能磷酸化糖蛋白,富含唾液酸、趋化因子、基质细胞,参与调节细胞功能,它的异常表达或剪接功能与疾病的发生及其病理特征相关,特别是癌症的不良改变,促进肿瘤的进展[19]。OPN可在乳腺癌、卵巢癌、肝癌、肺癌、胃癌、头颈部恶性肿瘤等多种肿瘤组织中异常表达,通过与其受体CD44、整合素结合,调节整体的信号转导,在肿瘤的发生发展及转移中起重要作用,其表达水平与肿瘤预后密切相关。因此OPN也被认为是肿瘤转移相关基因蛋白,并作为多种癌症类型的预后和诊断标志物,也被越来越多的学者探索成为可能的治疗靶点。
在全身其他肿瘤中,Xu等[20]通过Meta分析探讨了OPN表达与乳腺癌患者的临床病理特征及生存率的关系,发现OPN的表达与淋巴结转移、总体生存率及无病生存率呈正相关,认为OPN可作为判断乳腺癌患者预后的指标。Zhang等[21]通过Meta分析探讨了OPN表达与肝癌患者临床结局的关系,同时对肿瘤血管浸润或其他侵袭参数的相关性也进行了评估,结果显示OPN的过度表达与总体生存率、肿瘤血管侵犯和肿瘤分级有关,OPN的过度表达导致肝癌患者预后不良,可能对肝癌的侵袭转移有预测作用。Peng等[22]通过Meta分析评估OPN与肺癌患者生存率的关系,结果发现OPN过度表达对总体生存率不利,OPN的表达与肺癌患者预后不良有关。Gu等[23]通过Meta分析探讨了OPN对胃癌患者预后的影响以及OPN与胃癌患者临床病理特征的相关性,结果表明OPN的过度表达与总体生存率不良相关;此外,OPN过度表达与肿瘤淋巴结转移、TNM分期、浸润深度、肿瘤大小及远处转移相关,OPN可作为判断胃癌患者预后的生物标志物。
而在头颈肿瘤研究中,Qin等[24]证明OPN的表达与鼻咽癌的淋巴结转移、TNM分期及远处转移相关,肿瘤组织中OPN的上调促进了癌细胞的增殖和迁移,并抑制了癌细胞的凋亡。同时越来越多的研究结果显示,OPN在喉癌中有不同程度的表达,在喉癌的发生、发展和预后中可能扮演重要角色。本研究通过对OPN在喉癌中表达的相关临床文献Meta分析,共纳入15篇文献,均设置有喉癌组与正常对照组,由于Celetti[4]的研究并未在文中给出对照组中OPN具体的阳性例数,所以暂不将其纳入喉癌组与正常对照组的对比研究中,另14篇文献Meta分析结果显示,喉癌组的OPN阳性表达水平是正常对照组的12.44倍(95%CI为9.13~16.95),表明喉癌的发生与OPN的高表达有关。喉癌作为头颈部恶性肿瘤之一,常伴有淋巴结的转移,特别是声门上区的淋巴引流丰富,容易造成淋巴结的转移。在本研究中,淋巴结转移组中OPN的阳性表达水平明显高于无淋巴结转移组(OR=4.92,95%CI为3.32~7.31),表明OPN的高表达与喉癌的侵袭转移相关。在既往的一些报道中,OPN的表达与喉癌的临床分期、组织分化程度的相关性并不完全相同,而恶性肿瘤的临床分期及组织分化程度常常是临床上判断患者预后及选择合适治疗方案的关键指标;本研究对不同组织分化程度组的对比分析结果提示,中低分化组的OPN表达水平明显高于高分化组(OR=3.39,95%CI为2.37~4.86);而在不同临床分期的对比研究中,III/IV期的OPN表达水平明显高于I/II期(OR=4.67,95%CI为3.21~6.79),表明OPN的高表达与喉癌的发展及预后密切相关。此外,本研究也表明OPN的表达与喉癌患者的年龄、性别及肿瘤发生的部位无关;而对所有Meta分析的结论,通过敏感性分析进一步证实了它的可靠性,文献的选择通过对倒漏斗图的分析也没有发现明显的发表偏倚。
但本研究也存在一定的局限性,由于目前国内外对于OPN与喉癌关系的相关研究尚不多,导致检索时文献相对偏少,且纳入研究大部分为中文文献,质量偏低;对于一些可能造成偏倚的影响因素,如吸烟、饮酒、地域差异、人种差异等,仅一篇文献探讨了OPN表达与吸烟、饮酒的相关性,其余文献并未进行相应研究,故无法对其进行亚组分析而可能导致偏倚;部分正常对照组中组织来源为声带息肉,而大部分为癌旁正常组织,尽管未对Meta分析结论造成本质改变,但由于其对照基线不一致,也可能会导致一定的偏倚。因此,还需要国内外更多学者进行更多、更加完善的高质量病例对照研究来进一步证实OPN的表达与喉癌的发生及其临床病理特征之间的相关性,以期为喉癌的治疗和对预后的干预提供更加可靠的循证医学证据。
综上所述,本研究的结果表明喉癌组织中OPN的表达与正常组织具有显著的差异,其表达与肿瘤的发生、淋巴结转移、临床分期、组织分化程度密切相关,而与患者的年龄、性别、肿瘤的发生部位无明显关系,说明OPN在喉癌的发生、发展及转移中发挥重要的作用,其表达水平与肿瘤的恶性程度呈正相关,可能是评估预后不良的指标。
