固相萃取-高效液相色谱法同时测定蔬菜制品中11种合成着色剂
2018-11-22刘剑波余莲芳朱明扬高炜
刘剑波,余莲芳,朱明扬,高炜
(岳阳市食品质量安全监督检验中心,湖南岳阳414000)
着色剂即使食品赋予色泽和改善食品色泽的物质。食用着色剂分为人工合成着色剂和天然着色剂两大类。人工合成着色剂由于着色力好,色彩鲜艳,色调多样,成本低廉等原因在食品中被广泛使用[1-2]。中国允许在食品中添加的人工合成着色剂依据GB2760-2014《食品安全国家标准食品添加剂使用标准》有:柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、酸性红、喹啉黄、赤藓红共11种[3]。人工合成着色剂种类繁多,人体摄入超过一定量,可引起慢性中毒,致突变性、致畸性、致癌性等风险增加。蔬菜制品是指以蔬菜和食用菌为原料,采用腌制、干燥、油炸等工艺加工而成的各种产品,包括酱腌菜、蔬菜干制品、食用菌制品、其他蔬菜制品。蔬菜制品是我国传统的加工方法,在中国居民的膳食结构中,蔬菜制品是深受喜爱的一种佳品。蔬菜在加工过程中容易退色或变色,因此常常在加工过程中添加食用着色剂以改善其感官色泽[4-7]。GB2760-2014中规定:人工合成着色剂柠檬黄、苋菜红、靛蓝、胭脂红、亮蓝在腌渍蔬菜中允许使用,其限量分别为:0.1、0.05、0.01、0.05、0.025 g/kg。而新红、日落黄、酸性红、喹啉黄、诱惑红、赤藓红不得在蔬菜制品中使用[3]。目前GB 5009.35-2016《食品安全国家标准食品中合成着色剂的测定》中利用聚酰胺吸附法和液-液分配法(适用于含赤藓红的样品)对柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、亮蓝、赤藓红这8种人工合成着色剂进行了检测[8]。GB 5009.141-2016《食品安全国家标准食品中诱惑红的测定》规定了食品中诱惑红的测定方法[9]。SN/T 1743-2006《食品中诱惑红、酸性红、亮蓝、日落黄的含量检测》规定了食品中诱惑红,酸性红,亮蓝,日落黄的检测方法[10]。DBS 32/012-2016《食品安全地方标准食品中喹啉黄的检测》中规定了食品中喹啉黄的检测方法[11]。要同时检测这11种色素,需要采用4种标准方法。因此建立一种蔬菜制品中11种人工合成着色剂的高通量检测方法对于实际应用是非常必要的。本文旨在建立一种利用固相萃取-高效液相色谱法同时测定蔬菜制品中这11种着色剂的方法,简化前处理步骤,优化色谱条件,一次检测,提高日常监督检测的针对性和效率。
1 材料与方法
1.1 材料与试剂
检测样品为2017年岳阳市食品质量安全监督检验中心从本市内抽取的蔬菜制品如香辣榨菜、剁椒风味包、老坛酸菜包、酸豆角、麻辣海带、油炒萝卜、藕片、莴笋片、香辣金针菇、酸笋风味包、盐渍生姜、芋头条、冬瓜片、南瓜脆片、秋葵脆片、黄瓜片、红薯干、土豆条、原味香菇、脱水胡萝卜。
甲醇、乙腈(色谱纯):美国TEDIA公司;乙酸铵(≥98%):J&K科技;25%氨水、乙醇、柠檬酸、甲酸(分析纯):国药集团化学试剂有限公司;试验用水均为超纯水。
柠檬黄、苋菜红、胭脂红、日落黄、诱惑红、赤藓红、亮蓝标准溶液:中国计量科学研究院;新红标准溶液:农业部环境保护科研监测所;靛蓝(90.0%)、喹啉黄(97.2%):Dr.Ehrenstorfer公司;酸性红(90.7%):曼哈格公司。
1.2 仪器与设备
U3000超高效液相色谱仪(配有二极管阵列检测器)、Smart 2pure超纯水机:美国赛默飞公司;H1850R高速冷冻离心机:湖南湘仪仪器有限公司;BAS224S电子分析天平:德国赛多利斯股份公司;RE-2000B旋转蒸发器:上海亚荣生化仪器厂;KQ-600E超声波清洗器:昆山市超声仪器有限公司;涡旋仪QL-866:海门市其林贝尔仪器制造有限公司;Sepline-S4全自动固相萃取仪:莱伯泰科;Oasis WAX固相萃取小柱(150 mg/6 cc):美国 Waters公司。
1.3 方法
1.3.1 样品处理
准确称取样品1 g至2 g于10 mL离心管中,加入5 mL25%的氨水乙醇,涡旋混匀后超声提取10 min,高速冷冻离心10 min(4℃,10 000 r/min)后立即将上清液转入鸡心瓶中,残渣重复提取2次,合并3次上清液。40℃减压旋转蒸发至5 mL左右,用水转移入玻璃管中,用200 g/L柠檬酸调pH值至5.0左右,待Oasis WAX小柱净化。将净化柱装入全自动固相萃取仪,把进样管和收集管放入指定位置,编辑相应的方法管理程序,填充试剂通道并清洗进样针之后,依次按照方法用6 mL甲醇和6 mL纯水润洗小柱,上样时过柱的速度设置为1.0 mL/min,不收集滤液。再用甲醇∶甲酸∶水=2∶1∶7(体积比)的溶液10 mL淋洗小柱,干燥时间设置为10 s。最后用15 mL10%氨化甲醇洗脱,收集洗脱液,干燥时间设置为15 s。取出洗脱液于50℃氮吹至近干后,用2 mL 20%甲醇水溶液溶解残渣,过0.45 μm聚四氟乙烯(poly tetra fluoroethylene,PTFE)滤膜,待测。
1.3.2 标准溶液的制备
配制 0.2 μg/mL~40 μg/mL 浓度范围的柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、酸性红、喹啉黄、赤藓红的混合标准溶液。现用现配。喹啉黄主要由4个峰组成(分别为QYNa2Ⅰ、QYNa2Ⅱ、QYNaⅠ、QYNaⅡ),本方法把4个峰设为一组,由软件进行组校准。
1.3.3 色谱条件
色谱柱:Agilent 5 TC-C18(2)250 mm×4.6 mm;柱温30℃;流动相A:甲醇 ∶乙腈(4∶1),流动相B:0.02 mol/L乙酸铵;流速1 mL/min;液相色谱流动相梯度洗脱程序见表1,多通道检测,柠檬黄、喹啉黄415 nm,新红、苋菜红、胭脂红、日落黄、诱惑红、酸性红、赤藓红515 nm,靛蓝、亮蓝610 nm。

表1 液相色谱流动相梯度洗脱程序Table 1 Gradient elution program of liquid chromatography
2 结果与分析
2.1 前处理条件的优化
2.1.1 样品提取
本文研究的蔬菜制品对象主要分为腌制蔬菜、脱水蔬菜和膨化蔬菜三大类。通过参考文献以及国标方法主要考察甲醇-水溶液、乙醇-氨水-水溶液以及氨水-乙醇溶液对样品中色素的提取效果,甲醇-水溶液的提取液浑浊,不利于转移上清液以及过柱,而膨化蔬菜具有一定的油脂,脱水蔬菜吸水性较强,所以不宜采用水比例较大的提取液。其中氨水-乙醇作为提取溶剂,样品中的色素提取较为完全。通过试验发现随着氨水-乙醇溶液中氨水浓度的提高,合成色素的溶出更加充分,但提取液却越浑浊,最后确定用25%的氨水-乙醇作为提取溶剂。超声后进行高速冷冻离心,然后立即转移上清液能更好地分离油脂和水层[12-16]。
2.1.2 样品净化
本文研究的11种有机合成着色剂都含有磺酸基团,因此选择弱阴离子固相萃取小柱Waters Oasis WAX(150 mg/6 cc)对样品进行净化处理。提取液浓缩转移后使用柠檬酸调pH值至5.0左右,可以使合成色素的磺酸基成电离状态,有利于提高色素在净化柱上的保留性和选择性。试验中使用含有一定甲酸的甲醇水溶液作为淋洗液既能有效地洗掉天然色素等杂质又能取得较满意的回收率。通过试验比较了氨水乙醇、氨水甲醇以及甲醇作为洗脱液时在净化柱上的回收率,氨化甲醇的使用结果较为满意。氨化甲醇溶液氨水所占的比例越高,洗脱能力越强,但不利于氮吹浓缩,最终确定氨化甲醇的浓度为10%。国标方法中含赤藓红的样品需要用液-液分配法单独处理,本文由于赤藓红在Oasis WAX柱上的保留性较强,所以加大洗脱液用量至15 mL。样品在最后定容时使用20%甲醇水溶液溶解残渣,有效地保证了赤藓红的回收率。过滤样品溶液时应选择吸附作用小的聚四氟乙烯(PTFE)滤膜[12-16]。
2.2 色谱条件的优化
2.2.1 流动相
检测时使用的流动相既要能够使目标物得到有效的分离,又要能改善峰形,提高灵敏度。本文选用甲醇∶乙腈(4∶1)作为流动相A,0.02 mol/L乙酸铵作为流动相B。乙腈的加入能显著地改善峰的不对称性,提高灵敏度。而在流动相中作为调节剂的无机电解质的加入对于改善可电离物质的分离以及获得一个合理且较短的分析时间是很有必要的。乙酸铵缓冲溶液的浓度定为0.02 mol/L,乙酸铵的浓度越大,由于盐析效应增强导致分析物与色谱柱固定相的作用增强,因此分析物的保留时间增加[16]。乙酸铵缓冲溶液的浓度为0.02 mol/L时,溶液pH值约为6.5,所有着色剂都以中性化合物存在,以便发生反相机制,因此缓冲溶液的pH值无需优化。
2.2.2 梯度洗脱程序
本文使用4 μg/mL的11种合成着色剂的混合标准溶液来试验最佳的分离条件。最初9 min内有机相比例缓慢上升,使柠檬黄、新红、苋菜红、靛蓝达到有效分离。9 min至12 min,加快了有机相上升的速率,分离胭脂红、日落黄、喹啉黄,然后高有机相比例保持几分钟使诱惑红、酸性红、赤藓红、亮蓝依次洗脱下来,最后2 min回到初始流动相比例来平衡色谱柱。优化的梯度程序见表1。
2.2.3 检测波长
本试验采用二极管阵列检测器在190 nm~800 nm范围内进行全波长扫描,找到各个组分的特征吸收波长。结合梯度洗脱的分离效果以及各个组分的特征吸收,确定采用多通道检测这11种色素。在415 nm下检测柠檬黄、喹啉黄,在515 nm下检测新红、苋菜红、胭脂红、日落黄、诱惑红、酸性红、赤藓红,在610 nm下检测靛蓝和亮蓝。在以上检测波长条件下,各色素的同时检测互不干扰,能够实现准确地定性与定量。分离效果见图1。

图1 4 μg/mL的11种合成着色剂的混合标准溶液色谱图Fig.1 Chromatogram of mixed standard solutions of 11 synthetic colorants at 4 μg/mL
2.3 线性范围与检出限
在 0.2 μg/mL~40 μg/mL 范围内,以混合标准溶液的质量浓度X为横坐标,其相应的峰面积Y为纵坐标绘制标准曲线。11种合成色素的质量浓度与其峰面积呈良好线性关系,检出限以3倍信噪比计算。各色素的检测波长、保留时间、线性方程、相关系数及检出限见表2。
2.4 回收率与精密度
以未检出色素的酸菜包作为空白基质,制作1、2、10 mg/kg 3个水平的加标样品,上述每个添加水平做6次平行测定,回收率及相对标准偏差见表3。
由表3可知,在1、2、10 mg/kg 3个添加水平时,11种色素的加标回收率在87.5%~102.6%,相对标准偏差在1.5%~5.8%,由此可见该方法有较高的准确性和可靠性。

表2 11种合成色素的检测波长、保留时间、线性方程、相关系数及检出限Table 2 Detection wavelength,retention time,linear equation,correlation coefficient and detection limit of 11 synthetic colorants

表3 空白酸菜包样品中11种色素加标回收率及相对标准偏差Table 3 Spiked recoveries and RSDs of 11 synthetic colours in blank samples
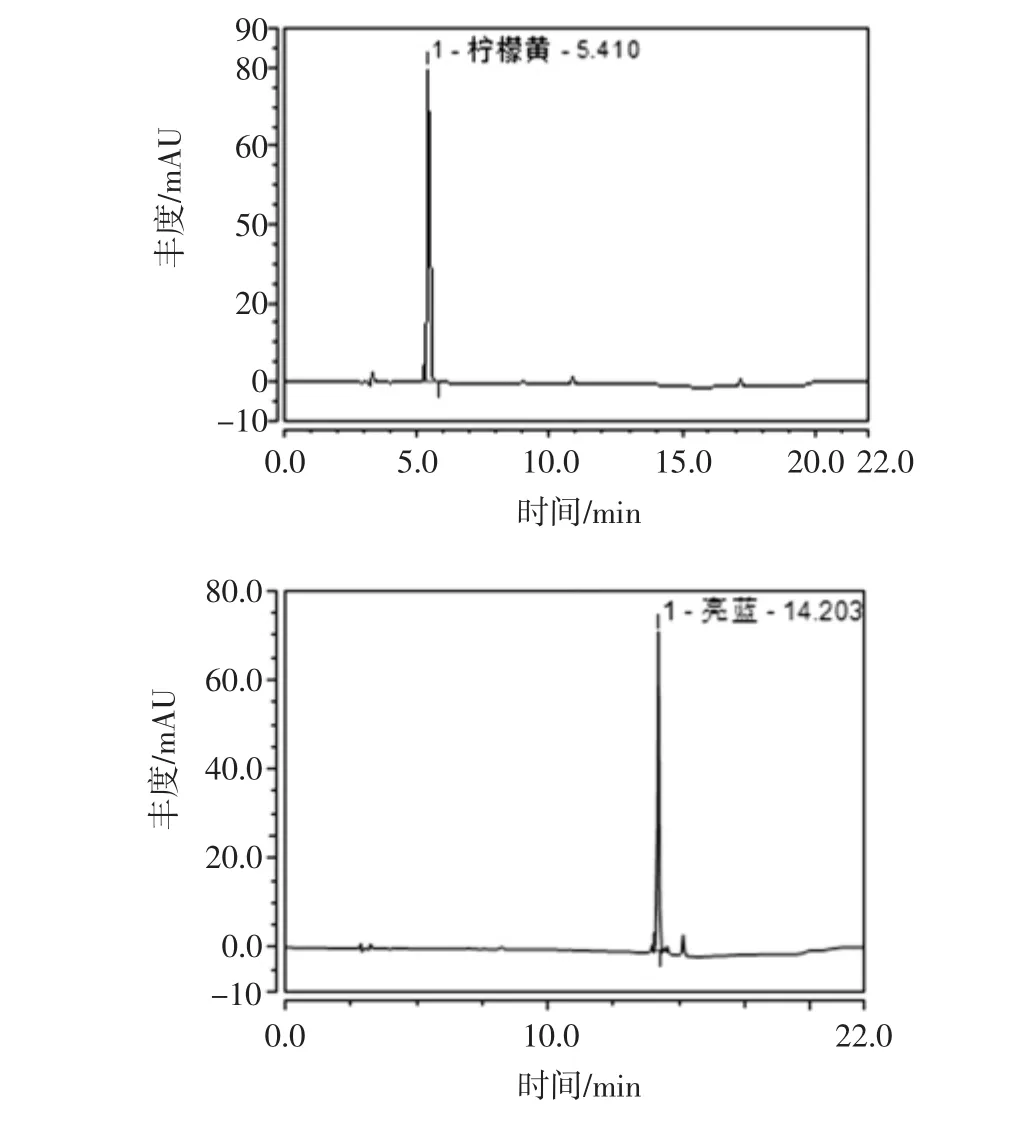
图2 检出人工合成色素的样品色谱图Fig.2 Sample chromatograms for detection of synthetic colorants
2.5 实际样品分析
采用该方法对岳阳市食品生产厂家生产的蔬菜制品进行了50批次的检测,检测结果显示在腌渍蔬菜制品中添加柠檬黄的现象比较普遍,其含量均未超出GB 2760-2014中0.1 g/kg的限量规定。对于腌渍水和蔬菜一起包装的蔬菜制品,应取可食用的腌渍蔬菜部分进行检测。此外,在少数膨化蔬菜制品中有一定的亮蓝检出。检出合成色素的酸豆角和黄瓜片样品的色谱图见图2。酸豆角中柠檬黄的检出结果为0.024 g/kg,黄瓜片中亮蓝的检出结果为0.009 g/kg。
3 结论
本方法采用弱阴离子固相萃取小柱进行前处理,梯度洗脱,多波长同时测定蔬菜制品中11种人工合成着色剂,改变了传统方法一次只能检测少数色素的状况,且具有操作简便,准确度高、精密度好的优点。样品提取后,采用全自动固相萃取仪进行净化,大大提高了检测效率,节约了人力成本。本方法在实际样品检测应用中结果良好,能满足日常蔬菜制品的监管检测需求,具有实际应用价值。
