荧光光谱法研究柠檬黄与溶菌酶的相互作用
2019-02-21
(衡水学院 化工学院,河北 衡水 053000)
柠檬黄是一种具有水溶性的合成色素,大量用于糕点、膨化食品、饮料、糖果、药品的着色。食用合成色素在人身体内的运载、分布及生理上的毒性与溶菌酶蛋白质的结合紧密相关,因此研究食用合成色素与溶菌酶的结合具有重要的意义。溶菌酶与药物的相互作用方面的文献报道很多[1-3], 但研究溶菌酶与食用合成色素结合相互作用的报道则较少。
本文主要采用荧光光谱法探讨了柠檬黄与溶菌酶之间的相互作用,探讨了柠檬黄与溶菌酶两者之间相互作用的猝灭机理,并考查了柠檬黄与溶菌酶两者相互作用的结合常数、结合位点数和结合热力学参数,还通过三维荧光光谱探讨了柠檬黄对溶菌酶结构的影响以及溶菌酶构象变化的具体信息。
1 实验部分
1.1 仪器与试剂
主要仪器: FA2204B电子天平(上海精密科学仪器股份有限公司);水浴锅;日立F-7000荧光分析仪;TU-1901双光束紫外可见分光光度计。
试剂:柠檬黄(天津多福源实业有限公司);二次蒸馏水;溶菌酶(上海伯奥生物科技有限公司)。
溶菌酶标准储备溶液:2×10-5mol·L-1,柠檬黄标准溶液:1×10-4mol·L-1。本实验所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 方法
1.2.1 荧光光谱分析
分别向10支比色管中移取1.0×10-4mol/L的柠檬黄标准溶液0、0.1、0.2、0.4、0.6、0.8、1.2、1.6、2.0、3.0mL再分别加入2×10-4mol/L溶菌酶标准溶液1mL,再向比色管中加入二次蒸馏水定容,配制成柠檬黄-溶菌酶体系溶液,配制3组,每组10支比色管,对每组在水浴锅水浴加热10min使温度稳定至291℃、306℃和323℃。将柠檬黄-溶菌酶体系溶液分别置于比色皿中,设置激发波长为280 nm、荧光分光光度计的激发狭缝宽度和发射狭缝宽度均为5.0 nm,在300~450nm波长范围内进行三种不同温度荧光光谱扫描,测定不同温度不同浓度的柠檬黄的柠檬黄-溶菌酶体系溶液的荧光强度。
1.2.2 同步荧光光谱分析
室温下,分别移取1.0×10-4mol/L的柠檬黄标准溶液0.00、0.20、0.40、0.80、1.20、1.60mL于6支比色管中,再分别加入2×10-5mol/L溶菌酶标准溶液1mL,再向比色管中加入二次蒸馏水定容,配制成柠檬黄浓度不同的柠檬黄-溶菌酶体系溶液,移至1 mL比色皿中,于日立F-7000荧光分析仪上,分别扫描激发285nm、发射300nm和激发285nm、发射345nm下的该体系溶液的在300~450 nm波长范围内进行扫描。
1.2.3 三维荧光光谱分析
室温下,分别向两支10mL比色管中移取1.0×10-4mol/L的柠檬黄标准溶液0mL和0.40mL和2×10-5mol/L溶菌酶标准溶液1mL,再向比色管中加入二次蒸馏水定容,配制成柠檬黄-溶菌酶体系溶液。将上述两种溶液分别于激发狭缝宽度和发射狭缝宽度为5.0 nm,激发波长为275 nm、发射波长为340 nm进行光谱扫描,对溶液于一定波长范围内进行荧光光谱的扫描,测定溶液荧光强度。
2 结果与讨论
2.1 柠檬黄-溶菌酶体系的猝灭机理
2.1.1 荧光光谱
柠檬黄-溶菌酶体系的荧光光谱,结果见图1。
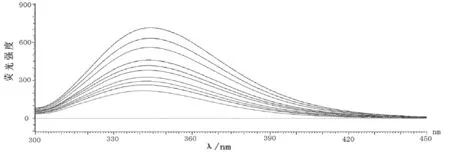
图1 柠檬黄浓度对溶菌酶荧光强度的影响
荧光猝灭通常按照Ksv与温度的数学函数关系划为静态猝灭和动态猝灭两种,如果两者之间成反比,则属于静态猝灭,反之,则属于动态猝灭。我们可以将不同温度下的荧光光谱图按Stern-Volmer方程(1)处理得到图2。
F0/F=1+Ksv[Q]=1+Kqτ0[Q]
(1)
式中:F0、F分别为加入柠檬黄前后溶菌酶的荧光强度;Ksv为猝灭常数,L·mol-1;[Q]为柠檬黄的浓度,mol-1·L;Kq是速率常数,L·mol-1·s-1;τ0为无猝灭剂存在下荧光分子的平均寿命,s。
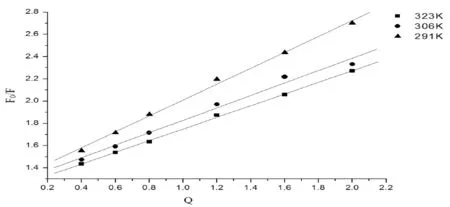
图2 不同温度时柠檬黄对溶菌酶的荧光猝灭Stern-Volmer曲线
根据曲线的斜率能求出在291K、306K、323K温度下时的动态猝灭常数Ksv分别为分别为7.15×104,5.59×104,5.25×104L·mol-1。通过查阅文献可以得知蛋白质的荧光寿命τ0为10-1s,所以根据方程(1)可以得到猝灭过程的速率常数Kq分别为7.15×1012,5.59×1012,5.25×1012L·mol-1。试验结果中相关系数分别为0.9983,0.9938,0.9995,说明曲线呈线性,而且随着温度的增高,曲线的斜率降低,说明只存在一种猝灭方式。各种猝灭剂对生物大分子的最大扩散碰撞猝灭常数约为2.0×1010L·mol-1·S-1,而根据方程(1)得到猝灭常数远大于2.0×1010L·mol-1·S-1,因此判断柠檬黄对溶菌酶的猝灭过程属于静态猝灭。
2.1.2 柠檬黄与溶菌酶的结合常数
静态猝灭的结合常数和结合位点数可以通过方程(2)[4]处理得到图3。
lg[(F0-F)/F] =lgKA+nlg[Q]
(2)
式中:F0、F分别为加入柠檬黄前后溶菌酶的荧光强度;K为结合常数,L·mol-1;n为结合位点数;[Q]为柠檬黄的浓度,mol-1·L;结果见表1。在不同的温度体系下结合常数K的103,说明两者之间的结合作用较大。

图3 不同温度下柠檬黄对溶菌酶荧光猝灭的双对数图
2.1.3 热力学参数和作用力类型
柠檬黄与溶菌酶反应过程中的自由能变以及焓变和熵变可以根据根据公式(3)~(5)[55]求得,计算结果详见表1。
ΔrGm=-RTlnKA
(3)
ΔrHm=T1T2/(T2-T1)Rln(KA2/KA1)
(4)
ΔrGm =ΔrHm-TΔrSm
(5)
式中△S为熵变,kJ·mol-1·K-1;△G为自由能变,kJ·mol-1;△H为焓变,kJ·mol-1;KA为结合常数,L·mol-1。由表1可知,三个△G均小于零,说明柠檬黄和溶菌酶之间的相互作用是自发进行的,两者之间的主要结合力为范德华力和氢键。

表1 柠檬黄与溶菌酶之间的热力学参数
2.2 柠檬黄-溶菌酶体系的同步荧光光谱
分别将测定条件中的Δλ设定为15和60nm,扫描即可得到溶菌酶在加入柠檬黄前后酪氨酸和色氨酸残基的同步荧光特征光谱[6],结果见图4。

图4 柠檬黄浓度对溶菌酶同步荧光光谱的影响
通过分析同步荧光光谱图可知,荧光强度随着柠檬黄浓度的增加而降低,溶菌酶的峰形基本不变,柠檬黄的引入对体系周围环境的极性有些改变,而且酪氨酸残基的荧光降低比色氨酸残基更显著,说明主要是酪氨酸残基发生猝灭。
2.3 柠檬黄-溶菌酶体系的三维荧光光谱
实验考查溶菌酶加入柠檬黄前后的三维荧光光谱,其中(λex/λem=275nm/340nm)为溶菌酶的特征峰见图5。由图5说明:加入柠檬黄后,溶菌酶的荧光强度大幅度降低,说明柠檬黄对溶菌酶的猝灭很大,两者发生了相互作用。特征发射峰不发生变化,说明加入柠檬黄之后没有改变溶菌酶所处的空间,不引起构象变化。


图5 柠檬黄浓度对溶菌酶三维荧光光谱的影响
4 结论
本次实验主要对柠檬黄与溶菌酶的相互作用采用荧光光谱法进行了研究,通过对两者的光谱图进行了分析,分析表示柠檬黄对溶菌酶具有荧光猝灭特性,主要模式为静态猝灭;通过对柠檬黄与溶菌酶的相互作用光谱进行了分析,得知柠檬黄的加入使得溶菌酶的空间结构不稳定,构象发生了变化;通过热力学参数焓变和熵变得出柠檬黄与溶菌酶的主要作用是静电引力。
