腹腔镜手术治疗全内脏反位合并胃癌患者的安全性分析
2018-11-20沈杨超汪进国陈贤军
沈杨超,汪进国,陈贤军
(皖南医学院弋矶山医院,安徽 芜湖,241000)
全内脏反位是罕见的先天性疾病,其特征是胸部、腹部脏器的完全镜像移位。当这样的患者出现腹腔内器官疾病时,诊断有一定困难,并且手术治疗也具有挑战性。需要对解剖学变化、术中人体工程学的改变及对反解剖学操作技能的熟练掌握[1]。目前关于为全内脏反位患者行腹腔镜手术的报道仍不多见,其中大部分为腹腔镜胆囊切除术,而关于腹腔镜胃癌根治术的研究鲜有开展,其手术安全性及术后并发症报道不一。本文现结合1例临床病例总结全内脏反位患者行腹腔镜辅助全胃根治性切除术的经验,以期为手术治疗提供帮助。
1 资料与方法
1.1 临床资料 患者男,76岁。因“中上腹部胀痛不适四月余”于2017年12月12日入院。患者在4个月前无明显诱因出现中上腹部持续性胀痛不适,餐后明显,无恶心、呕吐、呕血、黑便、畏寒、发热;患者就诊当地医院,行胃镜检查,结果提示:胃癌。病理诊断为低分化腺癌。入院体检:神清,胸廓无畸形,右侧胸锁骨中线四、五肋间可见心尖搏动,并可叩出心界,闻及心音。左侧胸腔叩诊呈清音,叩不出心界,双肺呼吸音清。腹软,上腹部轻压痛,无反跳痛及肌紧张,肝脾未触及。超声心动图提示:右位心,升主动脉增宽,左室收缩功能正常。实验室及影像学检查:血常规正常,尿常规提示红细胞增多,凝血功能结果正常,肝功能、电解质及空腹血糖等指标未见明显异常。肿瘤标记物:癌胚抗原6.61 ng/mL,糖类抗原199 42.54 U/mL。我院病理切片会诊示:(胃体活检)低分化腺癌。心电图提示(左右手反接,胸导联向右反接)右位心。胸片提示镜面右位心(图1)。腹盆腔CT检查:(1)全脏器反位;(2)胃底-体小弯侧局部胃壁异常增厚,强化,胃小弯侧少许增大淋巴结,考虑胃癌;(3)双肾少许囊肿;(4)前列腺钙化灶(图2)。结合病史、体检及辅助检查诊断为胃癌,胸腹腔脏器反位。
1.2 手术方法 患者取人字位,术者立于患者左侧,助手立于患者右侧,扶镜手立于两腿之间。术中腹腔镜探查示:肝脏位于左侧,脾脏位于右侧,胃底胃大弯位于右侧,幽门及十二指肠位于左侧(图3)。继续探查,见肿瘤位于胃体部,大小约8 cm,质硬、侵及浆膜层,未侵及周围组织,胃周淋巴结可见部分肿大。将大网膜向头侧掀起,由横结肠上缘无血管区分离胃结肠韧带,紧贴胰头表面分离并夹断胃网膜右动静脉,清扫No.6淋巴结。继续以胰腺作为重要解剖标志,沿胰腺上缘用超声刀暴露胃左静脉,近根部夹闭、切断。顺延暴露肝总动脉,沿动脉鞘解剖,清扫No.8淋巴结。同时在胰腺中部暴露分离腹腔干、胃左血管束、脾动脉近段,清扫No.7、No.9、No.11p淋巴结。沿脾门解剖、离断胃脾韧带至贲门左侧,清扫No.2淋巴结,并依次夹闭切断胃短动脉。沿胃十二指肠动脉向上,于胃右动脉根部夹闭切断,清扫No.5淋巴结。打开肝十二指肠韧带,暴露肝固有动脉,清扫No.12a淋巴结。沿肝下缘离断小网膜至贲门右侧,清扫No.1、No.3淋巴结。完成腹腔镜辅助根治性全胃切除术。消化道重建选择行食管空肠Roux-en-Y吻合。时间为210 min,术中出血量约20 mL。

图1 胸部DR平片示右位心

图2 腹部CT示腹腔内脏反位,胃底-体小弯侧胃壁异常增厚。

图3 术中腹腔镜所见腹腔解剖结构
1.3 术后结果 手术顺利完成。术后第1天引出约300 mL淡血性液体,第2天引出250 mL,第3天引出约250 mL,第6天通气后予以流质饮食,第7天拔除导尿管,第8天排便,第11天行消化道重建后造影(图4),第12天出院,未发生相关并发症。术后病理示:胃贲门胃体小弯侧溃疡型中-低分化腺癌,Lauren分型肠型;癌性浸润面积约7.0 cm×6.5 cm;癌组织侵及胃壁浆膜层;神经见癌侵犯,脉管内疑有癌栓;标本上、下切缘及送检(吻合口)未见癌组织累及;贲门周围找见淋巴结3枚,3枚见癌转移(3+/3),找见癌结节1枚;小弯侧找见淋巴结5枚,5枚见癌转移(5+/5),找见癌结节1枚;大弯侧找见淋巴结6枚,6枚见癌转移(6+/6);幽门上找见淋巴结1枚,1枚见癌转移(1+/1);幽门下未找见淋巴结,找见癌结节1枚。免疫组化标记结果(201712189):癌细胞ECadherin(膜+)、p120(膜+)、C-erbB-2(0)、CD31及 D2-40 显示脉管内癌栓存在,Ki-67(60%,+)。自2017年12月15日手术至今,患者已接受两次循环化疗,目前未发现肿瘤复发或转移,亦未发生相关手术并发症。

图4 术后消化道重建后造影
2 文献复习
全内脏反位患者又称为“镜面人”,是极为罕见的人体内脏解剖变异的先天性疾病,一般可分为腹腔内脏器反位与完全性胸腹腔内脏器反位,全内脏反位发病率为1/(10 000~50 000)[2]。全内脏反位除位置异常外,其功能完全正常,对人的生长、活动无明显影响,一般少有临床表现,多为体检时偶然发现。胃癌是消化道常见的恶性肿瘤之一,但全内脏反位合并胃癌的病例报道较少。从数据库Pubmed中通过检索词:(situs inversus or levocardia)and(cancer or tumor or carcinoma)and(gastric or stomach)得到文献60篇,其中涉及全内脏反位合并胃癌的文章38篇;在中国知网、重庆维普及万方数据库检索:全内脏(反位/转位)与胃癌/胃肿瘤发现相关文献11篇。检索及筛选文献流程均经两位研究人员独立完成,共得到与本研究主题相关文章49篇,其中1篇为术后护理体会报道。报道全内脏反位合并胃癌的病例48例,患者均接受手术治疗,其中14例行腹腔镜手术,患者术后均恢复顺利,未发生并发症,见表1。
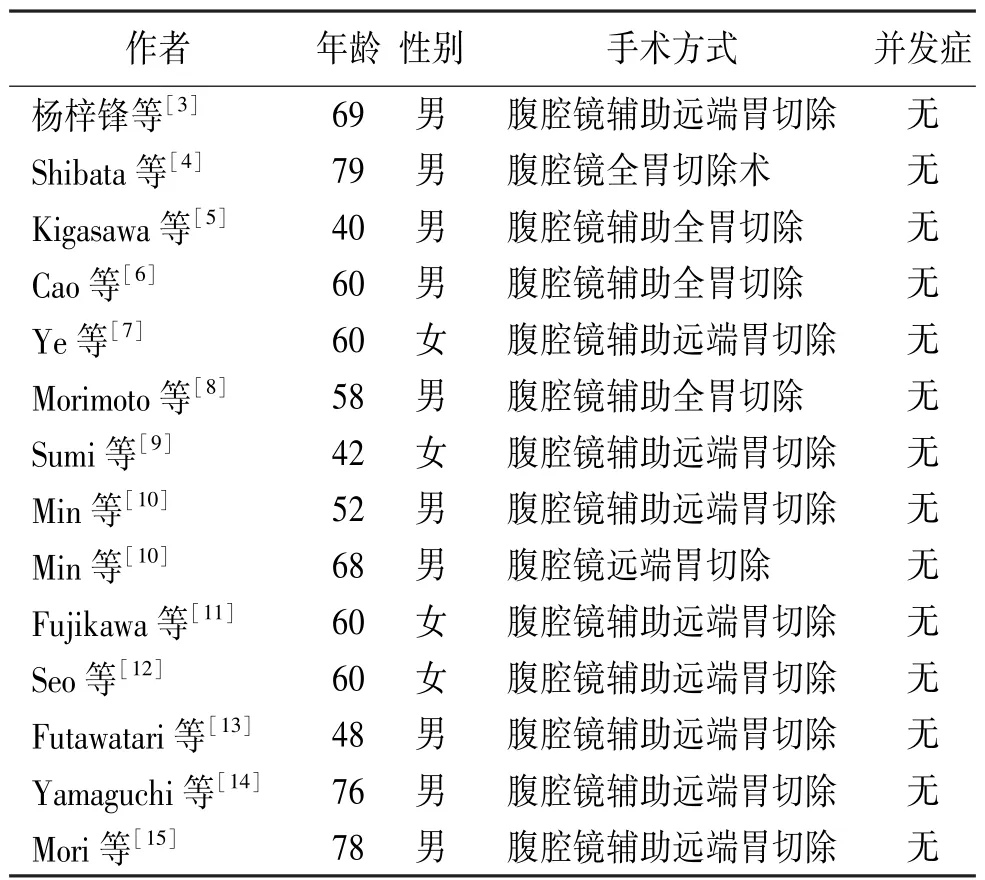
表1 文献报道的14例腹腔镜手术治疗全内脏反位合并胃癌患者的一般资料
3 讨 论
胃癌是消化系统中发病率较高的一种恶性肿瘤,在全球恶性肿瘤发病率中居第四位,而东南亚的胃癌发病率一直居高不下,我国每年约有40万人新发胃癌,约30万胃癌患者死亡。对于可接受治疗的胃癌患者,手术切除是唯一可能治愈的方法[16]。自首例腹腔镜辅助远端胃大部切除术成功病例被报道以来,腹腔镜胃癌手术得到较好发展,且随着腹腔镜技术的发展及大量临床研究对腹腔镜手术治疗胃癌患者有效性及安全性的肯定,腹腔镜手术在胃癌患者中得到广泛应用。相较传统开放手术,腹腔镜手术具有术野清晰、创伤小、疼痛轻、并发症少等优势,且利于术后康复。
本例患者为罕见的全内脏反位合并胃癌,目前我国此类病例数量较少,更多病例的积累有助于更好地了解其特征与风险,可促进患者的治疗、手术或其他干预措施的顺利开展。我们结合此特殊病例,就此类患者临床诊断与术中需要注意的事项总结如下:(1)因为全内脏反位的临床表现及体征部位与正常位置相反,如果未能发现内脏反位,会给诊断带来较大困难。因此完善相关术前检查是非常必要的,超声心动图、胸部X线、CT、心电图等影像学检查对诊断全内脏反位均有极大帮助。据报道,先进的诊断成像技术,如3D重构腹部CT或血管造影术,有助于证明血管、器官的结构,也是一种最理想的非侵入性诊断方式,最大限度地对血管解剖进行精确评估。全内脏反位患者的解剖变异并不仅仅与位置有关。全内脏反位合并无颌畸形已被报道过。研究表明,全内脏反位的患者可能伴有胸部异常症状(包括小叶间隔缺损、肺动脉狭窄、法洛四联征、大血管转位)及腹部异常症状(包括左右肝脏对称分布、脾脏缺失或多脾症、肠道异常、十二指肠闭锁或狭窄、泌尿系统异常)。部分全内脏反位患者也可能并发心脏疾病,包括家族性长QT综合征。除了畸形,全内脏反位患者由于KIF3复合体的异常可能会有更高的癌症风险。尽管全内脏反位患者通常是无症状的,但在某些临床情况下却经常出现[6]。目前全内脏反位的病因尚不清楚,人们认为,全内脏反位具有常染色体隐性遗传的变异倾向,可能造成胚胎期节点纤毛不流动,使胚胎外流体的流动受到抑制,从而导致疾病的发生。近年研究表明,KIF3复合体(一种细胞内运动蛋白)、细胞粘附因子(包括N-cadherin与β-catenin)参与了内脏反位的变化过程,以及同步癌症的发生与进展[17]。但目前全内脏反位与胃癌相关的病理机制间的病因学关系在很大程度上仍是未知的。(2)本例手术采用腹腔镜辅助技术,其手术时间虽较传统开放手术长,但手术切口相对较小,对患者肠胃内脏器官干扰也较轻,且对机体免疫影响较小,因此更利于促进患者的术后恢复。腹腔镜手术中可借助腹腔镜的放大效果廓清淋巴结,清扫淋巴结过程中可获得较为清晰的层次,因而具有出血少、并发症少、术中副损伤少等优势。借助腔镜系统局部清晰放大的作用,术中按局部淋巴结精细清扫、清扫区域流畅过渡的原则进行操作,明确相关解剖结构,注意解剖结构的反位走向,并借助毗邻的解剖结构关系进行识别与确认。值得注意的是,因为患者器官反转,必须时刻注意保持逆向思维,术中沉着、冷静、仔细地对待每一次操作,尤其操作视野过渡时,主刀、助手及扶镜头需统一转移方向,以免在反转的腹腔解剖结构中迷失,增加手术时间。
本研究提示合并全内脏反位的胃癌患者行腔镜辅助胃癌根治术是安全、可行的,且具有创伤小、康复快的优势,至于远期生存情况仍需大样本的长期随访结果进行分析。
