黑曲霉葡萄糖氧化酶基因改造及其在毕赤酵母中的表达
2018-11-20聂金梅李阳源刘金山
聂金梅, 李阳源, 刘金山, 王 勇, 唐 业
(广东溢多利生物科技股份有限公司,广东珠海 519060)
葡萄糖氧化酶(glucose oxidase,GOD),能专一地氧化β-D-葡萄糖成为葡萄糖酸和过氧化氢,反应产物葡萄糖酸可降低胃肠内pH值,为乳酸菌生长制造酸性环境。反应生成的过氧化氢具有灭菌作用,当过氧化氢积累到一定浓度时,直接抑制大肠杆菌、沙门氏菌、巴氏杆菌、葡萄球菌和弧菌的生长繁殖。因为具有天然无毒副作用的独特优点,葡萄糖氧化酶被广泛应用于食品加工、医药、葡萄糖定量分析及生物领域[1-3]。许多研究者对该酶的性质做了大量的工作,尤其对葡萄糖氧化酶的辅基黄素腺嘌呤二核苷酸(FAD)作了深入的研究[4],并给予详细的说明。Bentley等应用同位素18O2和H218O明确了在有过氧化氢酶存在下的一系列试验[5];Keilin等对黑曲霉的葡萄糖氧化酶的动力学及其作用形式也作了较详细的研究[6]。
葡萄糖氧化酶不仅能够代替抗菌药物,而且还能代替抗球虫药物,是一种新型绿色饲料添加剂。它还能除去葡萄糖,以防蛋白成品在贮藏期间变色、变质。用于全脂奶粉、谷物、可可、咖啡、虾类、肉等食品,可防止由葡萄糖引起的褐变。用于柑橘类饮料及啤酒等的脱氧,以防色泽增深、降低风味和金属溶出。由于葡萄糖氧化酶催化底物所生成的H2O2能使面筋中的-SH基氧化成S-S-基,有助于面筋蛋白之间形成较好的蛋白质网络结构,故近年来用于面包制造的效果良好,可用以代替可致癌的溴酸钾,受到愈来愈多的重视。此外,工业上还将葡萄糖氧化酶用于生产葡萄糖酸盐。
本研究克隆了来源于黑曲霉(Aspergillusniger)的葡萄糖氧化酶全长基因,综合运用了定点突变法、重叠PCR法获得了含突变基因的葡萄糖氧化酶基因,本研究首次去除葡萄糖氧化酶基因的信号肽,构建并筛选葡萄糖氧化酶毕赤酵母工程菌株的产酶活性有显著提高,为实现葡萄糖氧化酶工业化生产提供一种切实可行的方法。
1 材料与方法
1.1 材料
1.1.1 菌种 采用本实验室保存的黑曲霉。
1.1.2 仪器设备 基因扩增仪购于HEMA,电泳仪购于北京君意,基因导入仪购于Bio-rad,TG16-WS台式高速离心机、核酸蛋白凝胶图像分析系统购于HEMA,酶标仪购于Molecular devices,紫外分光光度计carybo UV-vis购于安捷伦公司。
1.1.3 主要试剂 限制性内切酶和连接酶购于NEB公司;酵母粉(OXFORD)、蛋白胨(OXFORD)、抗生素Zeocin&Amp购于Invitrogen公司;感受态细胞制备试剂盒购于上海生工生物工程有限公司;其他试剂均为国产分析纯产品。
1.1.4 培养基 大肠杆菌培养基为LB,LBA为LB培养基加100 μg/mL氨苄青霉素,LBZ为LB培养基加25 μg/mL Zeocin。酵母培养基为YPD,酵母筛选培养基为YPDZ(YPD+100 μg/mL Zeocin),BMGY酵母诱导培养基和BMMY(除了以0.5%甲醇代替甘油,其余成分与BMGY相同)。
1.1.5 酶活性定义 在pH值为5.5、温度为37 ℃的条件下,每分钟能把1.0 μmol的β-D-葡萄糖氧化成D-葡萄糖酸和H2O2所需的酶量称为1个酶活性单位(U)。
1.2 测定葡萄糖氧化酶活性方法
邻联(二)茴香胺分光光度法:在有氧条件下,葡萄糖氧化酶催化葡萄糖脱氢产生葡萄糖酸和过氧化氢,在辣根过氧化物酶作用下,过氧化氢和邻联(二)茴香胺反应,生成水和红色的氧化型邻联茴香胺。加入2 mol/L硫酸终止反应,在 540 nm 下测定反应液吸光值,依据酶活力标准曲线,从而换算为葡萄糖氧化酶的活性。
1.3 试验方法
1.3.1 表达载体的构建 首先根据葡萄糖氧化酶全基因序列,设计引物GODF/GODR、GODF(mut)/GODR(mut)(表1)。

表1 本研究所用引物序列
1.3.2 提取黑曲霉基因组 本试验所用的黑曲霉保藏编号是:CGMCC NO.4235,用察氏培养基培养,纱布过滤培养液,称取100 mg菌体,用液氮研细,加入到经65 ℃预热的装有700 μL PCB溶液的1.5 mL EP管中,混匀,再加入7 μLβ-巯基乙醇。其余操作参照真菌基因组DNA抽提试剂盒。将黑曲霉基因组置于-20 ℃保存。
1.3.3 克隆葡萄糖氧化酶基因 以黑曲霉基因组作为模板、引物GODF/GODR,通过PCR方法克隆葡萄糖氧化酶基因,PCR共35个循环,其中98 ℃ 30 s,98 ℃ 10 s,58 ℃ 30 s,72 ℃90 s,72 ℃ 120 s;经1%琼脂糖凝胶电泳分析,切胶回收约 1.8 kb 的片段。
1.3.4 定点突变法和重叠PCR法 本研究将GOD基因序列中的GAATTC序列突变为GAGTTC,针对该位点设计了1对突变引物GODF(mut)/GODR(mut),采用重叠PCR方法扩增其编码区基因序列。重叠PCR分PCR1和PCR2两步进行,扩增条件如下:
PCR共30个循环,其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃1 min,72 ℃ 2 min,72 ℃ 5 min。将PCR产物用1%浓度的琼脂糖凝胶进行电泳分析,分别切胶回收大小约为 0.96 kb 和0.88 kb的基因片段并纯化,置于-20 ℃保存,具体操作参照PCR纯化试剂盒。取5 μL纯化后的PCR产物进行琼脂糖电泳分析。以上述PCR1和PCR2产物片段为模板和引物,进行PCR扩增,PCR3共18个循环,其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃ 1 min,72 ℃ 4 min,72 ℃ 5 min。以PCR3产物为模板,以GODF及GODR为引物,进行PCR扩增,PCR4共40个循环,其中94 ℃ 5 min,94 ℃ 1 min, 61 ℃ 1 min,72 ℃ 4 min,72 ℃ 5 min。将PCR4产物用1%琼脂糖凝胶进行电泳分析,并切胶回收大小约1.8 kb基因片段,置于-20 ℃保存。取 5 μL 纯化后的DNA进行琼脂糖电泳分析。
取葡萄糖氧化酶突变基因GODmut以及pPICZαA各 20 μL,用NotⅠ和EcoRⅠ双酶切,37 ℃,3 h,T4连接酶连接,4 ℃ 过夜,转化大肠杆菌Top10。转化步骤如下:冰上放置 30 min,42 ℃孵育90 s,冰上放置20 min,加1 mL LB培养基后37 ℃振荡培养1 h,涂布LBZ平板,37 ℃培养过夜,挑取单菌落共20个,采用菌落PCR法鉴定阳性克隆子,菌落PCR条件如下:反应条件为94 ℃ 4 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,72 ℃ 10 min,30个循环。取10 μL PCR产物进行琼脂糖凝胶电泳分析。对阳性克隆进行酶切鉴定以及测序序列,DNA测序由华大基因完成。
1.3.5 去除葡萄糖氧化酶基因的信号肽 去除葡萄糖氧化酶基因序列中的信号肽,设计上游引物GODECONS,以葡萄糖氧化酶突变基因(GODmut)为模板、引物GODECONS/GODR扩增GODnew基因,经1%琼脂糖凝胶电泳分析,切胶回收约1.75 ku的片段。采用上述试验方法,酶切连接,转化及鉴定。
1.3.6 构建葡萄糖氧化酶毕赤酵母工程菌株 将重组质粒用限制性内切酶PmeI线性化,采用电击法将线性化的重组质粒转化至毕赤酵母X33,涂布于YPDZ平板,30 ℃下静置培养2~3 d,直至长出单菌落。
1.3.7 筛选高效分泌表达的葡萄糖氧化酶毕赤酵母工程菌株 挑取单菌落接种于装有5 mL BMGY的50 mL离心管中,于28~30 ℃、200 r/min培养,直到细胞密度达108(D600 nm为 1.2~1.6)时,添加甲醇至终溶度为0.6%,每隔24 h补加甲醇并留样,采用测定酶活性的方法初步筛选高产菌株,再以1%的量接种至装有50 mL BMGY的500 mL三角瓶中,用双层纱布封口,于28~30 ℃、200 r/min的摇床培养,复筛,分别得到高效分泌表达的葡萄糖氧化酶突变基因工程菌株和新葡萄糖氧化酶基因工程菌株各1株,将它们分别命名为X33-PIC-GODmut和X33-PIC-GODnew。
1.3.8 中试试验 50 L液体发酵罐采用蒸汽灭菌,发酵原料20 L,加水量为16 L,121 ℃灭菌24 min,然后冷却至室温;制备YPD液体种1 L,分为8瓶装,125 mL/瓶,接种葡萄糖氧化酶毕赤酵母菌株,220 r/min、30 ℃培养24 h;待发酵液冷却至室温后,接种菌液1 L。将上述工程菌株进行高密度发酵培养。配置20 L基本盐培养基,在50 L自动控制发酵罐中灭菌后,冷却至常温备用。用氨水和磷酸调节发酵液的pH值至6.0,通过调节转速和空气流量控制溶氧大于30%,发酵温度为30 ℃。整个发酵过程分3个阶段:第一阶段为菌体培养阶段,将重组菌X33-PIC-GODmut和X33-PIC-GODnew按照10%的接种量接种至发酵罐中,流加已灭菌的4 L 50%葡萄糖,培养24~30 h,以补充完葡萄糖为标志;第二阶段为饥饿阶段,当葡萄糖补完之后,不流加任何碳源,当溶氧上升至80%以上即表明该阶段结束,需30~60 min;第三阶段为诱导表达阶段,在此阶段,流加诱导培养基,并且保持溶氧在20%以上,培养时间在180~200 h之间。发酵液可通过陶瓷膜或超滤膜处理后获得酶液。在发酵过程中的不同时间点取样测定酶活。同样发酵条件下,将本实验室保藏的改造信号肽之前的葡萄糖氧化酶毕赤酵母菌株进行高密度发酵培养,诱导培养185 h的发酵液的酶活性为由原来的460.3 U/mL提高到了 714.9 U/mL。说明信号肽改造后的葡萄糖氧化酶毕赤酵母菌株能明显地提高了葡萄糖氧化酶的表达水平。
1.3.9 葡萄糖氧化酶活性分析 采用酶活力测定方法,在pH值为5.5的条件下,分别在30、35、40、45、50、55、60、65、70、80 ℃测定酶的活力;在37 ℃的条件下,分别在pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0时测定酶的活力;在测定葡萄糖氧化酶活性的体系中,加入20 mmol/L金属离子磷酸盐缓冲液溶解(pH值=5.0)至金属离子的终浓度为2 mmol/L,测定葡萄糖氧化酶的活性。
1.3.10 葡萄糖氧化酶SDS-PAGE蛋白电泳 制备浓度为5%的浓缩胶,凝固后,再加入12%的蛋白分离胶,收集工程菌株X33-pPIC-GODmut和X33-pPIC-GODnew185 h的发酵上清液,分别稀释12倍和15倍后,加入5×loading buffer,煮沸5 min使蛋白变性,电泳条件:电压100 V、2 h,用染色液染色2 h后,再用脱色液脱色至条带显色清晰。
2 结果与分析
2.1 葡萄糖氧化酶突变基因诱导表达载体的构建及鉴定
本试验克隆的葡萄糖氧化酶基因全长1 818 bp(图1),编码605个氨基酸,测序结果表明,它与登录号为FJ979866.1的基因完全一致,利用重叠PCR法扩增出含突变位点的2段葡糖糖氧化酶基因PCR1和PCR2,大小分别为960 bp和 880 bp(图2);构建重组质粒pPIC-GODmut,转化至Top10感受态细胞,利用通用引物5′AOX和3′AOX进行菌落PCR鉴定阳性转化子,结果如图3所示。

克隆新型葡萄糖氧化酶基因,大小为1 752 bp(图4)。利用特征引物GODECONS和GODR进行菌落PCR鉴定阳性转化子,结果如图5所示。
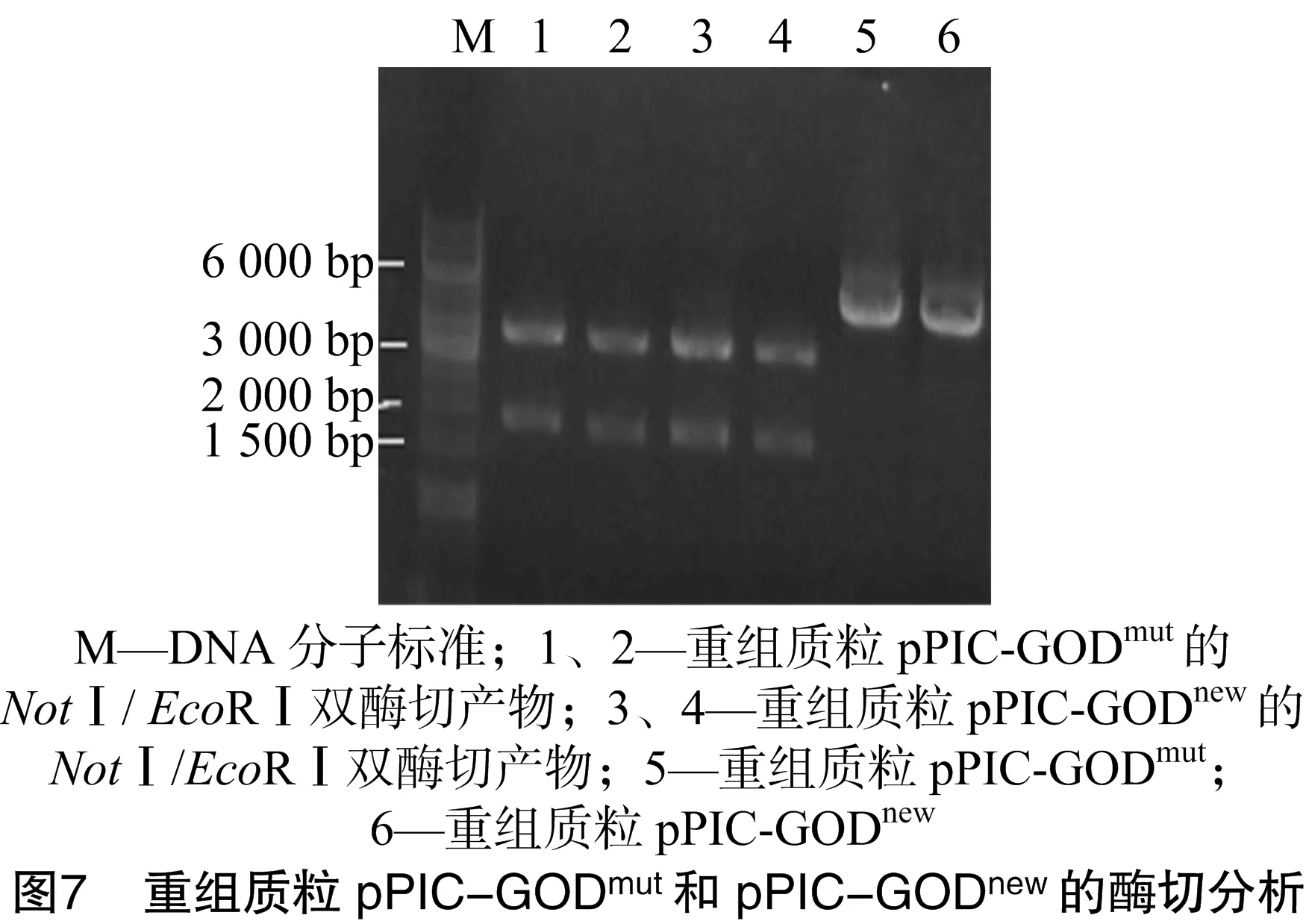
提取重组质粒pPIC-GODmut和pPIC-GODnew,用琼脂糖凝胶电泳鉴定(图6)和NotⅠ和EcoRⅠ酶切鉴定(图7),测序结果都表明成功构建重组质粒。

2.2 重组毕赤酵母表达菌株的诱导表达
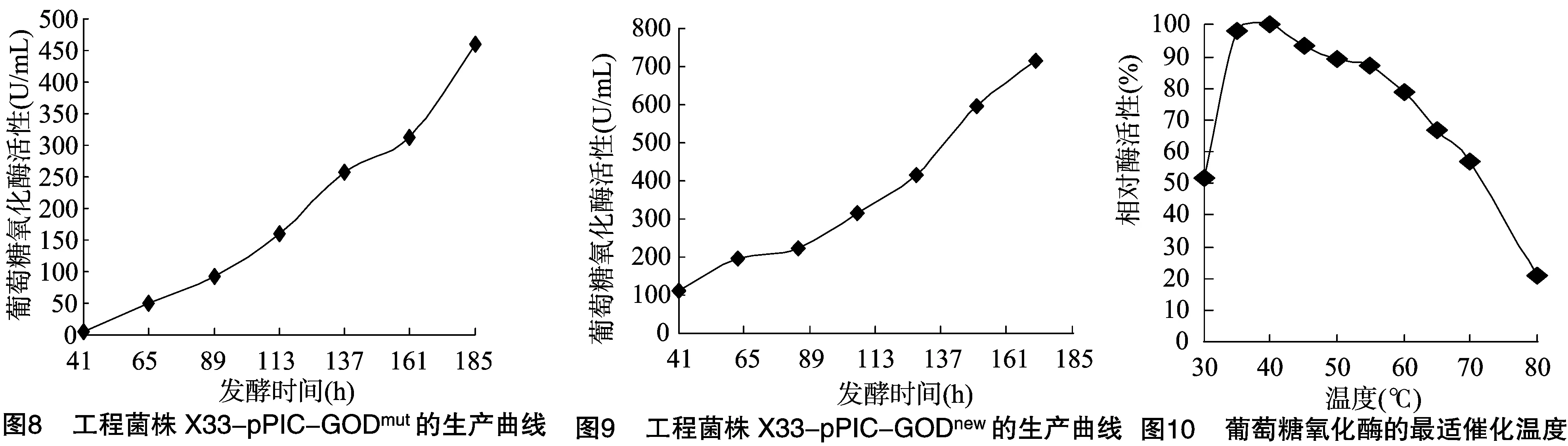
将筛选得到的高效分泌表达的工程菌株X33-pPIC-GODmut和X33-pPIC-GODnew,分别利用50 L液体发酵罐进行高密度培养,每24 h取样1次,测定葡萄糖氧化酶活性,发酵至185 h,X33-pPIC-GODmut的产酶水平为460.3 U/mL,X33-pPIC-GODnew的产酶水平为714.9 U/mL(图8、图9)。
2.3 葡萄糖氧化酶酶学性质分析
2.3.1 最适催化温度 在pH值为5.0的条件下,分别在30、35、40、45、50、55、60、65、70、80 ℃测定酶的活力,40 ℃时酶活力最高。以pH值5.0、40 ℃条件测定的酶活力为100%,80 ℃时酶活力急剧下降,仅为最高酶活力的20.9%(图10)。
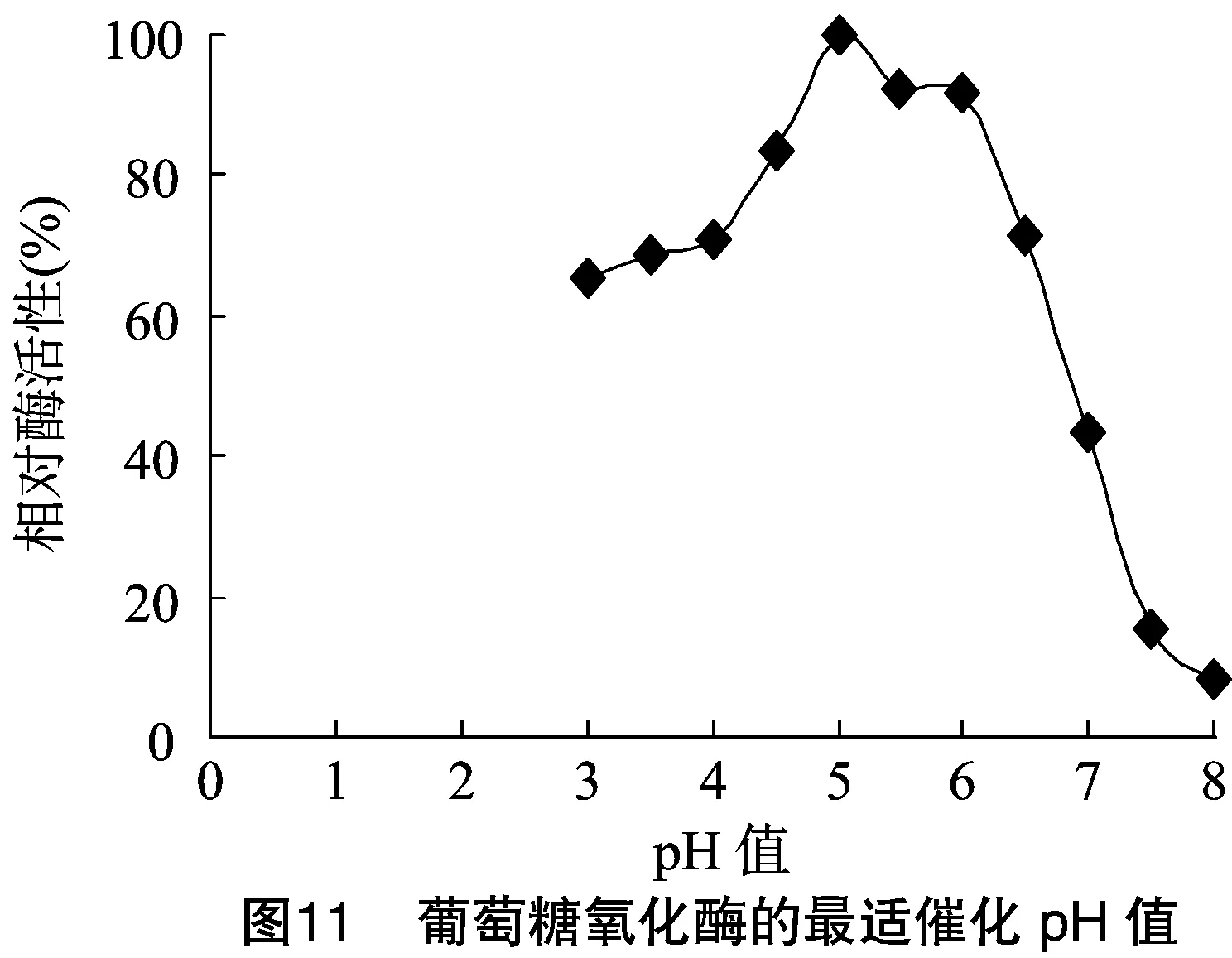
2.3.2 最适催化pH值 在37 ℃的条件下,分别在pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0时测定酶的活力,结果显示,在pH值为5.0时酶活力最高。以40 ℃、pH值5.0时酶活力为100%,pH值为3.0~6.0时相对酶活在50%以上,但在pH值为7.5时,相对酶活性低于20%(图11)。
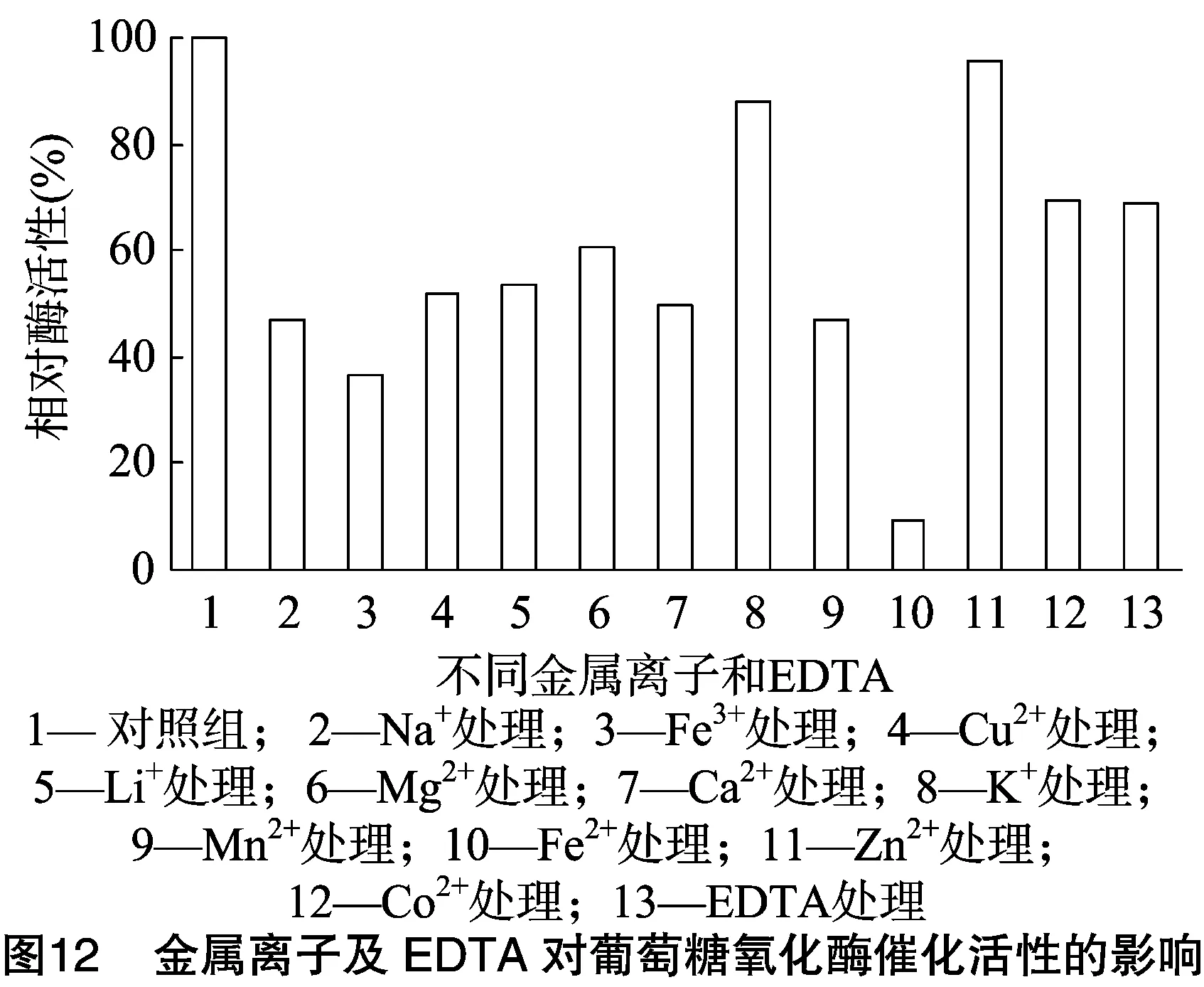
2.3.3 金属离子及乙二胺四乙酸(EDTA)对葡萄糖氧化酶催化活性的影响 采用酶活力测定方法,在测定葡萄糖氧化酶活性的体系中,加入20 mmol/L金属离子磷酸盐缓冲液溶解(pH值=6.0),至金属离子的终浓度为2 mmol/L,测定葡萄糖氧化酶的相对活力,进行3组平行试验,以未加入任何金属离子的葡萄糖氧化酶溶液作为对照组,结果如图12所示。
2.4 葡萄糖氧化酶发酵上清液蛋白电泳分析
将发酵上清液煮沸使其失活后,进行蛋白电泳分析,上样量均为30 μL,葡萄糖氧化酶大小为80 ku左右,结果如图13所示。

3 讨论
从黑曲霉(Aspergillusniger)分离的葡萄糖氧化酶是二聚体,由2个相等的亚基单元组成,每个分子量为80 ku。每个亚基单元含有1个黄素腺嘌呤的二核苷酸部分和1个铁。该酶是一种糖蛋白,含有16%的中性糖和2%的氨基糖。该酶也包含3个半胱氨酸残基和8个潜在的N-连接糖基化位点。葡萄糖氧化酶极具商业开发潜力,但其构象不稳定的特点大大限制了葡萄糖氧化酶的研究及应用。葡萄糖氧化酶的动力学特性以及其热稳定性,在很大程度上依赖它的氧化还原状态。蛋白的糖基化可影响活性位点的构象动力学并最终影响酶的活性[7],但糖基化以何种途径影响葡萄糖氧化酶稳定性目前尚不十分清楚。此外,葡萄糖氧化酶表面经合成的聚乙烯·乙二醇长链修饰后,其熔点升高,并且体外添加多元醇,如山梨醇或丙三醇,也可显著升高葡萄糖氧化酶的熔点。报道指出,黑曲霉葡萄糖氧化酶比青霉菌葡萄糖氧化酶更加稳定,但是青霉菌葡萄糖氧化酶的底物亲和力是黑曲霉葡萄糖氧化酶的7倍,其催化速率也接近黑曲霉葡萄糖氧化酶的4倍[8-10]。
本研究去除信号肽大小为69 bp,测定发酵上清液的酶活性结果表明,信号肽对葡萄糖氧化酶的活性产生很大的影响,究其原因是信号肽对分子构象的影响,所以,进一步研究其构象的变化有利于清晰掌握葡萄糖氧化酶的结构与酶学性质之间的关系,为深入研究和应用葡萄糖氧化酶提供理论基础。
4 结论
本研究通过改造黑曲霉葡萄糖氧化酶基因,提高了葡萄糖氧化酶在毕赤酵母表达系统的产酶水平,目前正在对黑曲霉葡萄糖氧化酶基因针对毕赤酵母密码子偏好性进行优化,构建优化后的黑曲霉葡萄糖氧化酶毕赤酵母基因工程菌株,以期获得产酶水平更高的工程菌株,并初步研究葡萄糖氧化酶分子结构对其活性的影响。
