硝化抑制剂DCD和NP对温室菜田土壤氮素转化及N2O、CO2排放的影响
2018-11-20臧祎娜周晓丽解东友梁晓娜贾剑波王金垚张丽娟
臧祎娜, 周晓丽,, 解东友, 梁晓娜, 贾剑波, 王金垚, 张丽娟
(1.河北农业大学资源与环境科学学院,河北保定 071000;2. 河北省农田生态环境重点实验室,河北保定 071000)
N2O作为重要的温室气体,其增温效应可达CO2的298倍[1]。据估计,大气每年80%~90%的N2O、5%~20%的CO2来自土壤[2]。为了追求高产,农民过量施肥,使氮肥的施用量持续增加,这大大促进了温室气体的排放[3]。与大田作物不同,高投入高产出的经营模式使设施菜田养分投入量很高,氮素积累现象特别明显[4]。据统计,至2010年年底,我国设施蔬菜栽培面积已经超过270 hm2[5];而到2015年,我国北方设施蔬菜面积突破102 533 hm2[6]。大量投入氮肥不仅利用率较低,造成资源浪费和面源污染,由此还产生大量N2O、CO2等温室气体,严重威胁生态系统安全。因此,研究提高氮肥利用率及温室气体减排的途径和机制具有重要的现实意义。土壤氮素转化过程调控以及N2O排放机制一直是研究的焦点,已有的研究围绕不同施氮量及田间管理对氮素转化的影响展开[7]。分析土壤氮素转化和循环过程,通过施加硝化抑制剂来调控转化,是提高氮素利用率、减排温室气体、优化农田生态系统的可行途径[8-9]。氮肥配施双氰胺、硫代硫酸钾矿质氮库铵态氮转化量分别显著降低了74.1%(P<0.01)、16.6%(P<0.05),氮肥与这2种抑制剂配施均不同程度地抑制了硝化作用,抑制率分别为35.5%~98.7%、82.2%~103.5%[10]。同时,也有很多研究集中于不同添加剂对露天菜地或种植小麦、玉米等粮食作物的大田中氮素转化以及N2O排放的影响[11-15]。雨养区种植春玉米的农田减量施氮同时添加硝化抑制剂双氰胺(dicyandiamide,简称DCD)降低了硝态氮峰值19.0%[16]。连续种植4季蔬菜的大田在各氮肥水平处理下,硝化抑制剂均能降低N2O排放量,抑制率为8.75%~25.28%,且这种减排效果随着施氮量的增加而增加[17]。
本试验通过室内静态培养,测定培养期内N2O、CO2排放通量、排放总量、无机氮含量及转化率,研究不同添加比例的硝化抑制剂2-氯-6-(三氯甲基)吡啶(nitrapyrin,简称NP)以及DCD对设施蔬菜田土壤氮素转化和CO2排放的影响,揭示土壤氮素损失的机制,旨在筛选效果最优的抑制剂及其添加量,对研制生化调控肥及农业生产应用具有现实意义。
1 材料与方法
1.1 供试土壤
试验于2015年8月30日至10月9日在河北农业大学生命科学楼实验室进行。供试土壤选用河北省廊坊市永清县大辛阁乡北岔口村蔬菜棚(种植年限为16年,前茬作物为番茄)耕层土壤,质地为沙质黏壤土,容重为1.2 g/cm3,pH值(水、土体积比=2.5 ∶1)为8.0,有机质含量为37.53 g/kg,碱解氮含量为114.80 mg/kg,速效磷含量为278.49 mg/kg,速效钾含量为307.19 mg/kg。试验前土壤去除草、杂物,过 2 mm 筛,在(25±1) ℃下避光培养1周。
1.2 试验设计与布置
在室温(25±1) ℃下,采用静态培养系统进行室内模拟试验。试验共设6个处理,每个处理9个重复,随机排列(表1)。
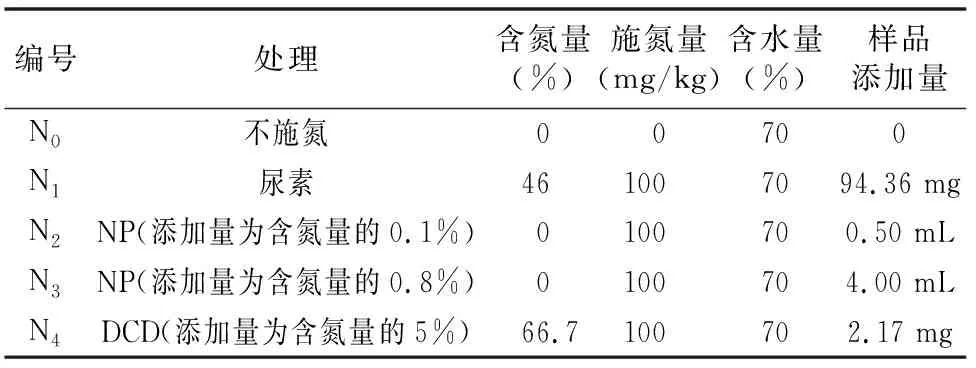
表1 试验主要成分设计
将预培养土样与不同添加物充分混匀后装入广口瓶(高17 cm,内径9.6 cm),广口瓶事先分别于距瓶底2.5、5.0 cm 处标记,土壤分2次装入并压实到标记刻度处,使广口瓶中土层高度为5 cm,样品容重与田间容重一致。装瓶完毕后,继续向瓶中土层喷洒蒸馏水,调节土壤含水量为田间最大持水量的70%,盖上封口膜(Parafilm膜,透气不透水),同时裹上黑色塑料袋避光,将样品随机放置在(25±1) ℃培养箱中培养 40 d。在培养期间每3 d称质量1次,根据初始瓶质量补加去离子水以保持土壤含水量恒定。
1.3 样品采集及测定
1.3.1 N2O和CO2装瓶后的第1、2、3、5、7、10、13、16、22、30、40天采集气体。采集时间为每天08:30—09:00,采气前揭开 Parafilm 膜5 min,充分通气,然后塞上橡皮塞富集气体。橡皮塞上连有三通阀,通过注射器与三通阀连接可以采集广口瓶顶部的气样,连续采集0、10、20 min的气体各1针,每针20 mL,同时记录温度。利用气相色谱仪(Agilent 7890A型)测定N2O、CO2气体样品浓度。
1.3.3 土壤pH值的测定 在试验开始、初期、试验结束时采集土壤样品,土样风干并通过1 mm筛,采用电位计法测定土壤pH值。
1.4 数据计算与统计分析
1.4.1 N2O通量 计算公式:
F1=273÷(273+T)×28×60×24×10-3×V×dC/dt÷22.4/0.465 67。
(1)
式中:F1为 N2O排放通量(N2O-N) ,μg/(kg·d);T为瓶内温度,℃;28为1 mol N2O分子中N的质量数;22.4为 273 K 时 N2O摩尔体积,L/mol;V为土壤表面上方的气体体积,L;C为N2O 气体浓度,nL/L;t为关瓶时间,min;dC/dt为广口瓶内N2O气体浓度的时间变化率,nL/(L·min)。
1.4.2 CO2通量 计算公式:
F2=273÷(273+T)×12×60×24×10-3×V×dC/dt/22.4÷0.465 67。
(2)
式中:F2为 CO2排放通量(CO2-C),mg/(kg·d);12为 1 mol CO2分子中C的质量数; dC/dt为广口瓶内 CO2气体浓度随时间的变化率,nL/(L·min)。
1.4.3 土壤NO3-、NH4+含量 计算公式:
M=C×[100+1.24×w]/24。
(3)
式中:M为土壤NO3-、NH4+含量,mg/kg(以氮计);C为浸提液中NO3-、NH4+浓度,mg/L(以氮计);w为土壤水的质量分数,%。
1.4.4 土壤表观硝化率 计算公式:
土壤表观硝化率=NO3--N 含量 /(NH4+-N 含量+NO3--N含量)×100%。
(4)
1.4.5 统计分析 数据采用Excel 2003、SPSS 16.0进行方差分析与统计分析,用最小显著差异法(LSD)作多重比较。
2 结果与分析
2.1 土壤N2O和CO2排放特征
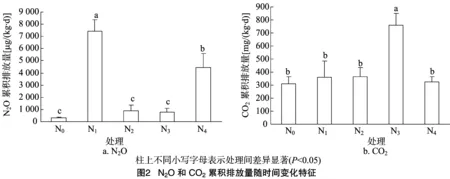
2.1.1 培养期间土壤N2O和CO2排放通量动态变化 由图1-a可知,对照N0的N2O排放通量最低,N1处理N2O排放通量最高,在第1天即达到最大值2 430.03 μg/(kg·d),之后逐渐减少;N4处理N2O排放通量仅次于N1处理,随时间的变化趋势与N1处理相同;N2处理的N2O排放通量低于N4处理,在第1天达到最大值,第3天则急剧减少,此后趋于平缓;N3处理的N2O排放通量峰值延后,第3天出峰至第5天后骤降,此后趋于平缓。N2、N3、N4处理的N2O排放通量峰值分别为311.63、336.46、1 435.07 μg/(kg·d)。
由图1-b可知,N0处理的CO2排放通量最低,在第5天达到峰值; N3处理CO2排放通量最高,呈现先上升后缓慢下降的趋势;N2处理随时间的变化趋势与N3处理大致相同,但其CO2排放通量低于N3处理。N4与N1处理的排放通量相差不大,培养前期CO2排放通量呈先上升后下降趋势,后期略有上升而后趋于平缓。
2.1.2 土壤N2O和CO2累积排放量 由图2-a可知,N0处理的N2O累积排放量最低,为308.35 μg/(kg·d);N1处理累积排放量最高,为7 450.94 μg/(kg·d);N4处理累积排放量比N1处理少40.44%,且差异显著; N2、N3处理的N2O累积排放量分别为872.16 、786.68 μg/(kg·d),2种处理间差异不显著,均显著低于N4处理,与N0处理差异不显著。
由图2-b可知,不施氮处理CO2累积排放量为 308.02 mg/(kg·d),低于其他处理; N3处理CO2累积排放量最高,为757.87 mg/(kg·d),显著高于其他处理。N1、N2、N4处理CO2累积排放量分别为360.04、367.35、325.03 mg/(kg·d),均显著低于N3处理,与N0处理没有显著差异。
2.2 培养期土壤无机氮含量的动态变化
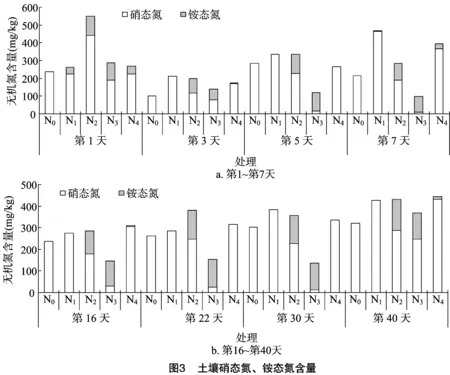
由图3可知,在培养期间,N0处理的土壤NO3--N含量呈现减—增—减—增的趋势。N1处理土壤NO3--N含量在培养前期先减少后增加,培养后期先减少后增加,总体高于其他各处理;土壤NH4+-N含量在第1天最高,第3天及其后均为0。N2处理的土壤NO3--N含量在第1天达到最大值,高于其他处理,第3天降到培养期最低值,培养后期整体呈增加趋势,但均低于N0、N1、N4处理;土壤NH4+-N含量总体变化趋势为先减少后增加,培养后期与N3处理相当。 N3处理的土壤NO3--N含量在培养期间均低于其他处理,总体呈现先减少后增加的趋势;而在培养期内土壤NH4+-N含量高于N0、N1、N4处理。N4处理土壤NO3--N含量与N1处理大体相当,总体呈先减少后增加的趋势;土壤NH4+-N含量在第1天达最大值,随后降低,第7天又增加,第7天后先减少后增加,低于N2、N3处理。

2.3 土壤表观硝化率
由表2可知,N0处理土壤表观硝化率在第3天就达到100.0%,随后不变;N1处理前期略有浮动,在第16天达到100.0%后不再变化; N2、N3处理的表观硝化率均低于其他处理,变化趋势大致相同,总体呈现先减少后增加的趋势,其中N3处理土壤表观硝化率整体最低;N4处理土壤表观硝化率高于N2、N3处理,总体呈现波动上升趋势。综上所述,N3处理的效果最佳,N2处理次之,N4处理对N2O抑制效果较差。
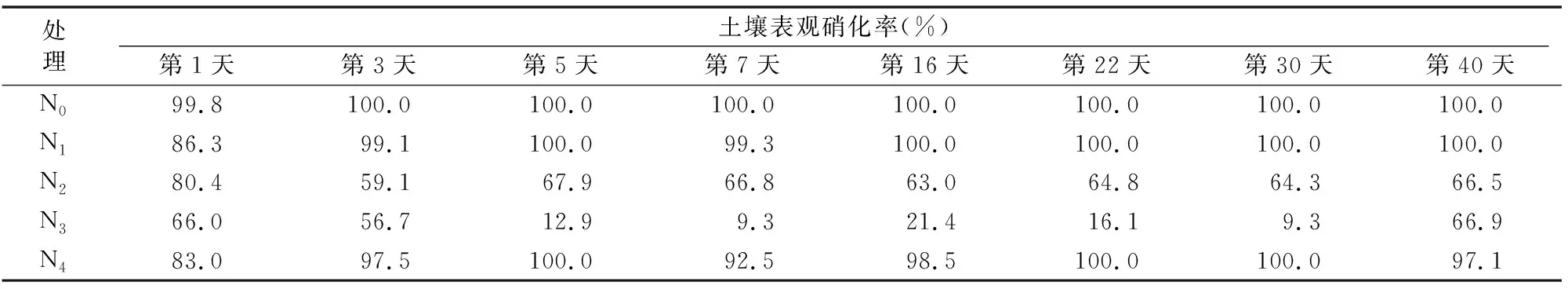
表2 不同处理土壤表观硝化率的动态变化
2.4 pH值
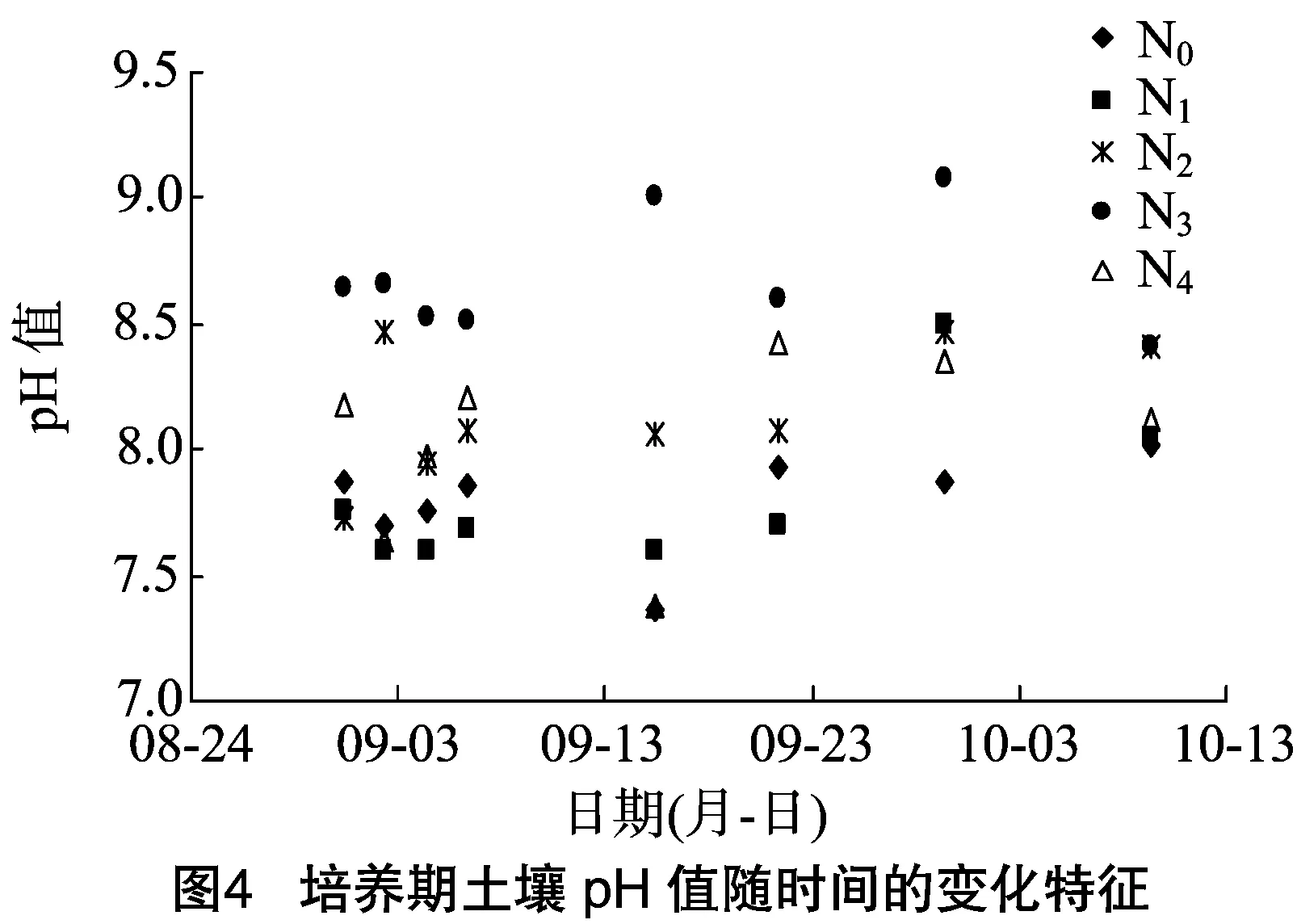
由图4可知,培养期间N0处理的pH值为7.30~8.00; N1处理的pH值为7.5~8.5; N2、N3处理的pH值高于对照处理,其中N3处理的pH值最高;N4处理的pH值总体高于N0、N1处理,且变化幅度较大。
3 讨论与结论
3.1 讨论
相关研究表明,设施蔬菜地典型种植模式(番茄—白菜—生菜) 下,减氮优化施肥配施硝化抑制剂处理的N2O年排放总量比传统施肥减少61.13%[17]。这与本试验结果类似,硝化抑制剂DCD与氮肥(N4处理)配施于温室菜地中,与只施尿素的N1处理相比,土壤N2O排放降低了40.44%。杨柳青等的研究发现,华北平原石灰性潮土施加硝化抑制剂NP、DCD能够降低87.4%~99.6%的N2O排放[18]。本试验中N2、N3处理的N2O累积排放量分别为872.16、786.68 μg/(kg·d),与N1处理(只添加尿素)相比分别下降了88.29%、89.44%,且2个处理间没有显著差异,表明不同浓度的NP抑制N2O排放的效果差异不大。
有研究表明,硝化抑制剂可选择性地抑制土壤硝化微生物的活动,有效减缓土壤中铵态氮向硝态氮的转化[19]。NP通过抑制土壤中氨氧化细菌的生长有效延缓了铵态氮的氧化过程,整个培养过程中土壤铵态氮含量与pH值呈正相关关系,与氨氧化细菌数量和硝态氮含量呈负相关关系[20]。本试验测定土壤CO2排放量发现,N3处理能显著促进土壤CO2排放,同时培养期N3处理的pH值最高,NP为有机物,笔者推测N3处理可能通过影响土壤pH值和土壤的碳氮比(C/N)来影响土壤微生物活性,从而使CO2排放量增加,具体原因有待进一步试验验证。
相关研究表明,在红壤菜地上,与普通尿素处理相比,碧晶尿素(含nitrapyrin)处理地表径流中铵态氮、硝态氮、无机氮的流失量分别降低13.1%、12.9%、11.7%[21]。姜亮等研究发现,施用NP处理的东北黑土土壤NH4+-N含量显著高于单施尿素处理,NO3--N和NO2-N含量均显著低于单施尿素处理[22]。本试验表明,添加硝化抑制剂NP的处理(N2、N3)土壤NO3--N含量较只施尿素的处理(N1)显著降低,而NH4+-N含量则有所提高;不同浓度的NP影响无机氮转化的能力不同,添加0.8%NP的处理(N3)调控效果更优。杨威研究表明,种植番茄的温室土在优化施肥处理条件下,配施DCD能显著抑制土壤NH4+-N向NO3--N的转化,提高氮素利用率[23]。本试验添加DCD处理(N4)与只施氮肥处理(N1)相比土壤NH4+-N含量有所提高。
3.2 结论
添加硝化抑制剂NP和DCD均能抑制温室菜田土壤中N2O的排放,其中添加0.8%NP处理的抑制效果更好,其次为添加0.1%NP的处理,添加5%DCD处理的抑制效果较差。
添加0.8%NP的处理能促进CO2排放,排放量显著高于其他处理。
添加0.1%、0.8%NP均明显降低了土壤中NO3--N含量,提高了土壤中NH4+-N含量,其中0.8%NP的效果更好;添加5%DCD处理的土壤中NH4+-N含量与对照相比有所增加。
