氨甲环酸不同时间给药对血管内皮细胞多糖-蛋白质复合物降解的影响
2018-11-16胡磊
胡磊
(金华市中心医院 急诊科,浙江 金华 321000)
所有健康血管内皮细胞表面均覆盖有多糖-蛋白质复合物,这种复合物可调节内皮细胞通透性、保持内皮细胞屏障功能以及抑制血管内血栓形成等[1]。严重创伤或出血性休克可导致血管内皮细胞中多糖-蛋白质复合物降解,从而导致血液凝固、细胞炎症反应和内皮细胞屏障功能失调,这种损伤称为“创伤性血管内皮细胞病”,其致病机制尚不明确[2]。氨甲环酸(tranexamic acid,TXA)已被广泛应用于临床创伤治疗中,但确切作用机制仍不十分明确[3]。近年来研究表明,在出血性休克致肠上皮细胞损伤模型中,TXA腔内给药可通过保护上皮细胞多糖-蛋白质复合物而发挥上皮细胞保护作用[4],但TXA对创伤导致体外血管内皮细胞中细胞多糖-蛋白质复合物的作用尚未见报道。为此,本研究探讨TXA在不同时间点给药对体外血管内皮细胞中多糖-蛋白质复合物的作用。
1 材料和方法
1.1 材料 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自上海细胞生物研究所;DMEM低糖培养基购自美国HyClone公司;胎牛血清购自美国Gibco公司;Hoechst 33258购自美国Sigma公司;cleaved-caspase-3抗体购自上海碧云天生物科技有限公司;细胞间黏附分子(in-tercellular cell adhesion molecule,ICAM)、基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)和β-actin抗体购自美国Epitomics公司;多配体聚糖、透明质酸(hyaluronic acid,HLA)和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)含量检测的ELISA试剂盒购自南京凯基生物科技发展有限公司;Transwell小室和Matrigel胶购自美国BD公司。
1.2 细胞培养和细胞分组 将HUVECs接种于DMEM培养基中,培养基中含有10%胎牛血清、100 U/mL的青霉素、100 μg/mL的链霉素、2 mmol/L谷氨酰胺和1.5 g/L碳酸氢钠。细胞置于37 ℃下5% CO2饱和湿度的细胞培养箱内,当细胞生长至铺满培养瓶底面积80%~90%以上时用适量胰蛋白酶消化传代,实验选用第3~第5代细胞进行实验。调整细胞浓度为1×106/L,将200 μL细胞悬液接种于96孔板中,随机分为正常对照组、H2O2组、H2O2+TXA(30 min)组、H2O2+TXA(60 min)组、H2O2+TXA(10 h)组和H2O2+TXA(11 h)组,后5组细胞均加入100 μmol/L的H2O2作用12 h,并分别在H2O2作用开始后30 min和60 min以及H2O2作用结束前1 h和2 h这4个时间点加入TXA(150 μmol/L)作用1 h。
1.3 细胞形态学观察 调整细胞浓度为1×106/L,取细胞悬液0.5 mL于载玻片上,加入浓度为10 μg/mL的Hoechst 33258液10 μL,在室温下避光处理10 min,立即在Olympus倒置荧光显微镜下进行观察并拍照。每组重复3次,每次重复计数50个细胞。
1.4 Western blot检测蛋白表达 将细胞置于冰PBS液中洗涤3次,添加细胞裂解液后置于冰上反应30 min,在12000 r/min的速度下冷冻离心20 min,收集上清液后应用BCA法定量蛋白。每份样品使用30 μg蛋白质,使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜上,在4 ℃温度下使用5%脱脂奶粉反应过夜,硝酸纤维素膜经一抗和二抗反应后进行ECL显色、曝光和显影,利用灰度分析软件半定量计算目的蛋白表达量,以β-actin为内参。
1.5 ELISA法检测多配体聚糖、HLA和TNF-α含量调整细胞浓度为1×106/L,取1 mL细胞悬液接种于24孔板中,置于细胞培养箱中孵育24 h,待细胞铺满底面积进行细胞功能性实验,实验结束后即刻收集细胞上清液,在12000 r/min的速度下常温离心20 min,将细胞上清液收集于EP管中,并冻存于-20 ℃冰箱备用。临实验时取出EP管,迅速复溶后严格按ELISA试剂盒说明书进行操作,在酶标仪450 nm处读取吸光度值,并按照各自标准绘制标准曲线,分别计算多配体聚糖、HLA和TNF-α含量值。
1.6 细胞体外侵袭实验 将消化后的细胞加入无血清DMEM培养基中,调整细胞浓度为1×104/mL,将300 μL细胞悬液和300 μL含20%胎牛血清的培养基分别加入Transwell上室和下室,放置细胞培养箱中培养24 h后添加结晶紫染色液进行染色,维持染色时间20 min,用PBS液清洗3遍后将Transwell上室放置在倒置显微镜下进行观察,在高倍镜下随机选取10个视野对穿过小室的蓝染细胞进行计数,计算蓝染细胞平均值。
1.7 统计学处理方法 采用SPSS17.0统计学软件进行统计学分析,计量资料以±s表示,各组间比较用单因素方差分析,组内比较用Dunnett-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 TXA对HUVECs凋亡的影响 荧光显微镜下观察到正常对照组细胞核呈均匀的低强度荧光,H2O2组细胞可见大量细胞出现染色体边集呈新月状,同时出现凋亡小体,呈典型凋亡细胞改变,细胞凋亡率明显高于正常对照组,差异有统计学意义(P<0.01);与H2O2组相比,H2O2+TXA(30 min)组和H2O2+TXA(60 min)组凋亡细胞均明显减少,差异有统计学意义(P<0.01);H2O2+TXA(10 h)组和H2O2+TXA(11 h)组细胞凋亡率与H2O2组比较,差异无统计学意义(P>0.05)。见图1和表1。与正常对照组比,H2O2组HUVECs后可显著上调cleaved-caspase-3蛋白的表达,差异有统计学意义(P<0.05);而H2O2+TXA(30 min)组和H2O2+TXA(60 min)组中cleaved-caspase-3的表达较H2O2组明显减少,差异有统计学意义(P<0.05);cleaved-caspase-3蛋白在H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中的表达与H2O2组比较,差异无统计学意义(P>0.05)。见图2。

图1 荧光显微镜下观察HUVECs凋亡,箭头示典型凋亡细胞(Hoechst 33258荧光染色法,×400)

表1 TXA对HUVECs凋亡的保护作用

图2 TXA对HUVECs中cleaved-caspase-3蛋白表达的影响
2.2 TXA对HUVECs中的ICAM和MMP-9蛋白表达的影响与正常对照组比,H2O2组的HUVECs中ICAM和MMP-9蛋白表达显著上调,差异有统计学意义(P<0.05);与H2O2组比,H2O2+TXA(30 min)组和H2O2+TXA(60 min)组中ICAM和MMP-9的表达明显减少,差异有统计学意义(P<0.05);而在H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中ICAM和MMP-9蛋白的表达与H2O2组比较,差异均无统计学意义(P>0.05)。见图3。
2.3 TXA对HUVECs中的多配体聚糖表达的影响 与正常对照组比,H2O2组HUVECs的多配体聚糖的表达显著上调,差异有统计学意义(24.7±5.1vs.78.6±11.6,P<0.05);H2O2+TXA(30 min)组和H2O2+TXA(60 min)组中多配体聚糖的表达分别为(27.6±5.3)ng/mL和(28.7±4.5)ng/mL,与H2O2组比较差异均有统计学意义(P<0.05);而多配体聚糖在H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中的表达与H2O2组比,差异均无统计学意义(P>0.05)。见图4。

图3 TXA对HUVECs中ICAM和MMP-9蛋白表达的影响
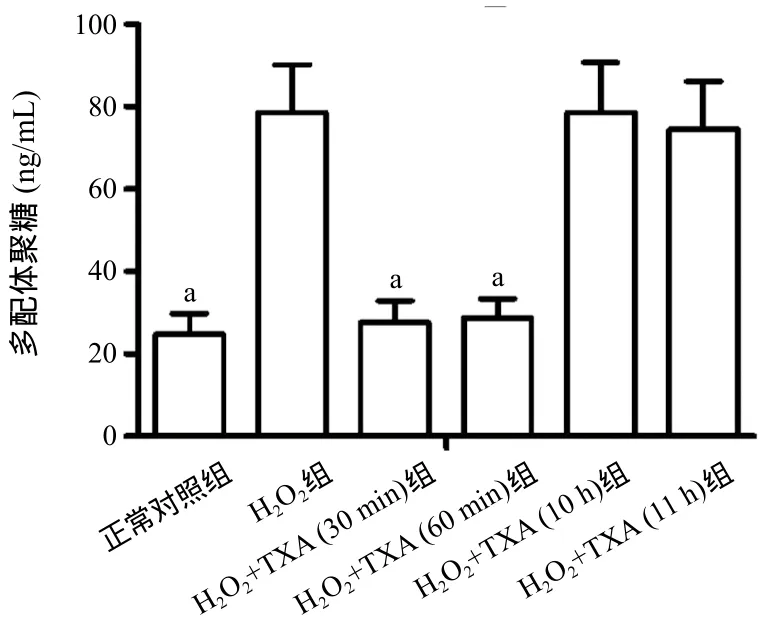
图4 TXA对体外HUVECs中多配体聚糖表达的影响
2.4 TXA对HUVECs中的HLA和TNF-α表达的影响H2O2组HUVECs的HLA表达显著上调,与正常对照组比,差异有统计学意义(17.8±3.3vs.64.2±11.4,P<0.05);H2O2+TXA(30 min)组和H2O2+TXA(60 min)组中HLA的表达分别为(22.8±5.3)ng/mL和(25.1±5.7)ng/mL,与H2O2组比,差异均有统计学意义(P<0.05);而HLA在H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中的表达与H2O2组比较,差异均无统计学意义(P>0.05)。见图5。与正常对照组比,H2O2组HUVECs中TNF-α的表达可明显升高,差异有统计学意义(16.3±2.7vs.74.9±15.4,P<0.05);H2O2+TXA(30 min)组和H2O2+TXA(60 min)组中TNF-α的表达分别为(28.5±4.8)pg/mL和(33.8±4.1)pg/mL,与H2O2组比较,差异均有统计学意义(P<0.05);而H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中TNF-α的表达,与H2O2组比较,差异均无统计学意义(P>0.05)。见图6。
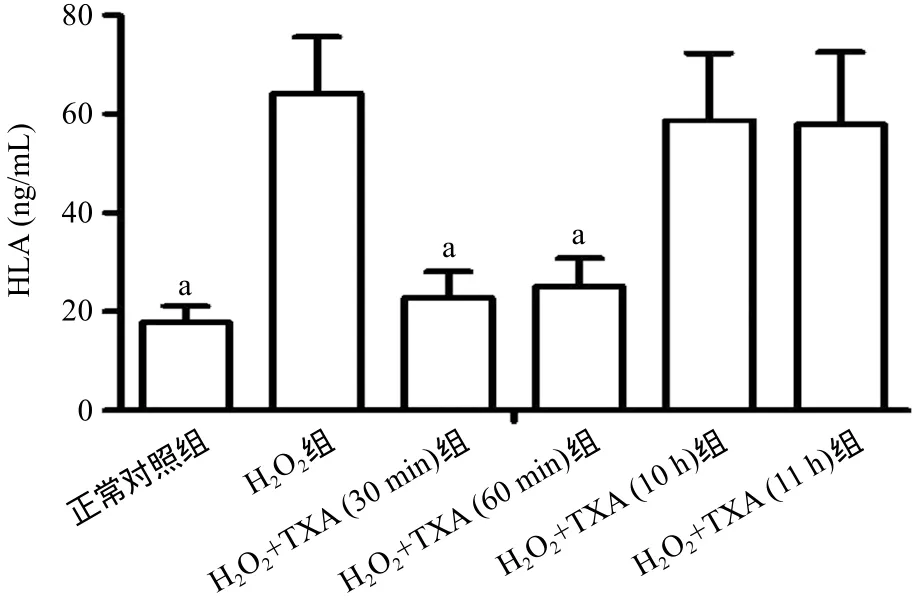
图5 TXA对体外HUVECs中HLA表达的影响

图6 TXA对体外HUVECs中TNF-α表达的影响
2.5 TXA对体外HUVECs侵袭的影响 H2O2组HUVECs侵袭性行为显著升高,与正常对照组比较,差异有统计学意义(2.3±0.3vs.32.8±6.2,P<0.01);H2O2+TXA(30 min)组和H2O2+TXA(60 min)组侵袭细胞数分别为(7.6±1.2)和(8.7±1.5),与H2O2组比较,差异均有统计学意义(P<0.01);而H2O2+TXA(10 h)组和H2O2+TXA(11 h)组中侵袭出Matrigel胶的细胞数为(14.8±4.7)和(16.2±4.3),与H2O2组比较,差异均有统计学意义(P<0.01)。见图7。
3 讨论
内皮细胞多糖-蛋白质复合物作为内皮细胞膜的骨架在维持血管通透性中发挥了重要的屏障作用,同时还具有将细胞外信号传递至细胞内的功能。多糖-蛋白质复合物的主要成分为葡糖氨基葡聚糖和蛋白聚糖,葡糖氨基葡聚糖主要有硫酸乙酰肝素、HLA和硫酸软骨素,而蛋白聚糖多由多配体聚糖和糖蛋白组成[5-6]。由于多糖-蛋白质复合物难以在体内环境中观察到,因此检测多配体聚糖和HLA的含量可间接反映多糖-蛋白质复合物的降解。研究表明,活性氧及炎症因子可破坏内皮细胞多糖-蛋白质复合物,同时创伤相关的交感神经活化可特异性降解血管内皮细胞中的多糖-蛋白质复合物,并引起凝血功能障碍,从而表明多糖-蛋白质复合物可能参与机体凝血过程。

图7 Transwell小室实验检测TXA在不同时机给药对体外HUVECs侵袭行为的作用(结晶紫染色法,×400)
血管内皮细胞作为血液和组织间的屏障组织,在调节血液信号转导、炎症反应和血液凝固等生理活动中发挥了重要作用。既往研究表明诸如脓毒血症和出血性休克等急危重症可对血管内皮细胞产生抑制作用。H2O2作为一种强氧化剂,可调控细胞氧化信号通路,同时H2O2可导致血管内皮细胞多层面损伤,并破坏血管内皮细胞多糖-蛋白质复合物完整性[7]。在本研究中所使用的H2O2浓度为100 μmol/L,并将H2O2作用于体外培养HUVECs,首先观察到H2O2作用后可诱导大量内皮细胞凋亡,从而在细胞凋亡层面观察到H2O2对内皮细胞的损伤。ICAM作为存在于内皮细胞中黏附分子免疫球蛋白超家族,在TNF-α等炎症因子刺激下表达上调,从而在介导细胞炎症反应中发挥了重要作用,研究表明ICAM 与内皮细胞激活和屏障功能密切相关[8-9]。本研究也观察到H2O2作用后可明显上调ICAM和TNF-α的表达,从而表明H2O2可引起显著的内皮细胞激活和损伤。
内皮细胞多糖-复合物可作为创伤性休克引起内皮细胞屏障损伤的早期标志。研究表明内皮细胞中多配体聚糖和HLA的流失与内皮细胞多糖-蛋白质复合物的降解关系密切;同时内皮细胞性多糖-蛋白质复合体在严重创伤患者中往往表达下调,并与血管通透性和急性创伤性凝血功能障碍密切相关[10]。因此,改善或者逆转血管内皮细胞多糖-蛋白质复合物在严重创伤患者的降解过程有望降低病死率,并改善预后。BUTWICK等[11]报道将新鲜冰冻血浆输注至出血性休克患者体内可减少多配体聚糖的降解,从而缓解患者炎症反应及病情进展;DUEBEL等[12]称凝血酶原复合物因子IV也具有新鲜冰冻血浆类似的功效。本研究发现H2O2可显著上调多配体聚糖和HLA在体外血管内皮细胞中表达。有研究表明MMPs家族参与调节血管壁通透性、血管活性因子生成、血管新生及细胞外基质降解等多种生理活动,而血管内皮细胞中多糖-蛋白质复合物可在炎症因子的刺激下通过活化包括MMPs在内的细胞外蛋白酶而发生降解[13-14]。本研究观察到H2O2作用可导致内皮细胞中MMP-9表达上调,并促进体外血管内皮细胞侵袭。至此,本研究通过将H2O2作用于体外血管内皮细胞,观察到H2O2可通过促进血管内皮细胞中炎症因子和细胞外蛋白酶的表达,从而促进多配体聚糖和HLA的表达,表明H2O2可破坏血管内皮细胞中多糖-蛋白质复合物,与既往文献[15]报道相吻合。
TXA是一种广泛应用于临床的凝血药。研究发现在出血性创伤发生后的3 h内使用TXA可有效减少出血引起的病死率[16];同时一项军方研究表明在急性创伤发生后1 h内使用TXA可显著降低患者病死率[17]。上述研究使TXA在急性创伤患者中广泛使用,尤其是在院前急救过程中,其作用机制与其抗纤维蛋白溶解作用相关,但这并不能解释TXA在创伤患者治疗中的所有治疗效果。在进一步研究TXA的作用机制中发现,TXA可缓解手术创伤患者的炎症反应;同时在严重创伤患者中单独使用TXA可有效降低多器官衰竭和病死率,从而表明出血性创伤患者从TXA中获益并非只是其止血作用。近来一项针对啮齿动物休克模型的研究表明,TXA腔内注射可保护动物肠黏膜屏障的自身消化作用;同时腔内注射TXA还可抑制缺血/再灌注损伤引起的的肠壁通透性增加,并对实验动物肺功能发挥保护作用,其作用机制与TXA抑制解聚素、金属蛋白酶和肿瘤坏死因子的表达相关[10-11]。本研究将TXA在不同时间点作用于体外血管内皮细胞中发现,早期TXA给药可抑制H2O2对内皮细胞的凋亡诱导和侵袭性增强的作用,同时可抑制H2O2对血管内皮细胞中多糖-蛋白质复合物的破坏作用,而晚期给药则对内皮细胞损伤无明显保护作用,提示临床应用TXA需早期给药,而血管内皮细胞中多糖-蛋白质复合物也有望成为创伤性休克患者有效作用靶点。
