正常糖耐量人群糖尿病家族史与血脂紊乱的相关性
2018-11-16胡珦顾雪疆杨丽娟林怡虞伟慧斯琪雅
胡珦,顾雪疆,杨丽娟,林怡,虞伟慧,斯琪雅
(温州医科大学附属第一医院 内分泌科,浙江 温州 325015)
2型糖尿病(type 2 diabetes mellitus,T2DM)是多因素疾病,遗传和环境因素及其之间的相互作用为其重要病因[1]。在遗传易感性的基础上,T2DM发病率随着环境与生活方式的改变而迅速上升。糖尿病一级亲属(first-degree relatives of patients with diabetes,FDR)的糖尿病风险显著升高[2]。正常糖耐量FDR尤其适合作为探讨糖尿病早期代谢异常的研究人群[3-5]。
T2DM患者常合并血脂紊乱[6]。而FDR与T2DM患者血脂紊乱类型相似[7]。基础研究提示FDR人群存在早期脂代谢缺陷[8]。大多数临床研究也显示,FDR人群血脂水平已出现显著异常[9-11]。但中国一项小样本的研究却报道,糖尿病家族史与血脂紊乱并无显著相关性[12]。因此,FDR人群其糖尿病家族史与血脂紊乱的关系结论尚不一致。
本研究选取正常糖耐量、非肥胖人群作为研究对象,排除继发高血糖及肥胖对血脂紊乱的影响,探讨FDR人群其糖尿病家族史与血脂紊乱的相关性。
1 对象和方法
1.1 对象 本研究是REACTION研究[13]基线调查的一部分。REACTION研究从2011年至2012年在中国大陆25个社区中进行,基线纳入了259657例40岁以上的参与者,占总参与者的92%,研究目的在于探讨糖尿病与恶性肿瘤的关系,其中,温州地区共有4个社区被随机选择进行研究。本研究在温州地区参与者中选取了1686例临床资料完整的既往无糖尿病病史者,平均年龄(55.7±8.2)岁,年龄范围40~76岁。所有研究对象进行了口服糖耐量试验,根据1999年世界卫生组织糖尿病诊断标准[14]选择正常糖耐量人群。本研究排除肥胖人群[体质量指数(body mass index,BMI)≥30 kg/m2][15],除此之外,有严重肝胆疾病、严重肾功能不全、甲状腺功能异常、已诊断的心脑血管疾病、恶性肿瘤、精神疾患的人群也排除在外。所有的研究对象均由经培训的调查员完成一份关于现病史、既往史、用药史、家族史、吸烟史、运动、饮食、情绪状态等临床资料的问卷。糖尿病家族史由参与者自己告知,FDR定义为有一个或多个一级亲属(父母、亲兄妹、子女)患有糖尿病[16]。本研究人群分为non-FDR组共1412例,平均年龄(56.1±8.3)岁,年龄范围40~76岁,包括男380例,女1032例;FDR组共274例,平均年龄(53.9±7.2)岁,年龄范围40~73岁,包括男性60例,女性214例。本研究经温州医科大学附属第一医院伦理审查委员会批准,所有参加者均签署书面知情同意书。
1.2 方法
1.2.1 人体简易参数:BMI=体质量(kg)/身高2(m2)。腰围采用腋中线肋骨下缘与髂嵴连线中点水平的周径。受试者休息10 min以上,采用常规袖套式水银血压计测量血压3次,每次间隔3 min,取均值。
1.2.2 生化检查:本研究生化指标的测定与先前的研究[13]一致。所有参与者在空腹至少8 h后行口服葡萄糖耐量试验。高效液相色谱法测定糖化血红蛋白(glycated hemoglobin A1c,HbA1c),采用VARIANTTMII和D-10TM系统(BIO-RAD,美国)。空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 hour postprandial glucose,2hPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-c)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)在自动分析仪(ARCHITECT ci16200分析仪,美国)上测定。
1.2.3 血脂紊乱诊断标准:根据中国成人血脂异常防治指南定义血脂水平[17]:血清TC水平≥5.18 mmol/L;血清TG水平≥1.7 mmol/L;血清LDL-c水平≥3.37 mmol/L;血清HDL-c水平<1.04 mmol/L;或目前正进行调脂治疗。
1.3 统计学处理方法 采用SPSS16.0软件进行数据分析。所有变量均进行正态性检验,正态分布变量以±s表示,非正态分布变量以M(P25,P75)表示。正态分布变量2组间比较采用独立样本t检验,非正态分布变量2组间比较采用Wilcoxon rank-sum检验。糖尿病家族史与血脂水平的相关性采用Spearman相关分析。采用多因素Logistic回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的临床特征 与non-FDR组比,FDR组年龄较小,2hPG、HbA1c、TC、TG及LDL-c水平较高,HDL-c水平较低(均P<0.05)。其他临床指标差异无统计学意义(见表1)。
2.2 FDR血脂紊乱的患病率 在non-FDR人群中,共有948人发生血脂紊乱,患病率为67.1%,而在FDR人群中,共有223人患有血脂紊乱,患病率为81.4%,后者明显高于前者(P<0.001)。从单个血脂水平来看,FDR组高TC血症、高TG血症、高LDL-c血症及低HDL-c血症的患病率分别为63.5%、33.2%、43.8%和10.6%,均显著高于non-FDR人群(分别为54.2%、25.8%、35.3%和6.6%),差异有统计学意义(均P<0.05),见图1。

表1 研究人群的临床特征
2.3 一级糖尿病家族史与血脂紊乱的相关性 Spearman相关分析显示,FDR糖尿病家族史与TC(r=0.075,P=0.002),TG(r=0.096,P<0.001),LDL-c(r=0.084,P=0.001)呈显著正相关,与HDL-c(r=-0.071,P=0.004)呈显著负相关。多因素Logistic分析将TC、TG、LDL-c和HDL-c逐步纳入方程,结果显示仅TG、LDL-c和HDL-c与一级糖尿病家族史呈独立相关(均P<0.05),见表2。
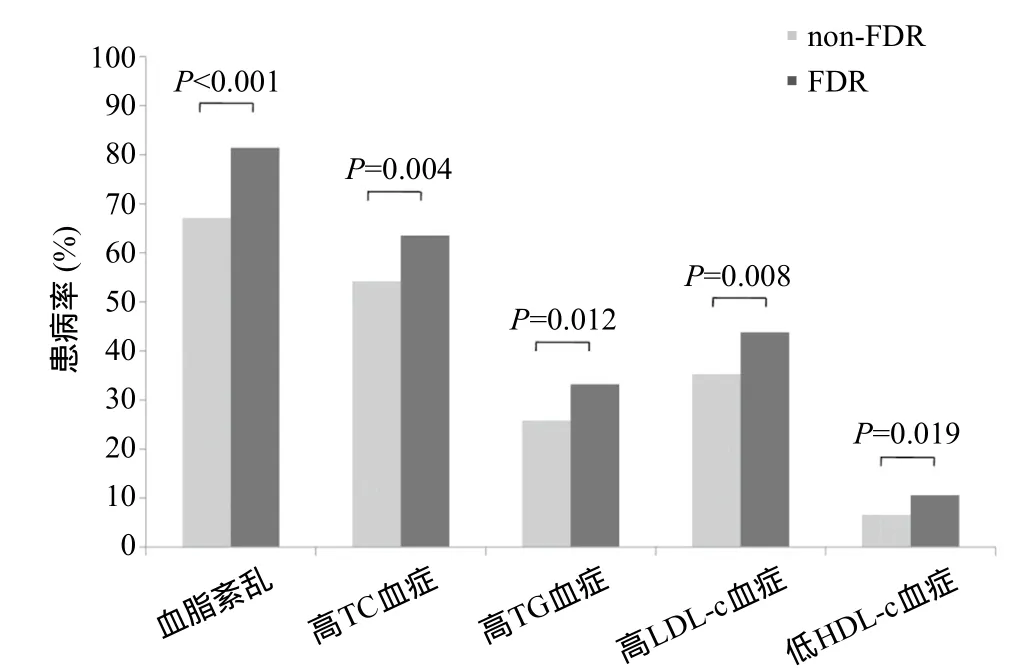
图1 non-FDR与FDR人群血脂紊乱患病率比较
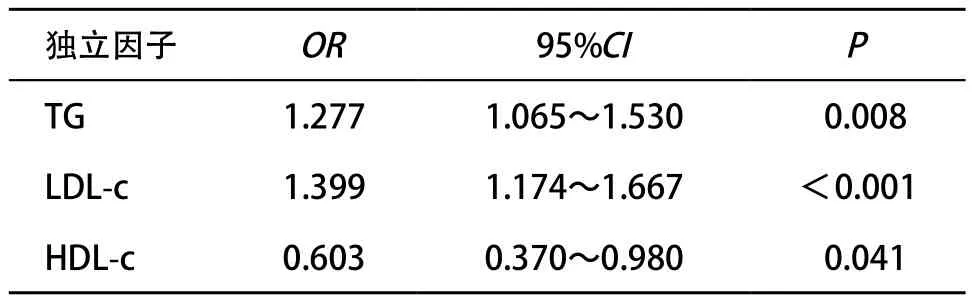
表2 一级糖尿病家族史与血脂紊乱的关系
2.4 影响血脂紊乱的多因素分析 多因素Logistic回归分析以血脂紊乱为因变量,以一级糖尿病家族史以及临床变量包括性别、年龄、BMI、腰围、收缩压、舒张压、FPG、2hPG和HbA1c作为自变量,结果显示,除了年龄、收缩压和HbA1c,一级糖尿病家族史与血脂紊乱的发生呈独立正相关(P<0.001),见表3。
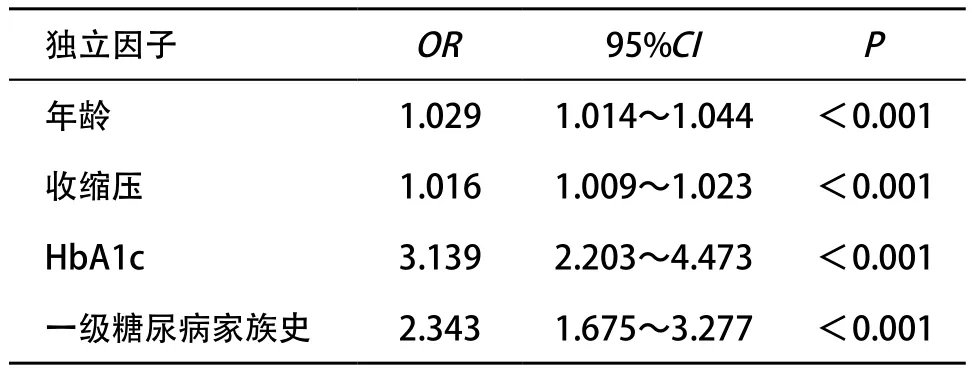
表3 血脂紊乱的多因素Logistic回归分析
3 讨论
在T2DM患者中,血脂紊乱十分常见。大规模的临床研究表明T2DM患者具有异常的血脂谱[7]。研究显示,在男性和女性中,血脂紊乱的发生率分别高达54%和56%[18]。瑞典一项包含75048例T2DM患者的大样本临床研究也报道37%~38%的参与者具有高TG血症合并或不合并低HDL-c,即使是接受他汀类药物治疗的T2DM患者,仍有35%~50%患有血脂紊乱[19]。
正常血糖的FDR与T2DM患者具有相似的遗传背景,而亚临床的代谢异常还未受高血糖继发作用的影响[3-5]。中国糖尿病患者血脂紊乱的检出率也持续增高[7]。FDR与T2DM患者具有相似的遗传背景。中国一项对糖尿病家系的研究中发现,糖耐量正常的FDR中血脂紊乱的检出率高达57.7%,且与其T2DM亲属具有相似的血脂紊乱类型[7]。本研究发现FDR人群更易发生血脂紊乱,糖尿病家族史是血脂紊乱发生的独立危险因素。而高达81.4%的检出率提示我国近十年来,随着生活方式的改变,饮食习惯的变化以及其他环境危险因素的增加,本身具备遗传易感性的FDR人群发生血脂紊乱的比例大大上升。
在血脂指标方面,我国学者发现在糖尿病的发生发展过程中,血脂的变化是从TG升高开始,逐渐到LDL-c升高,最后才出现TC升高。在FDR人群中也发现,TG升高早于血糖升高[20]。印度学者将39例男性参与者划分为3组,分别为组1(糖尿病前期FDR组)、组2(糖尿病前期non-FDR组)、组3(正常糖耐量non-FDR组),在口服脂耐量试验后发现,组1餐后TG反应(TG-曲线下面积,TG高峰,餐后6 h TG,餐后8 h TG)显著高于组2和组3,而组2和组3之间差异无统计学意义[9]。澳大利亚的临床研究发现,FDR人群HDL-c水平显著低于无糖尿病家族史的人群[10]。但中国一项小样本的研究却报道,在74例FDR和51例non-FDR之间,TG、TC、HDL-c、LDL-c并无显著差异[12]。本研究与大部分研究结论相似,在正常糖耐量的FDR人群中,各项血脂指标均与non-FDR存在显著差异,且TG、LDL-c和HDL-c水平的变化与其糖尿病家族史存在相关性。
目前FDR更易发生血脂紊乱的机制尚不明确。糖尿病患者血脂紊乱并非孤立的代谢异常,而是与其他代谢异常密切相关,肝脏对高甘油三酯脂蛋白的过度生产及延迟清除是其潜在的代谢异常原因之一[18]。另外,在FDR人群中,由于遗传缺陷所带来的胰岛素抵抗引起脂蛋白脂酶活性下降,从而造成TG和极低密度脂蛋白胆固醇消除障碍,HDL-c形成减少[11]。近年来基础研究也有了新的进展。与non-FDR的人群相比,FDR人群肌肉及脂肪组织中参与脂质代谢的基因表达具有显著差异,这种差异提示FDR人群存在早期脂代谢缺陷[8]。丹麦学者选取了17例FDR及17例non-FDR,所有参与者均非糖尿病患者。在给予高单不饱和脂肪酸饮食后,non-FDR的肌肉组织中脂肪酸转运因子(CD36)基因表达显著上调,而FDR的CD36的基因表达却并无显著变化,表明FDR人群餐后脂肪酸转运功能相对较弱。另外,non-FDR的脂肪组织中ASCL1(可将长链脂肪酸转化为乙酰CoA,从而激活脂肪酸酯化或氧化)基因表达上调而FDR的ASCL1基因表达下降,表明FDR餐后脂肪酸的储存功能也相对受损[5]。因此,FDR人群餐后脂代谢相关基因的表达也在其血脂紊乱的发生发展中发挥重要的作用。
综上所述,本研究结果表明,在糖耐量及体质量均正常时,FDR人群已出现血脂紊乱的易感性。糖尿病家族史是血脂紊乱发生的独立危险因素。因此,对于FDR人群,在出现糖代谢异常之前,早期进行血脂紊乱的筛查和干预至关重要。
