快速老化SAMP6小鼠成骨细胞的体外培养鉴定和生长特性
2018-11-16王洁王萧枫
王洁,王萧枫
(1.瑞安市中医院 骨伤科,浙江 温州 325200;2.温州市中西医结合医院 科教科,浙江 温州325000)
随着社会经济的发展,人类生育观念发生改变,人口老龄化逐渐加重。目前骨质疏松症(osteoporosis,OP)已经成为一种十分常见且危及老年人生命健康的疾病。研究发现,在世界范围的疾病中,OP的患病率已经跃升至第7位[1]。通常认为正常人的第4个十年是一个界限,之后骨吸收作用大于骨形成作用,骨量呈持续性减少,导致OP的发生。
快速老化型小鼠(senescence accelerated mouse,SAM)是1968年由日本学者经AKR/J系小鼠的近交繁殖所培育出来的一种能够快速老化的小鼠模型,按照老化速率可以分为快速老化的P系和正常老化的R系。其P系中的SAMP6小鼠的骨特点与人类老年性OP的骨特点相似:骨组织的超微结构破坏引起全身广泛性骨量减少,骨密度减少引起骨骼脆性增加等[2]。3月龄之后的SAMP6小鼠与同时期的SAMR1小鼠对比可发现前者骨量减少,骨皮质骨厚度减少且骨骼生物力学性能显著下降,是目前仅有的比较符合老年性OP研究标准的动物模型[3]。而有关SAMP6小鼠的成骨细胞体外培养的研究少有报道。查阅有关成骨细胞体外培养的文献,本研究拟从新生SAMP6小鼠颅骨提取成骨细胞并鉴定。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康出生3 d的SAMP6小鼠5只,购自北京大学医学部实验动物科学部,实验动物许可证号:SCXK(京)2016-0010。
1.1.2 实验试剂与仪器:倒置显微镜(日本Olympus公司),高速离心机(德国Eppendorf公司),CO2细胞培养箱(美国Thermo公司),旋转式恒温振荡仪(江苏培英实验设备有限公司),超净工作台(苏州安泰空气技术有限公司),液氮生物容器(四川亚西橡型机器有限公司),PBS(美国Hyclone公司),alpha-MEM培养基(美国Hyclone公司),胎牛血清(杭州四季青生物工程材料公司),双抗(美国Gibco公司),胰蛋白酶-EDTA消化液(美国Gibco公司),I型胶原酶(北京索莱宝科技有限公司),细胞碱性磷酸酶(alkaline phosphatase,ALP)活性染色试剂盒(上海杰美基因医药有限公司),瑞氏-姬姆萨(R-J)染液(北京索莱宝科技有限公司),CCK-8测定试剂盒(杭州联科生物技术有限公司),茜素红(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 SAMP6小鼠成骨细胞的分离和培养:取5只健康出生3 d的SAMP6小鼠断颈处死后放于75%乙醇中20 min,然后放入无菌操作箱在无菌条件下取出颅盖骨。将颅盖骨放于培养皿上用含1%青霉素、链霉素双抗的PBS液漂洗多次,剪成大小约1 mm×1 mm。将碎块置于离心管中,加入含0.25% EDTA的胰蛋白酶5 mL,放入37 ℃恒温水浴锅中消化20 min,弃消化液。再加入I型胶原酶5 mL,放入37 ℃恒温振荡仪中消化1 h。小心收集消化后的上清液放于10 mL离心管,离心后弃上清液,加入细胞培养液(含90%α-MEM培养基+10%胎牛血清+1%双抗)制成细胞悬液放于37 ℃、5% CO2培养箱中暂存。将上一步剩余的碎骨块继续消化,重复上一步的操作。收集上述两次步骤消化得到的细胞悬液放在10 mL离心管中,移液枪轻柔重悬细胞并吹打均匀,细胞计数后按照5×105个/mL的浓度依次接种于10 cm培养皿中,将培养皿放置于37 ℃、5% CO2、饱和湿度环境的培养箱中培养,每3 d 换液1次。
1.2.2 SAMP6小鼠成骨细胞传代:每日或在细胞换液时观察细胞贴壁情况以及生长状态、有无细胞污染等情况。待细胞增殖至约占培养皿底80%的表面积时,先弃去培养液,再用PBS小心冲洗3次,然后用含0.25% EDTA的胰酶消化1 min,中止消化后收集细胞悬液离心(1000 r/min,10 min),弃上清液,加适当培养液,以一传三的比例传代,细胞传代后继续放置在37 ℃、5% CO2、饱和湿度的培养箱中培养,每3 d 换液1次。
1.2.3 SAMP6小鼠成骨细胞的纯化:在P1、P2、P3代细胞传代时,将培养皿放置在37 ℃、5% CO2、饱和湿度的培养箱中培养5 min后将上清液吸走加入到新的无菌10 cm培养皿中。
1.2.4 R-J染色:将纯化后的第3代细胞计数后以1×104个/mL接种到24孔细胞培养板中,每孔接种1 mL,以后每3 d换液。待细胞生长融合至约占每孔底面积80%时,弃培养液后用PBS小心冲洗3次,再加甲醇,室温下固定10 min,弃去甲醇,R-J染液室温下作用2 min,用蒸馏水冲洗后,将培养板放于倒置相差显微镜下观察细胞的形态并拍照保存。
1.2.5 茜素红染色:选24孔细胞培养板接种细胞,接种、培养方法以及换液频率同1.2.4。待21 d后,弃培养液,用PBS冲洗3次,再用95%乙醇室温下固定30 min,弃95%乙醇,用蒸馏水冲洗3次。每孔加入适量茜素红染液,室温下静置30 min,弃染色液时尽量吸走避免残留底部影响镜下观察,用蒸馏水缓慢冲洗残留的茜素红染液。冲洗后肉眼观察染色情况后再放于倒置相差显微镜下观察染色情况并拍照保存。
1.2.6 ALP染色:选24孔细胞培养板接种细胞,接种、培养方法以及换液频率同1.2.4。待细胞生长融合至约占每孔底面积80%时,按ALP染色试剂盒要求进行操作。
1.2.7 SAMP6小鼠成骨细胞增殖能力测定(绘制生长曲线):取纯化后的第3代成骨细胞,按照上述步骤消化后接种在96孔细胞培养板中,接种浓度为:2×103个细胞/100 μL/孔,每组共7孔。剩余未加细胞悬液的孔加入每孔200 μL的PBS。将96孔细胞培养板放在37 ℃、5% CO2、饱和湿度的培养箱中培养,每日换液1次。每日测定7个孔中细胞的OD值。小心吸走每孔的培养液,PBS清洗后,每孔加入10 μL 含CCK-8溶液和90 μL培养基的混合溶液,将培养板在培养箱内孵育2 h。酶标仪设置条件为450 nm处的吸光度,参比波长620 nm,测得每日7孔细胞OD值,生长曲线的绘制方法:纵坐标为每日平均OD值,横坐标为测定的天数,用CCK-8法连续检测8 d。
2 结果
2.1 倒置相差显微镜下观察SAMP6小鼠成骨细胞形态 原代的SAMP6小鼠成骨细胞接种24 h后镜下观察发现大多数细胞已经贴壁,少部分细胞仍悬浮,贴壁的细胞呈现多种形态,大致有三角形、多角形、梭形等(见图1A)。6 d时,贴壁的细胞互相连接成片甚至重叠生长,整体外观呈铺路石状(见图1B)。传代后的细胞形态仍以不规则形、三角形、梭形为主,有的细胞突起较多,继续培养融合后总体外观呈铺路石样。
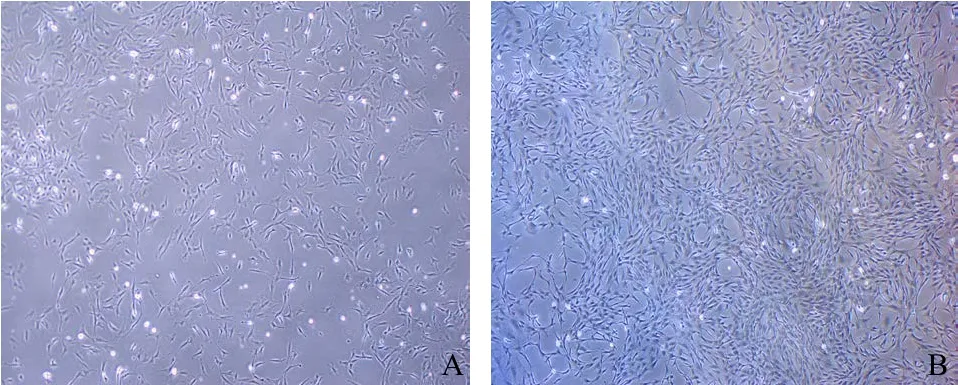
图1 原代SAMP6小鼠成骨细胞培养24 h和6 d时的形态观察(×40)
2.2 R-J染色结果 镜下观察到R-J染色后的细胞胞浆被染成紫蓝色,细胞核被染成深蓝色,细胞中可见圆形或椭圆状的1~3个核仁(见图2),细胞形状多样化,主要为三角形、梭形、多角形。
2.3 茜素红染色结果 连续培养21 d后的细胞汇合密集,并且层层重叠生长,肉眼下及镜下可见到伴有不透明的钙化结节覆盖生长在细胞上面,茜素红染色后镜下观察到不透明的钙化结节颜色变成橘红色(见图3)。表明分离得到的成骨细胞体外培养具有矿化的特征。
2.4 ALP染色结果 ALP染色后镜下观察可见细胞浆被染成紫红色,胞内紫蓝色颗粒分布,大量阳性细胞出现(见图4)。表明分离得到的成骨细胞具有合成分泌ALP的功能。
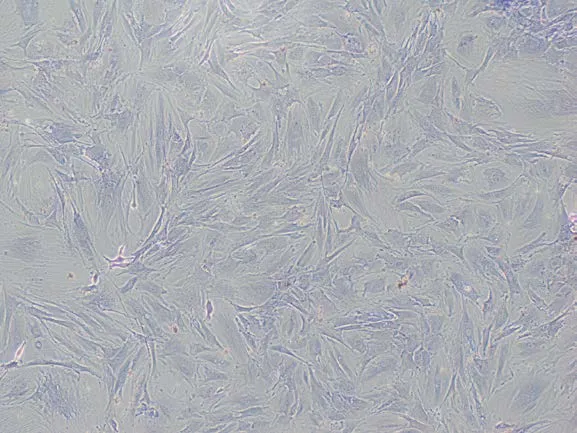
图2 第3代SAMP6小鼠成骨细胞R-J染色结果(×100)
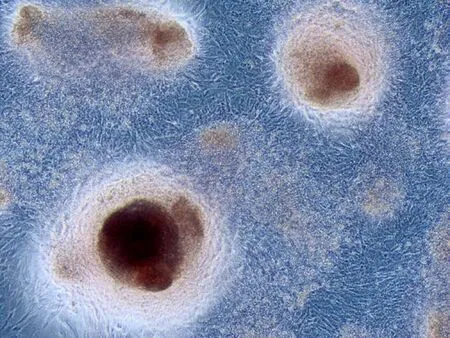
图3 第3代SAMP6小鼠成骨细胞茜素红染色结果(×100)

图4 第3代SAMP6小鼠成骨细胞培养ALP染色结果(×100)
2.5 SAMP6小鼠成骨细胞生长特性 每日用CCK-8测定细胞的OD值,分析数据后发现细胞接种的前3 d为适应期,此时生长曲线平缓,第3~第7天生长曲线基本为线性曲线,进入细胞的对数生长期。7 d后随着细胞生长平台期的到来细胞增殖较对数生长期明显减缓,生长曲线因此变得相对平缓(见图5)。表明分离得到的成骨细胞生长曲线基本呈“S”形。
3 讨论
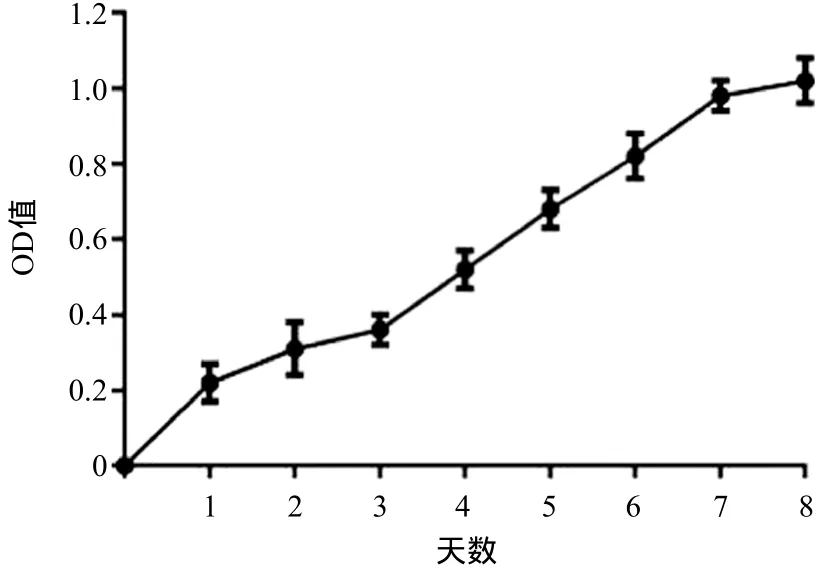
图5 SAMP6小鼠成骨细胞的生长曲线
3.1 SAMP6小鼠 SAMP6小鼠是目前公认针对老年性OP研究较为理想的动物模型[4]。与其他模拟老年性OP的动物模型相比,SAMP6小鼠有稳定的遗传性能,骨骼微观退化改变与人类老年性OP的病理改变比较相似。目前,有关SAMP6小鼠多从其骨形态、骨密度、骨髓间充质干细胞、骨的矿化、骨小梁密度等作为研究方向。杨燚等[5]研究SAMP6小鼠骨髓间充质干细胞不仅有明显的成骨分化障碍而且存在衰老加速,这可能是SAMP6小鼠模拟老年性OP的机制。SAMP6小鼠的长骨中分离骨髓间充质干细胞的研究发现其与临床上老年性OP患者情况较一致[6]。赵延蕾等[7]用鲫鱼卵唾液酸糖蛋白治疗雄性SAMP6小鼠由骨丢失引起的OP,与正常对照组相比,模型对照组小鼠松质骨出现严重的骨量丢失和结构退变。UEDA等[8]研究发现将SAMP6小鼠的骨髓间充质干细胞直接注入C57BL/6J小鼠的骨髓髓腔,C57BL/6J小鼠在1个月后也出现OP的表现,两者体内IL-11基因的表达水平均显著下降。
而SAMP6小鼠成骨细胞培养及鉴定的报道较少见。故本研究以SAMP6小鼠的成骨细胞为研究对象,采用体外分离培养新生的SAMP6小鼠颅盖骨的成骨细胞的方法,进行OP机制的研究。
3.2 成骨细胞的来源 从动物或者活体的骨、骨膜以及骨髓间充质干细胞分离提取得到成骨细胞是目前常用的研究体外成骨细胞生理病理的3种来源。有学者用SD大鼠的骨髓间充质干细胞体外分离后成功诱导为成骨细胞[9]。而有观点认为颅骨来源的成骨细胞在分化能力上要优于骨膜来源的成骨细胞[10]。孙正义等[11]为了探究不同部位取材获得的成骨细胞功能差异,通过引产胎儿各个部位的取材来培养成骨细胞后发现,不同的解剖部位得到的成骨细胞的分化能力差异较大,引产胎儿骨膜来源的成骨细胞内ALP和骨钙素含量显著高于颅盖骨来源的成骨细胞。目前普遍采用分离新生动物的颅盖骨来作为成骨细胞的来源[12-14]。故本研究通过用新生SAMP6小鼠的颅盖骨分离得到成骨细胞。
3.3 成骨细胞的消化方法 成骨细胞的原代培养方法目前主要有3种,分别为组织块培养法、酶消化法和改良酶消化法[15]。组织块培养法虽然简便廉价且细胞纯度较高,但是成骨细胞爬行周期需要较多的时间且数量相对偏少[16]。而酶消化法中胰蛋白酶的消化时间也因不同组织对其耐受程度有差异而不同,大多数文献中胰酶的消化时间不超过20 min,以避免产生细胞破坏,并且在37 ℃时胰酶的消化力最强。关于成骨细胞体外培养的研究中2次消化时I型胶原酶、II型胶原酶的应用均有报道,但胶原酶的消化时间以及消化次数等存在差异。汤小康等[17]用I型和II型胶原酶分别消化新生SD大鼠的颅骨,得出两者均可用于成骨细胞的原代消化,但当条件变为每次消化1 h,共消化2次时,I型胶原酶作用更强,可能的原因为I型胶原基质比II型胶原基质在大鼠骨组织含量更多。故本研究选用I型胶原酶消化新生SAMP6小鼠的颅骨,条件设置为消化1 h,共消化2次,收集2次得到的细胞。为避免细菌污染,在机械法分离新生SAMP6小鼠颅骨后用含1%青霉素、链霉素双抗的PBS溶液反复冲洗。实验过程中胰蛋白酶很容易对细胞产生不可逆的毒性反应,所以胰蛋白酶消化的时间缩短到20 min。消化得到的细胞难免有杂质细胞,应尽可能减少以避免影响后续实验,在每次传代时利用差速贴壁法纯化成骨细胞,原理是成纤维细胞比成骨细胞在消化时更易脱壁,而终止消化后更易贴壁。
3.4 成骨细胞的鉴定 体外培养的成骨细胞必须保持其在体内表现的生物性能和状态。本研究分离获得的SAMP6小鼠成骨细胞贴壁24 h后镜下观察发现细胞形状各异,主要有三角形、梭形、多角形等,贴壁的细胞互相连接成片甚至重叠生长,整体外观呈铺路石状。符合大多数文献报道的体外培养成骨细胞的形态特点[18]。经R-J染色后镜下观察呈三角形、梭形、多角形等多种形态,胞浆被染成紫蓝色,细胞核被染成深蓝色,可见圆形或椭圆形状的1~3个核仁位于细胞中。许兵等[19]用R-J染色观察成骨细胞形态显示细胞核呈现紫褐色,胞浆分布蓝色颗粒。本研究中SAPM6小鼠成骨细胞生长曲线显示:细胞贴壁后前3 d生长曲线较平缓,说明细胞增长相对缓慢,3~7 d是细胞的对数生长,与前3 d比较可见生长曲线基本为线性曲线。7 d后曲线变得相对平坦,随着细胞生长平台期的到来细胞增殖减缓。
对成骨细胞的鉴定除了观察其形状特征外,还可从其所分泌的细胞外基质来判断其成骨能力。相关文献[20]报道活体内的成骨细胞活跃时可以分泌出大量的ALP,而体外分离培养的成骨细胞也应具有这一功能,并且经过ALP染色可以呈现阳性表现。本研究对得到的SAMP6小鼠成骨细胞进行ALP染色后镜下观察可见细胞浆内呈紫蓝色及紫蓝色颗粒,表明大量阳性细胞出现。成骨细胞在分化的晚期还具有矿化的特点是其促进骨形成的重要表现,肉眼下可见许多不透明钙化结节[21]。本研究中,连续培养21 d后的成骨细胞汇合密集,并且层层重叠生长,肉眼下及镜下可见到伴有不透明的钙化结节形成,茜素红染色后镜下观察钙化结节被染成橘红色,基本符合体外培养的成骨细胞生物学性能。
综上所述,本研究采用传统的酶消化法分离SAMP6新生小鼠颅骨的成骨细胞,通过细胞生长曲线显示所提取的成骨细胞有稳定的增殖能力。经鉴定其形态功能良好,生物特性稳定,且具有大多文献中报道的成骨细胞的特征,符合体外细胞生物学评价实验中对细胞的要求。
