甲状腺乳头状癌中PD-L1蛋白表达与BRAF V600E基因突变的相关性
2018-11-16罗华荣甘梅富徐铖徐伟铭梁勇
罗华荣,甘梅富,徐铖,徐伟铭,梁勇
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.台州恩泽医疗中心(集团)恩泽医院 病理科,浙江 台州 318050;3.台州学院 医学院,浙江 台州 318000)
近年来甲状腺癌的发病率逐年上升,已跃居女性常见肿瘤的第5位[1]。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺最常见的恶性肿瘤,受环境、遗传和激素等多种因素的影响,并与慢性淋巴细胞性甲状腺炎(chronic lymphocytic thyroiditis,CLT)明显相关。程序性死亡配体-1(programmed death ligand 1,PD-L1)是重要的负性免疫调节分子,能够抑制T淋巴细胞的功能,是导致肿瘤发生免疫逃逸的重要原因之一[2]。目前关于PD-L1蛋白在甲状腺疾病中的研究较少,尚处于初始的探索阶段。BRAF V600E基因突变是PTC最常见的分子事件,在PTC的发生、发展过程中起着重要的作用[3]。本研究通过检测PTC组织中PD-L1蛋白的表达,探讨其与PTC临床病理特征及BRAF V600E基因突变的关系。
1 资料和方法
1.1 一般资料 收集台州恩泽医疗中心(集团)恩医院病理科2017年1月至12月间手术切除原发性PTC连续标本74例。其中男21例,女53例,年龄17~72岁,平均(47±12)岁。根据AJCC第8版甲状腺癌分期标准[4],以55岁作为诊断年龄切点,<55岁57例,≥55岁17例;I期59例,II期10例,III~IV期5例。按2004年WHO颁布的PTC分类分为经典型66例,滤泡亚型8例。肿瘤直径≤2 cm 50例,>2 cm且≤4 cm 20例,>4 cm 4例。甲状腺外浸润55例,未浸润19例。淋巴结转移40例,未转移34例。35例伴有CLT(CLT),39例不伴有CLT(Non-CLT)。选取甲状腺癌组织边缘>2 cm或对侧正常甲状腺组织作癌旁对照组。所有标本的患者术前均未接受治疗。
1.2 主要试剂 兔抗人单克隆抗体PD-L1(SP142)购自北京中杉金桥生物技术有限公司,EnVision检测试剂盒和DAB显色试剂盒均购自丹麦Dako公司,人类BRAF V600E基因突变检测试剂盒购自厦门艾德生物医药科技有限公司。
1.3 方法 所有手术标本均经4%中性甲醛溶液固定,石蜡包埋,4 μm连续切片,HE染色,光镜下评估肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)情况。PD-L1检测采用免疫组织化学Envision两步法,以PBS代替一抗作为阴性对照,高温高压抗原修复,DAB显色。BRAF V600E基因检测采用Q-PCR法,操作步骤严格按照试剂说明书进行,石蜡组织提取DNA,样本DNA评估设有阳性质控品和阴性质控品(纯化水)。分析仪器:ABI 7500(Applied Biosystems,美国应用生物系统公司)。
1.4 结果判定 参照乳腺癌TILs评估标准[5],以单核炎症细胞占肿瘤间质面积的平均百分比评估:TILs占肿瘤间质≥10%为TILs-rich,TILs占肿瘤间质<10%为TILs-poor。PD-L1蛋白阳性诊断标准[6]:>5%的肿瘤细胞有明确的细胞膜或/和细胞质着色。BRAF V600E基因突变的判定:样本FAM信号Ct值<28为阳性,样本FAM信号Ct值≥28或低于试剂盒的检测下限为阴性。
1.5 统计学处理方法 采用SPSS13.0软件进行统计分析。单因素比较采用χ2检验,采用多因素logistic回归模型评估影响PD-L1蛋白表达的临床病理因素,采用Kappa一致性检验评判PD-L1蛋白表达和BRAF V600E基因突变的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1蛋白的表达 PD-L1蛋白在PTC组织中的阳性表达率为48.6%(36/74),以肿瘤细胞的灶性表达为主,主要表现为细胞膜和(或)细胞质强弱不等的棕黄色着色;对照组PD-L1蛋白的表达率为0(0/74)。PTC组与对照组的PD-L1蛋白表达差异有统计学意义(χ2=47.571,P<0.001)。见图1。

图1 PD-L1蛋白在PTC组织中的表达
2.2 PD-L1蛋白表达与PTC临床病理特征的关系 PDL1蛋白在不同年龄、肿瘤大小、TILs丰富程度、CLT背景及临床分期组别中的表达差异均有统计学意义(P<0.05);PD-L1蛋白在不同性别、不同组织学类型、有无腺外浸润及有无淋巴结转移组别中的表达差异均无统计学意义(P>0.05)。见表1。
2.3 BRAF V600E基因突变与PTC临床病理特征的关系 74例PTC中BRAF V600E基因突变的阳性率为79.7%(59/74)。对照组中BRAF V600E基因突变的阳性率为0(0/74)。差异有统计学意义(P<0.01)。BRAF V600E基因突变与PTC的组织学分型有关(P<0.01);BRAF V600E基因突变在不同性别、年龄、肿瘤大小、CLT背景、TILs丰富程度、有无腺外浸润、有无淋巴结转移及临床分期组别中的差异均无统计学意义(P>0.05)。见表2。
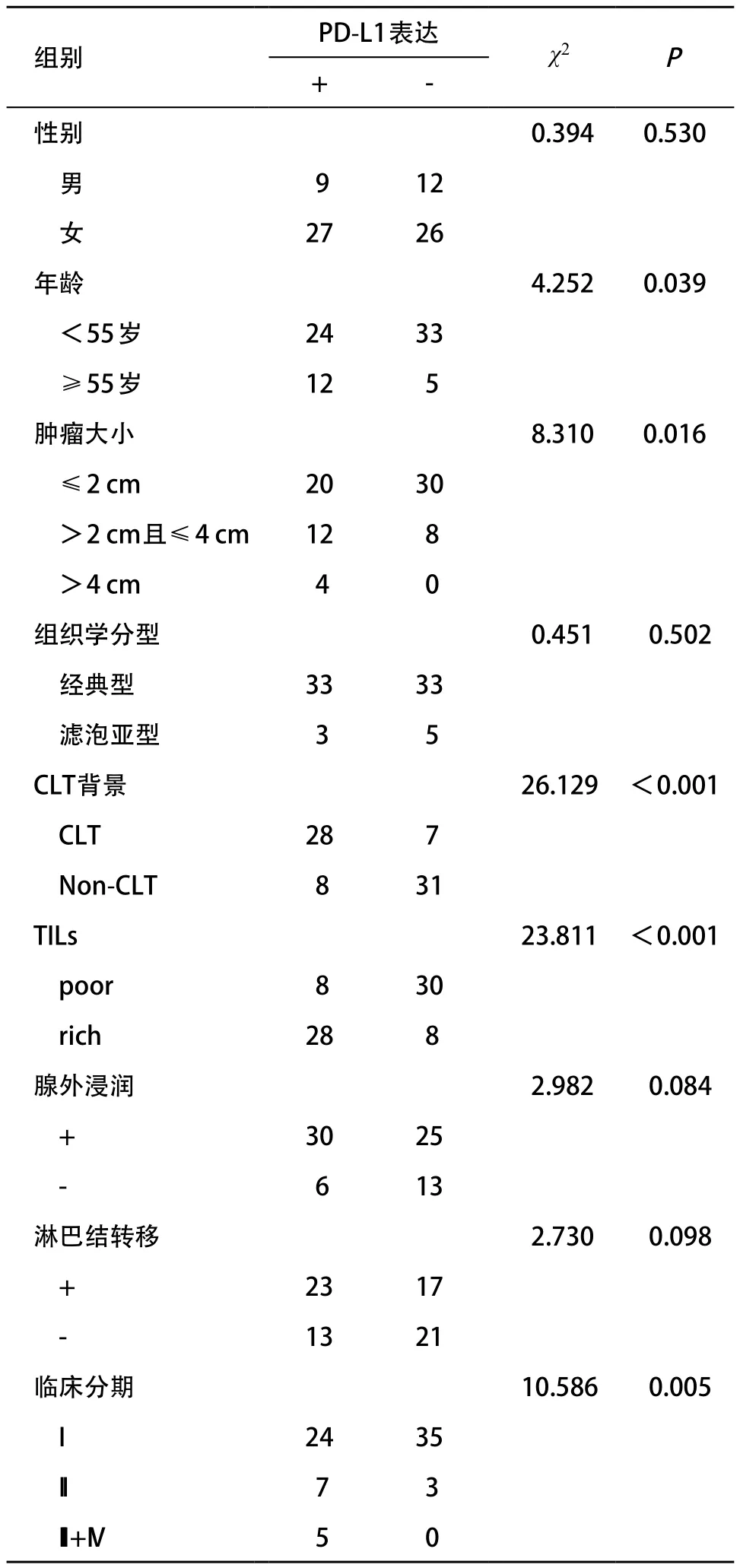
表1 PD-L1蛋白表达与PTC临床病理参数的关系(例)
2.4 PTC组织中PD-L1蛋白表达和BRAF V600E基因突变的相关性 在PD-L1蛋白阳性表达的PTC组织中BRAF V600E基因突变率为75.0%(27/36),在PD-L1蛋白阴性表达的PTC组织中BRAF V600E基因突变率为84.2%(32/38)。Kappa检验统计分析表明,在PTC组织中,PD-L1蛋白表达和BRAF V600E基因突变之间缺少一致性(Kappa=-0.091,P=0.325)。

表2 BRAF V600E基因突变与PTC临床病理参数的关系(例)
2.5 PD-L1蛋白表达的影响因素 取年龄、肿瘤大小、CLT背景、TILs丰富程度、临床分期为自变量,以PD-L1蛋白表达为应变量,采用进入法做logistic回归分析,结果显示CLT背景是影响PD-L1蛋白表达的独立因素(OR=18.675,95%CI:3.074~113.453,P<0.01)。见表3。
3 讨论
PD-L1又称B7同源分子1(B7 homologue 1,B7-H1),是程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)的配体。PD-L1基因定位于人染色体的9p24,编码含有290个氨基酸的I型跨膜蛋白。PD-L1蛋白和PD-1结合后,由PD-1传递抑制性信号,调控淋巴细胞功能,诱导机体产生免疫抑制。此外,PD-1还可抑制炎性介质的释放,影响T细胞的分化,促进调节性T细胞的生成。PD-1/PD-L1通路参与了肿瘤的免疫应答调控,在肿瘤免疫耐受的建立及自身免疫性疾病的发生、发展中发挥着重要作用。近年来,以PD-L1为靶点的免疫检查点阻断疗法已广泛应用于多种肿瘤的临床治疗[7]。研究表明,PD-L1可以在多种肿瘤细胞中诱导表达,如恶性黑色素瘤、非小细胞肺癌、乳腺癌、肾癌等[8]。PDL1蛋白在PTC中也有表达,但目前相关的研究仍然较少。CHOWDHURY等[9]的研究发现,PD-L1在66.5%的PTC病例中呈细胞质阳性表达,40.0%的病例呈细胞膜阳性表达。本研究结果显示,PD-L1蛋白在PTC组织中的阳性表达率为48.6%,阳性部位主要定位在肿瘤细胞的细胞膜或/和细胞质上,PD-L1蛋白在PTC组与对照组中的表达差异显著(P<0.01),这与上述研究结果一致。
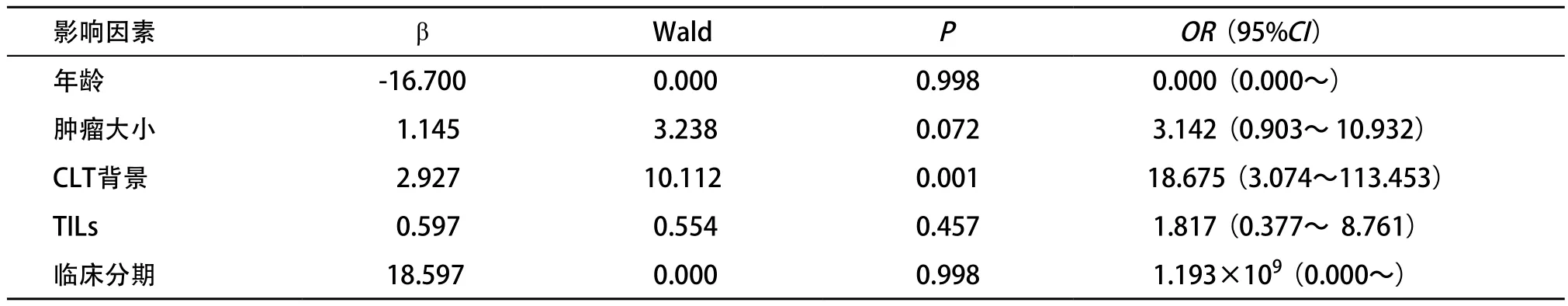
表3 PD-L1蛋白表达影响因素logistic回归分析
至少有1/3的PTC组织中伴有CLT。HAYASHI等[10]发现,PD-L1基因的单核苷酸多态性在Graves病的发展过程中起着重要的作用。而Graves病的组织学主要表现就是CLT。本组结果显示,PTC组织中CLT的比例达到47.3%(35/74),CLT组与Non-CLT组间的PD-L1蛋白表达差异具有统计学意义,且CLT背景是影响PD-L1蛋白表达的独立因素。可以推测,CLT与PD-L1蛋白之间可能存在着相同的信号通路,CLT可能是影响抗PD-L1免疫治疗的重要因素。这有待于进一步的研究证实。随着免疫检查点阻断疗法在肿瘤患者中的应用,研究者们发现抗PD-L1免疫治疗只对某种肿瘤的一部分患者有效[11]。这种差异不仅和肿瘤中PD-L1蛋白表达有关,而且也和TILs的表达水平有关。这就要求我们必须根据PD-L1蛋白的和TILs的表达水平对不同病例采取个性化的免疫治疗方法[12]。本研究显示PD-L1蛋白在PTC组织中的表达随着TILs的递增而递增,证实了PD-L1蛋白的阳性表达与TILs的丰富程度有关。这与BAI等[6]的研究结果一致。此外,越来越多的研究认为,PDL1蛋白表达可以作为判断PTC预后的重要指标,PDL1蛋白表达阳性预示着更大的复发风险和更短的无病生存期[9]。众所周知,PTC的诊断年龄是PTC预后的独立危险因素[13-14]。本研究结果显示,高年龄组的PD-L1阳性率高于低年龄组,PD-L1蛋白的表达与肿瘤大小及临床分期有关,证实了PD-L1蛋白的阳性表达可能与PTC的侵袭性特征和不良预后有关。
BRAF V600E基因突变是PTC最常见的基因突变,对PTC的诊断、鉴别诊断及预后判断均有重要价值[15]。BRAF V600E基因定位于人染色体7q34,编码一种丝/苏氨酸蛋白激酶,是MAPK激酶家族中最高效的磷酸化剂。目前能检测到的BRAF V600E基因突变已经超过30种,其中T1799A点突变是最常见的BRAF V600E激活突变[16]。研究结果表明,不同国家PTC组织中的BRAF V600E基因突变检出率不同,欧美国家BRAF V600E突变率低于亚洲国家,说明BRAF V600E基因突变可能存在种族差异。XING等[3]总结了1856例PTC检测结果,发现BRAF V600E的突变率为44%。本研究BRAF V600E基因突变的阳性率为79.7%,与亚洲国家的检出率相仿[6]。研究表明,BRAF V600E基因突变是PTC预后不良的指标[15]。本组结果显示,BRAF V600E基因突变率在不同性别、年龄、肿瘤大小、CLT背景、TILs丰富程度、腺外浸润、淋巴结转移及临床分期中的组间差异均无统计学意义,这可能与入组的中晚期患者过少有关,有待后续更大样本的研究。本组BRAF V600E基因突变与PTC的经典型组织学类型有关,与文献[3]相符。ANGELL等[17]发现伴有BRAF V600E基因突变的PTC与PD-L1蛋白表达增高密切相关。而BAI等[6]通过免疫组织化学染色分析了126例PTC病例,结果显示BRAF V600E的阳性表达与PD-L1蛋白的表达没有相关性,这与BASTMAN等[18]的研究结果一致。本研究通过Kappa检验分析,并未发现PD-L1蛋白表达与BRAF V600E基因突变存在相关性。
综上所述,PD-L1作为一种新的分子标记物,有望成为PTC侵袭性特征的指标,其表达与PTC的临床病理特征有关。现阶段对于PD-L1蛋白表达与BRAF V600E基因突变的报道各异,可能与BRAF V600E基因突变在不同人种中的表达差异有关;同时,目前免疫组织化学检测PD-L1尚无统一的阳性标准,不同克隆号抗体的阳性截点不同,也导致了统计结果之间的差异。因此,对于PD-L1蛋白表达与BRAF V600E基因突变的相关性,仍需更深入的研究分析。
