紫胡萝卜花青素微胶囊工艺优化
2018-11-15刘战霞程卫东王斌刘玥彤李梦杰
刘战霞,程卫东,王斌,刘玥彤,李梦杰
(石河子大学 食品学院,新疆 石河子 832000)
紫胡萝卜是胡萝卜的一个品种,其颜色呈现紫黑色,花青素属于多酚类物质且是紫胡萝卜重要的生物活性物质,不仅有较强的抗氧化能力,是一种天然、高效的抗氧化剂,还有预防高血压、抗菌、抗炎、抗癌等作用,此外还有改善视力和眼部疲劳的功效[1-3]。花青素是一种水溶性色素,是植物的二级代谢产物,具有重要的生理作用,属类黄酮化合物,是羟基的供体,能够与蛋白质结合防止过氧化,也可清除自由基及鳌合金属离子[4-6]。微胶囊技术是当今一种在食品工业领域中应用广泛且发展迅速的新技术[7-9]。如今人们对绿色、健康的生活水平的不断追求,功能保健产品也受到了广大消费者的关注,因此,会有广阔的市场前景。作为功能保健品,其生理活性物质是必不可少的,紫胡萝卜花青素具有增强机体免疫、抗衰老、抗癌等活性[10]。
紫胡萝卜花青素对光、热等十分敏感,这极大地限制了它的使用价值。因此我们将紫胡萝卜花青素制成微胶囊[11],包埋、封存在一种具有聚合物的壁壳内,使其性能和生物活性不被暴露出来,提高它在功能性产品中的可用性,且促进其生理功能的发挥[12]。目前国内外对紫胡萝卜微胶囊的研究还处于初步阶段,因此,此研究为后续研究奠定了重要基础[13]。
1 材料与方法
1.1 原料与试剂
紫胡萝卜:自有紫胡萝卜种植基地提供。
纤维素酶、果胶酶、麦芽糊精、大豆分离蛋白:均购自北京索莱宝科技有限公司;单甘脂:成都市科龙化工试剂厂;乙醇:分析纯,北京化工。
1.2 仪器与设备
电子分析天平 梅特勒-托利多仪器(上海)有限公司;旋转蒸发仪 南通经典包装有限公司;磁力搅拌器;标准型pH计、紫外分光光度计 上海精密科学仪器有限公司;恒温水浴锅 金坛市医疗仪器厂;喷雾干燥机 重庆干燥设备有限公司。
1.3 方法
1.3.1 原料预处理
将新鲜的紫胡萝卜洗干净,切成小块状再干燥处理,用搅拌机打碎,放冰箱内保存好。
1.3.2 花青素的提取工艺
取一定量打碎的紫胡萝卜粉→加入双酶(纤维素酶、果胶酶)→加入乙醇浸泡→抽滤→蒸去乙醇、水溶→测吸光值[14]。
1.3.3 紫胡萝卜花青素提取工艺优化
单因素影响试验主要考察复合酶比例(果胶酶∶纤维素酶)、加酶量、提取时间、提取温度等因素对原花青素提取率的影响,试验重复3次。在前期单因素试验的基础上,采用响应曲面法试验设计采用Box-Behnken模型,以复合酶比例(果胶酶∶纤维素酶)、加酶量、提取时间、提取温度为主要考察因素(自变量)[15],Box-Behnken试验因素与水平见表1。

表1 Box-Behnken试验因素与水平
1.3.4 花青素提取率[16]
花青素含量(mg/g)=A×Mw×DF×100/(ε×1)。
式中:A为(OD533 nm,pH 2.0-OD700 nm,pH 2.0)-(OD533 nm,pH 4.5-OD700 nm,pH 4.5);Mw为矢车菊素葡萄糖苷的摩尔质量,449.2 g/mol;DF为溶液的稀释倍数;ε为矢车菊素葡萄糖苷的摩尔消光系数,26900 L/mol·cm。
1.3.5 花青素微胶囊的制备工艺[17]
壁材、水合乳化剂、芯材→均质乳化→乳化喷雾干燥→微胶囊产品。
避光,将花青素溶于乙醇中,加入一定量的乳化剂(单甘脂)制成芯材溶液,加入溶解好的壁材溶液,磁力搅拌均匀,得到的混合液经胶体磨均质乳化,在一定条件下进行喷雾干燥,制成花青素微胶囊。
1.3.6 微胶囊化工艺优化
1.3.6.1 单因素(以包埋率为指标)
分别以不同的芯材壁材比例(1∶5,2∶5,3∶5,4∶5)、壁材比例(1∶5,2∶5,3∶5,4∶5)、固形物含量(15%,20%,25%,30%)、单甘脂添加质量分数(1.5%,2%,2.5%,3.0%)为影响因素,考察其对提取工艺的影响。
1.3.6.2 正交试验
根据单因素试验结果,选取微胶囊化芯材壁材质量比、壁材质量比、固形物含量、 单甘酯添加质量分数4个因素,每个因素确定4水平,按表2中L9(34)正交试验,以微胶囊化效率为评价指标,确定最佳微胶囊化工艺。

表2 正交试验方案
1.3.7 微胶囊化的效果评定[18]
微胶囊化效率和微胶囊化产率是评价微胶囊化效果的主要指标。微胶囊化效率被定义为芯材原花青素实际被包埋量与理论被包埋量的比值,是衡量原花青素被包埋的程度;微胶囊化产率被定义为微胶囊产品中所含芯材原花青素与理论总原花青素含量之比[19]。
2 结果与分析
2.1 紫胡萝卜中花青素提取的单因素试验
2.1.1 复合酶比例(果胶酶∶纤维素酶)
取色素溶液50 mL,加酶量2.0%,酶解温度60 ℃, 酶解时间60 min,分别在复合酶比例为1∶1,1.5∶1,2∶1,2.5∶1 (g/g)进行提取,提取结果见图1。
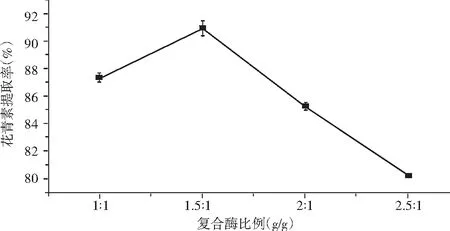
图1 复合酶比例对花青素提取率的影响
由图1 可知,随着复合酶比例的增大,花青素提取率的值先增大后减少。当复合酶比例为1.5∶1 时,花青素的提取率最大,这是由于当复合酶比例低于1.5∶1时,浸提不充分,不利于紫胡萝卜中花青素的溶出。当复合酶比例为1.5∶1 时,紫胡萝卜中花青素已基本溶解完全。因此,确定最佳的复合酶比例为1.5∶1。
2.1.2 加酶量
取色素溶液50 mL,复合酶比例1.5∶1, 酶解温度60 ℃, 酶解时间60 min,加酶量分别在为1%,1.5%,2%,2.5%进行提取,提取结果见图2。
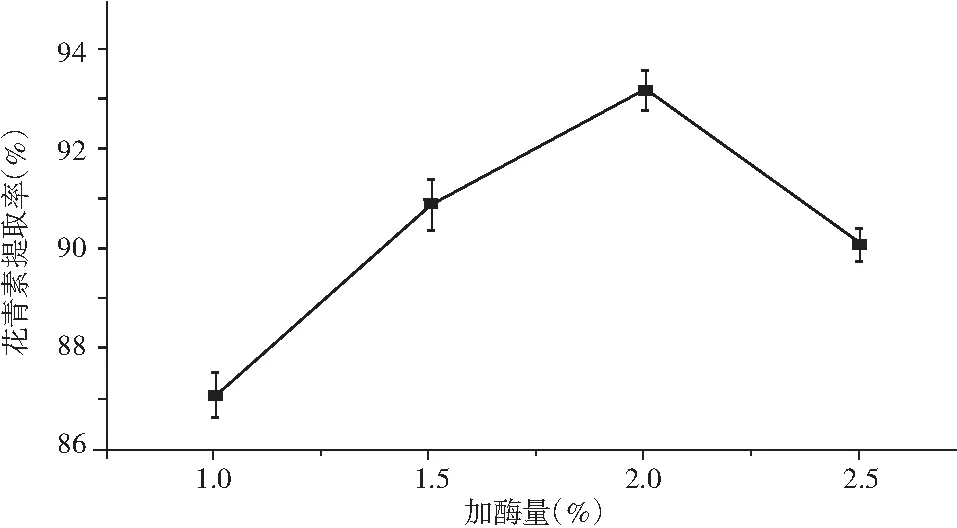
图2 加酶量比例对花青素提取率的影响
由图2 可知,随着加酶量的增大,花青素提取率的值先增大后减少。当加酶量为2.0% 时,花青素的提取率最大,这是由于当加酶量低于2.0% 时,浸提不充分,不利于紫胡萝卜中花青素的溶出。当加酶量为2.0% 时,紫胡萝卜中花青素已基本溶解完全。因此,确定最佳的加酶量为2.0%。
2.1.3 酶解时间
取色素溶液50 mL,复合酶比例1.5∶1,加酶量2.0%, 酶解温度60 ℃ ,酶解时间分别在为30,60,90,120 min进行提取,提取结果见图3。
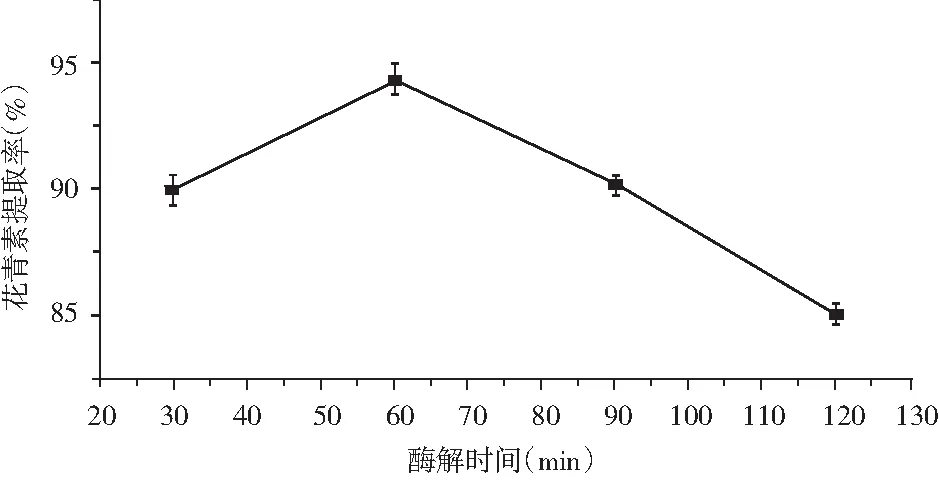
图3 酶解时间对花青素提取率的影响
由图3可知,当酶解时间为60 min 时,紫胡萝卜中花青素的提取率最高。酶解时间过短,花青素溶出不充分;酶解时间过长,可能会造成溶解的杂质成分过多。因此,确定最佳酶解时间为60 min。
2.1.4 酶解温度
取色素溶液50 mL,复合酶比例1.5∶1,加酶量2.0%, 酶解时间60 min ,酶解温度分别在为30,60,90,120 ℃进行提取,提取结果见图4。
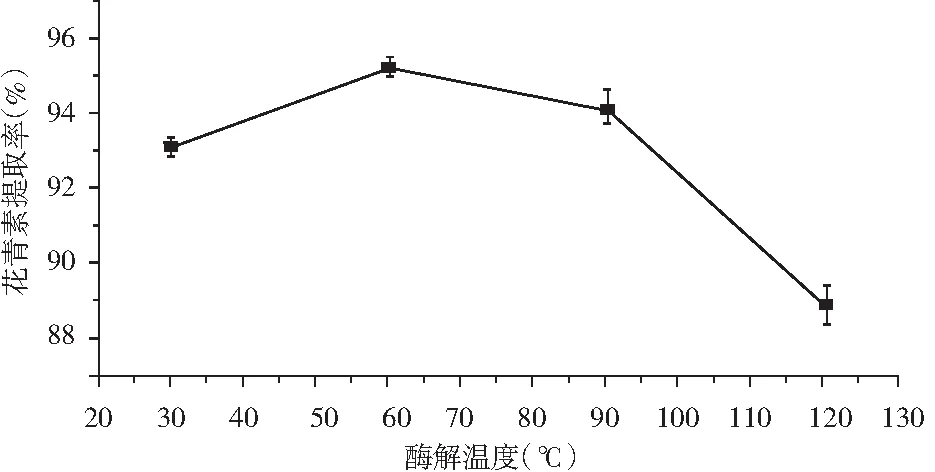
图4 酶解温度对花青素提取率的影响
由图4 可知,酶解温度在60 ℃时,紫胡萝卜中花青素的提取率最高。当温度高于60 ℃时,随温度的变化,花青素的提取率变化较小,这说明60 ℃是紫胡萝卜中花青素提取的最佳温度。当酶解温度过高时,可能是较高的温度破坏了花青素的有效活性成分。
2.2 紫胡萝卜花青素提取率的响应面试验
在单因素试验的基础上,为优化单因素试验得到的工艺条件,选取复合酶比例(A)、加酶量(B)、酶解时间(C)、酶解温度(D)为4个影响因子,以紫胡萝卜花青素得率(Y)为响应值进行Box-Behnken试验设计,优化紫胡萝卜花青素提取率。响应面设计方案及试验结果见表3。
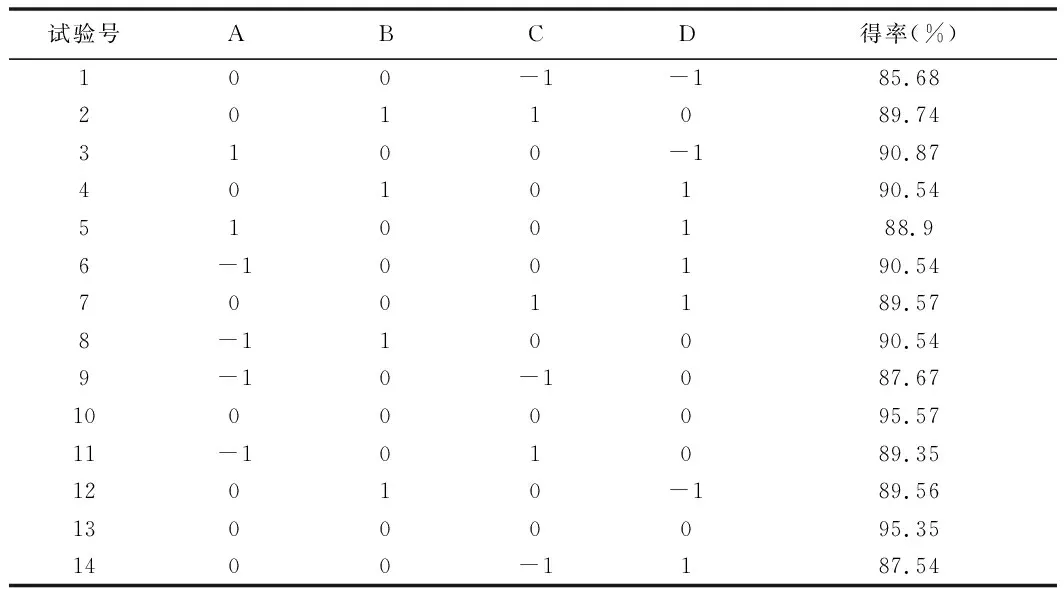
表3 响应面设计方案与试验结果
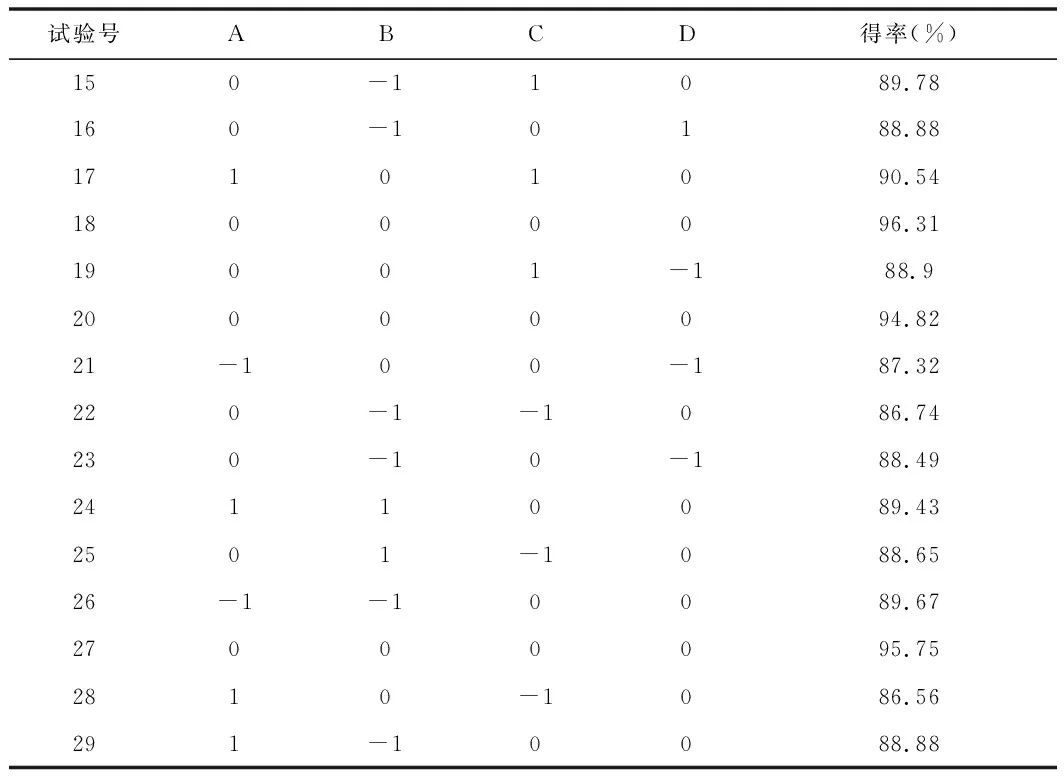
续 表
根据试验结果建立得到花青素提取率Y与A,B,C,D的二次回归实际模型方程为:
Y=+95.56+7.500E-003A+0.50B+1.25C+0.43D-0.080AB+0.58AC-1.30AD-0.49BC+0.15BD-0.30CD-2.93A2-2.85B2-4.12C2-3.36D2。为检验方程的有效性,进一步对其进行方差分析及模型分析,结果见表4。
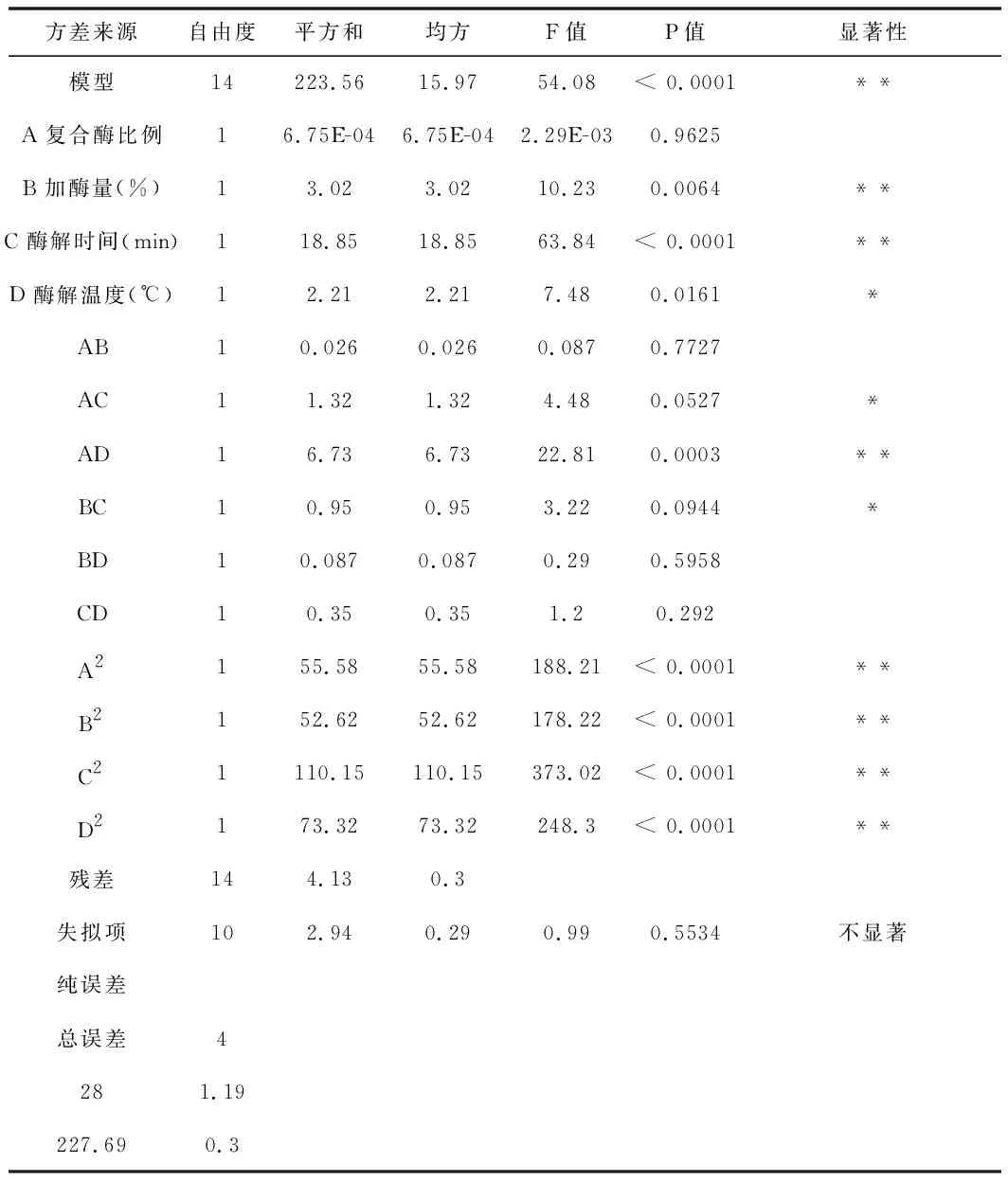
表4 模型回归系数显著性检验及结果
在本试验中,模型显著性检验、回归方程分析显著性检验表明失拟项P=0.5534>0.05,失拟项不显著,回归显著。另外,模型相关系数R2=0.9818,回归模型P<0.0001,回归方差是高度显著的,说明回归方程的拟合度较好,试验误差比较小,模型调整相关系数Radj2=0.9637,说明该模型能解释96.37%响应值的变化。回归方程系数显著性检验结果显示单因素中一次项复合酶比例、加酶量、酶解温度和酶解时间对紫胡萝卜花青素提取率有显著的影响。各单因素交互作用(AB,AC,AD,BC,BD,CD)的响应面及等高线图见图5~图10。
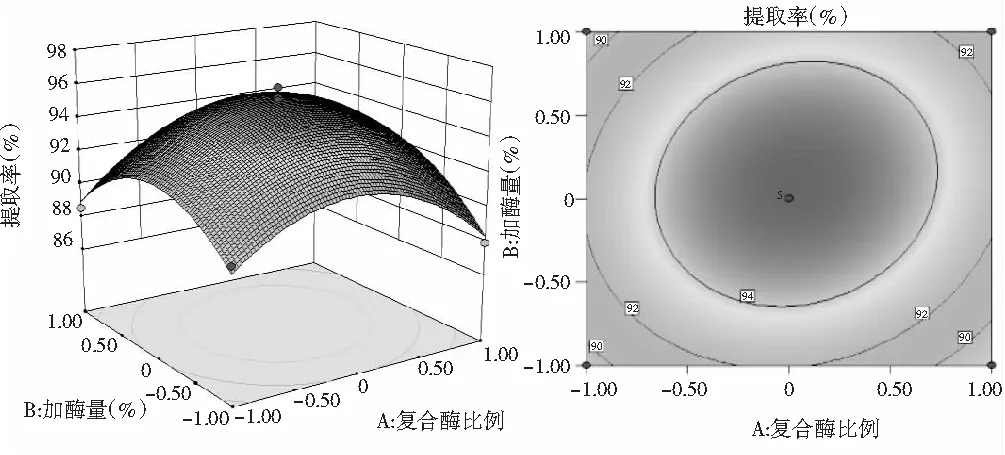
图5 Y=(A,B)的响应面图与等高线图
由图5可知,当复合酶比例不变时,提取率随着加酶量的增加先上升后下降。当加酶量一定时,随着复合酶比例的增大,提取率增大,达到最大值后又迅速减小。等高线图接近圆形,说明复合酶比例和加酶量的交互作用不显著。
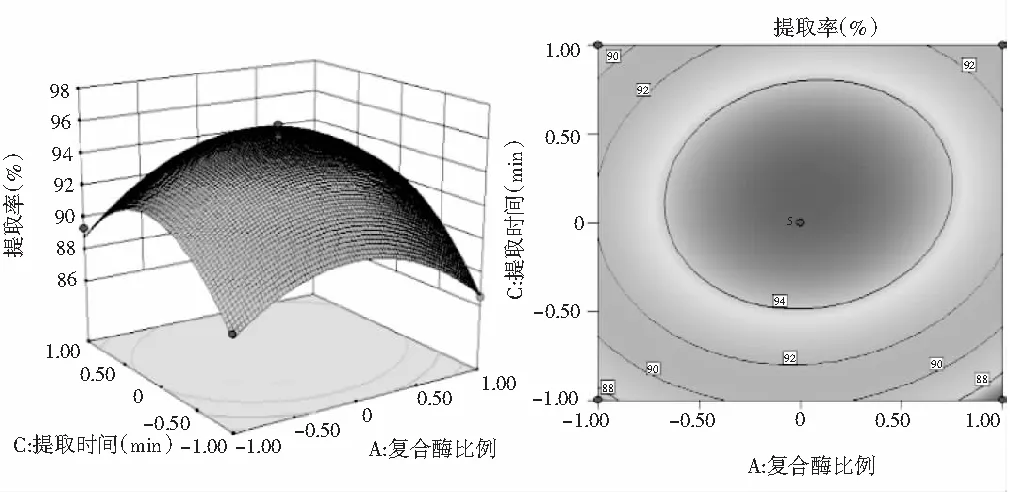
图6 Y=(A,C)的响应面图与等高线图
由图6可知,当复合酶比例不变时,提取率随着提取时间的增加先上升后下降。当提取时间一定时,随着复合酶比例的增大,提取率增大,达到最大值后又迅速减小。等高线图接近圆形,说明复合酶比例和提取时间的交互作用不显著。
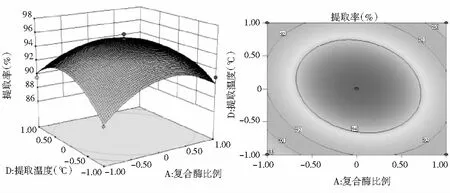
图7 Y=(A,D)的响应面图与等高线图
由图7可知,当复合酶比例不变时,提取率随着提取温度的增加先上升后下降。当提取温度一定时,随着复合酶比例的增大,提取率增大,达到最大值后又迅速减小。等高线图接近椭圆形,说明复合酶比例和提取温度的交互作用显著。
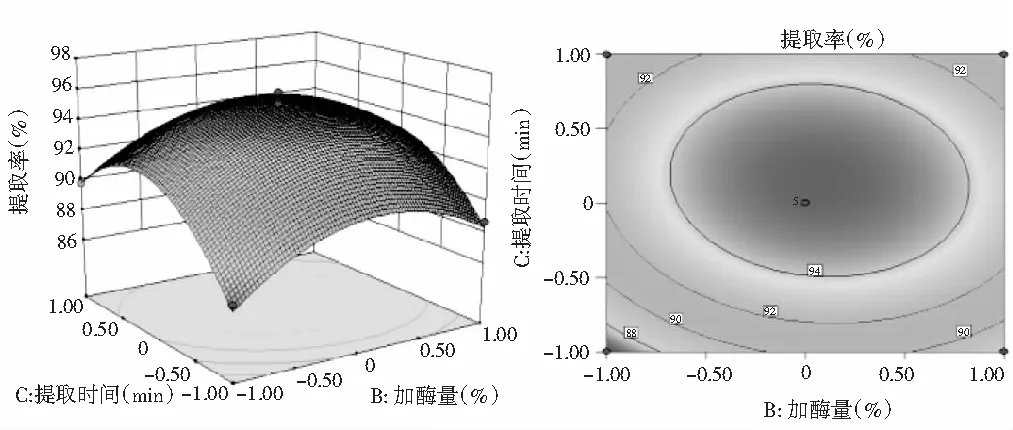
图8 Y=(B,C)的响应面图与等高线图
由图8可知,当加酶量不变时,提取率随着提取时间的增加先增大后减小。当提取时间一定时,随着加酶量的增大,提取率增大,达到最大值后又迅速减小。等高线图接近椭圆形,说明提取时间和加酶量的交互作用显著。
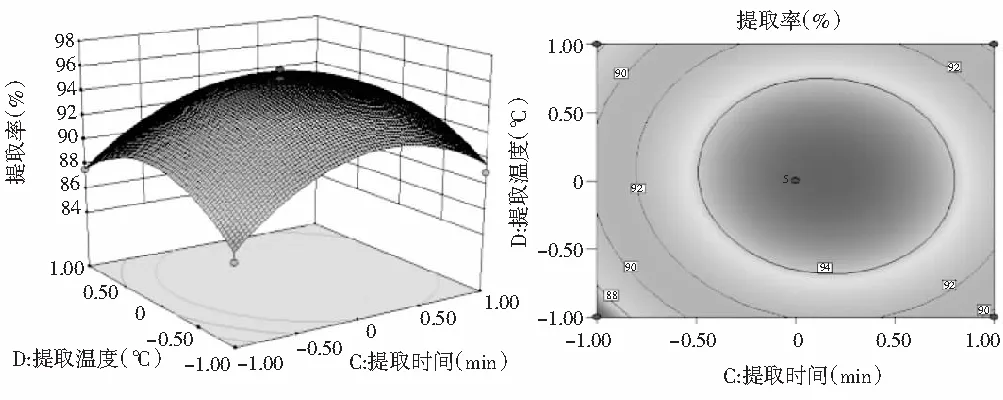
图9 Y=(C,D)的响应面图与等高线图
由图9可知,当提取时间不变时,提取率随着提取温度的增加先上升后下降。当提取温度一定时,随着提取时间的增大,提取率增大,达到最大值后又迅速减小。等高线图接近椭圆形,说明提取时间和提取温度的交互作用显著。
由图10可知,当加酶量不变时,提取率随着提取温度的增加先上升后下降。当提取温度一定时,随着加酶量的增大,提取率增大,达到最大值后又迅速减小。等高线图接近椭圆形,说明提取温度和加酶量的交互作用显著。
2.3 微胶囊工艺单因素试验
分别以不同的芯材与壁材质量比(1∶5,2∶5,3∶5,4∶5)、壁材比例(1∶5,2∶5,3∶5)、固形物含量(15%,20%,25%)、单甘脂添加质量分数(1.5%,2%,2.5%)为影响因素,考察其对提取工艺的影响。
2.3.1 芯材壁材质量比
取5 mL花青素溶液,壁材比例2∶5,固形物含量20%, 单甘脂添加质量分数2%,芯材壁材比例分别为1∶5,2∶5,3∶5,4∶5,以花青素包埋率为指标,结果见图11。
喷雾干燥法制备的微胶囊中,芯材有效载量可达到60%~70%,但一般为20%~40%。由图11可知,随着芯材与壁材比例的提高,花青素包埋率增加,但当芯材与壁材的比例提高到3∶5时,产品效率下降,这可能是因为芯材载量过高,囊壁强度减弱,产品不耐摩擦或挤压,从而降低了壁材对芯材的包覆效果,导致产品的效率较低。
2.3.2 壁材质量比
取5 mL花青素溶液,芯材壁材比例3∶5,固形物含量20%, 单甘脂添加质量分数2%,壁材质量比分别为1∶5,2∶5,3∶5,4∶5,以花青素包埋率为指标,结果见图12。
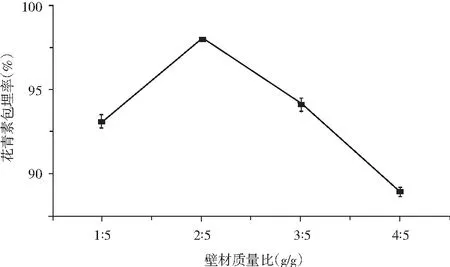
图12 壁材质量比对花青素微胶囊包埋率的影响
由图12可知,随着壁材质量比的提高,花青素包埋率增加,但当壁材质量比提高到2∶5时,产品效率下降,其原因是芯壁比增加后,芯壁混合溶液粘稠度增加,微胶囊成型效果差,导致花青素包埋率降低。因此,微胶囊制备的最佳壁材质量比为2∶5。
2.3.3 固形物含量
取5 mL花青素溶液,芯材壁材比例3∶5,固形物含量20%, 单甘脂添加质量分数2%,壁材质量比分别为1∶5,2∶5,3∶5,4∶5,以花青素包埋率为指标,结果见图13。
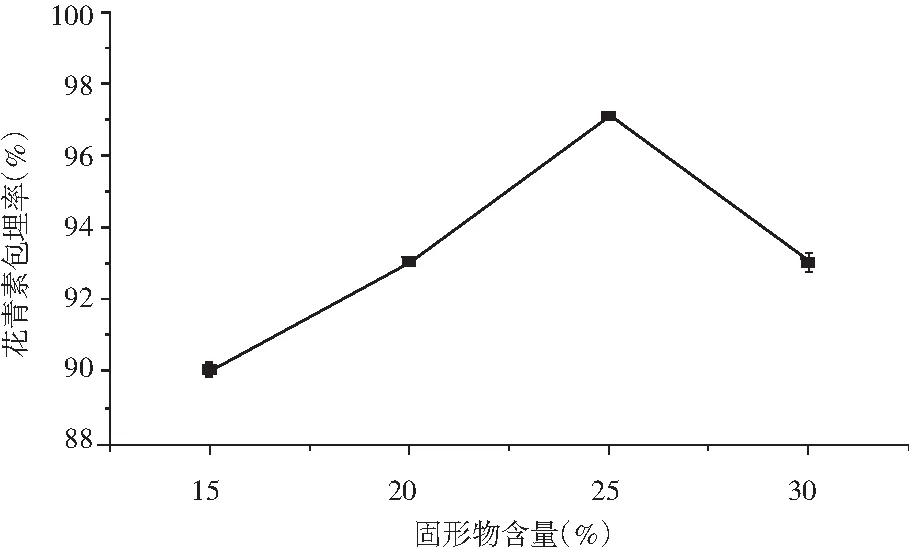
图13 固形物含量比对花青素微胶囊包埋率的影响
由图13 可知,随着固形物浓度的增加,微胶囊产品的效率先上升后下降。这可能是因为固形物浓度增加时,体系的粘度增大,减少了芯材向壁材表面的迁移,有利于喷雾干燥过程中囊壁的形成和致密性的提高。但是当固形物含量过高时,进料黏度的增大使料液的雾化困难,导致料液在干燥筒中粘壁严重,使喷头发生堵塞现象。
2.3.4 单甘脂添加质量分数
取5 mL花青素溶液,芯材壁材比例3∶5,壁材质量比2∶5,固形物含量20%,单甘酯添加质量分数1.0%,1.5%,2.0%,2.5%,以花青素包埋率为指标,结果见图14。

图14 单甘脂添加量对花青素微胶囊包埋率的影响
由图14可知,随着单甘脂添加质量分数增大,花青素包埋率增加,但当单甘脂添加质量分数提高到1.5%时,产品效率下降,其原因是芯壁比增加后,芯壁混合溶液粘稠度增加,微胶囊成型效果差。导致花青素包埋率降低。因此,微胶囊制备的最佳单甘酯添加量为1.5%。
2.4 微胶囊工艺正交试验

表5 正交试验表
表5为以效率为指标的极差分析,比较4个因素的极差R,影响花青素包埋率的主要因素顺序为固形物含量>壁材中大豆分离蛋白∶麦芽糊精(质量比)>芯材壁材比例>单甘脂含量,最佳配比是A3B3C3D1,即当固形物含量为20%、壁材中大豆分离蛋白∶麦芽糊精(质量比)为3∶5、芯材∶壁材(质量比)为2∶5,微胶囊包埋效率和得率均为最高。用上述条件做验证试验,得到的微胶囊效率和得率分别为98.5%和87.3%。
3 结论
通过单因素试验初步分析紫胡萝卜花青素提取工艺的条件影响,在此基础上,采用Box-Benhnken试验,以花青素提取率为响应值,以复合酶比例(纤维素酶、果胶酶)、加酶量、酶解温度和酶解时间4个因素为响应因子建立二次回实际方程模型。经检验,该方程拟合较好,可真实地反映花青素提取率变化的动态过程,同时可以预测其理论值。依据二次回归方程,确定了花青素提取率的最佳工艺条件:复合酶比例1.5∶1,加酶量2.0%,酶解温度60 ℃,酶解时间60 min。
以大豆分离蛋白、麦芽糊精为壁材,采用喷雾干燥法制备花青素微胶囊,以花青素微胶囊包埋率为指标,通过单因素和正交试验对花青素微胶囊的配方和工艺进行了研究,获得了制备花青素微胶囊的最佳工艺条件:芯材壁材比例为2∶5,壁材质量比(大豆蛋白、麦芽糊精)为3∶5,固形物含量为20%,单甘脂添加质量分数为1.5%,按此最佳工艺条件制备的花青素微胶囊包埋率达95.31%。
