MCT1抑制剂AZD3965增强肝癌细胞对表柔比星敏感性的作用
2018-11-09王先知崇殿龙李其响王仲崑
王先知,张 配,崇殿龙,李其响,潘 琼,李 璐,王仲崑,魏 芳,刘 浩
(蚌埠医学院药学院,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail:liuhao6886@foxmail.com;#共同通讯作者,E-mail:weifangmailbox@126.com)
肝癌是最常见的恶性肿瘤之一,其病情进展迅速、治疗困难,已成为世界性难题。由于肝癌早期诊断困难,许多患者在确诊时己发生肝内播散或远处转移,无法手术切除。因此化学治疗在肝癌的治疗中占据着重要地位。表柔比星(EPI)是新一代的蒽环类抗肿瘤药物,是用于肝癌治疗的一线化疗药物。但随着耐药性的出现使其应用受到很大限制。因此,寻找联合用药方案,增加肝癌细胞对表柔比星的敏感性,对于肝癌的治疗具有重要的意义。
单羧酸转运蛋白1(MCT1)是哺乳动物细胞膜上的一种重要跨膜转运蛋白,在乳酸转运、pH调节以及能量代谢方面发挥重要的作用[1]。近年来,研究表明MCT1的表达和活性与癌细胞对某些化疗药物的敏感性密切相关,得到广泛关注[2-5]。目前还没有关于MCT1调节肝癌细胞对表柔比星敏感性方面的研究,本课题探究MCT1抑制剂AZD3965与表柔比星联合应用对肝癌细胞的抑制作用,并分析可能的机制,以期为肝癌的临床治疗提供新的思路和方案。
1 材料与方法
1.1 细胞株
肝癌HepG2细胞为中山大学惠赠,由蚌埠医学院生化药理实验室冻存。培养于含10%胎牛血清的DMEM高糖培养基中,37 ℃、5%CO2、饱和湿度培养。
1.2 主要试剂
DMEM高糖培养基、胰蛋白酶购于美国Gibco公司,胎牛血清购于杭州四季青公司,噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司,AZD3965购于美国Selleck公司,表柔比星购于浙江海正药业股份有限公司。
1.3 MTT法检测细胞存活率
取对数生长期细胞接种于96孔板,1×104个细胞/孔,培养24 h。分别用不同浓度AZD3965(0,10,20,40 μmol/L)、表柔比星(0,10,20,40 μmol/L)以及表柔比星(10,20,40 μmol/L)预处理细胞2 h再联合20 μmol/L AZD3965处理细胞,同时设阴性对照组和空白对照组,每组设置5个复孔。继续培养24 h,每孔加入20 μl MTT。继续培养4 h,缓慢吸弃上清,每孔加入150 μl DMSO,37 ℃温箱孵育30 min,酶标仪在波长490 nm下检测各孔吸光度。
1.4 集落克隆形成实验
取对数生长期细胞接种于6孔板,1×104个细胞/孔,培养24 h。分别用4 μmol/L AZD3965、0.01 μmol/L表柔比星以及0.01 μmol/L表柔比星预处理细胞2 h联合4 μmol/L AZD3965处理细胞,同时设空白对照组。培养箱内继续培养5 d,终止培养,吸弃上清并用PBS清洗2次,5%多聚甲醛-20 ℃固定15min,结晶紫室温染色10 min,PBS清洗2次,室温下干燥,拍照。
1.5 活细胞工作站观察AZD3965对表柔比星在HepG2细胞内分布的影响
取对数生长期细胞接种于12孔板,1.5×105个细胞/孔,培养24 h。分别用20 μmol/L表柔比星处理细胞4 h以及20 μmol/L表柔比星预处理细胞2 h再联合20 μmol/L AZD3965处理细胞2 h,同时设空白对照组。吸弃上清并用冰冷的PBS清洗3次,最后每孔加入0.5 ml PBS,利用蒽环类药物的荧光发色性,置入活细胞工作站的荧光显微镜下,调节适宜激发光和发射光波长,200倍镜下观察细胞内表柔比星的荧光情况。
1.6 流式细胞术检测AZD3965对表柔比星在HepG2细胞内积累的影响
取对数生长期细胞接种于12孔板,1.5×105个细胞/孔,培养24 h。分别用20 μmol/L表柔比星处理细胞4 h以及20 μmol/L表柔比星预处理细胞2 h再联合20 μmol/L AZD3965处理细胞2 h,同时设空白对照组。冰上收集细胞,冰冷的PBS清洗2次后用0.5 ml PBS重悬细胞,利用蒽环类药物的荧光发色性,用流式细胞仪检测各组细胞内表柔比星的平均荧光强度。
1.7 统计学分析
采用SPSS23.0软件进行分析,结果以均数±标准差表示,两组间差异采用单因素方差分析及t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 AZD3965增强表柔比星对HepG2细胞的增殖抑制作用
MTT结果显示,单独使用表柔比星(10,20,40 μmol/L)处理HepG2细胞24 h的存活率分别为(61.93±3.02)%,(59.87±1.14)%,(54.15±6.14)%。20 μmol/L AZD3965作用于HepG2细胞24 h的存活率为(73.25±6.21)%。AZD3965(20 μmol/L)联合表柔比星(10,20,40 μmol/L)处理HepG2细胞24 h,细胞存活率分别为(43.11±1.65)%,(45.27±1.09)%,(42.93±1.86)%。结果表明,在使用相同浓度的表柔比星时,与表柔比星单独使用组比较,表柔比星和20 μmol/L AZD3965联合使用组的细胞存活率明显下降,差异具有统计学意义(P<0.05,见图1)。
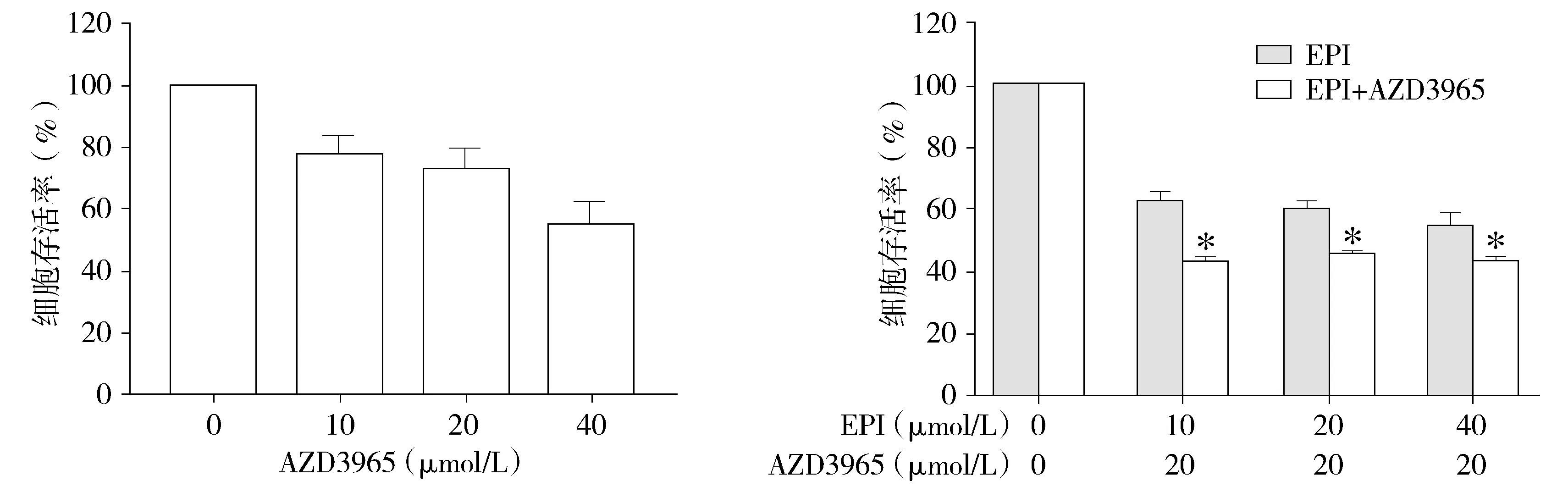
与EPI组比较,*P<0.05
2.2 AZD3965增强表柔比星对HepG2细胞集落克隆形成的抑制作用
为进一步观察AZD3965对表柔比星抑制HepG2细胞增殖作用的影响,使用4 μmol/L AZD3965和0.01 μmol/L表柔比星单独或联合处理细胞。结果表明,与表柔比星单用组相比,表柔比星与AZD3965联合使用时对HepG2细胞集落克隆的形成具有更加明显的抑制作用(见图2)。
2.3 AZD3965对表柔比星在HepG2细胞内分布的影响
为探究AZD3965增强表柔比星对HepG2细胞敏感性作用的机制,实验观察AZD3965对表柔比星在HepG2细胞内分布水平的影响。使用20 μmol/L表柔比星以及其联合20 μmol/L AZD3965处理细胞,利用蒽环类药物的荧光发色性,通过活细胞工作站观察表柔比星在HepG2细胞内的分布情况。结果表明,与表柔比星单用组相比,AZD3965可明显增强HepG2细胞内表柔比星的荧光强度(见图3)。
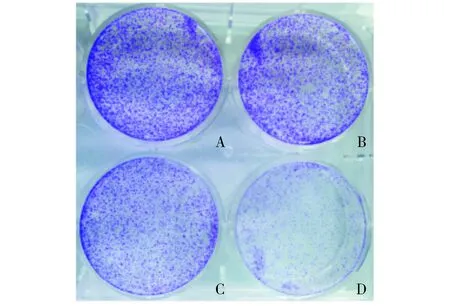
A.空白对照组;B.4 μmol/LAZD3965;C. 0.01 μmol/L EPI;D. 4 μmol/LAZD3965+0.01 μmol/L EPI
2.4 AZD3965对表柔比星在HepG2细胞内积累的影响
为定量检测AZD3965对表柔比星在HepG2细胞内积累水平的影响,单独使用20 μmol/L表柔比星以及其联合20 μmol/L AZD3965处理细胞,利用蒽环类药物的荧光发色性,通过流式细胞术检测HepG2细胞内表柔比星的平均荧光强度。结果显示,与单独使用表柔比星相比,当表柔比星与AZD3965联合处理细胞时,表柔比星的荧光曲线右移,细胞内平均荧光强度ΔMFI由ΔMFIB=58 035.22增强至ΔMFIC=168 965.42,与荧光显微镜所观察到的结果相一致(见图4)。
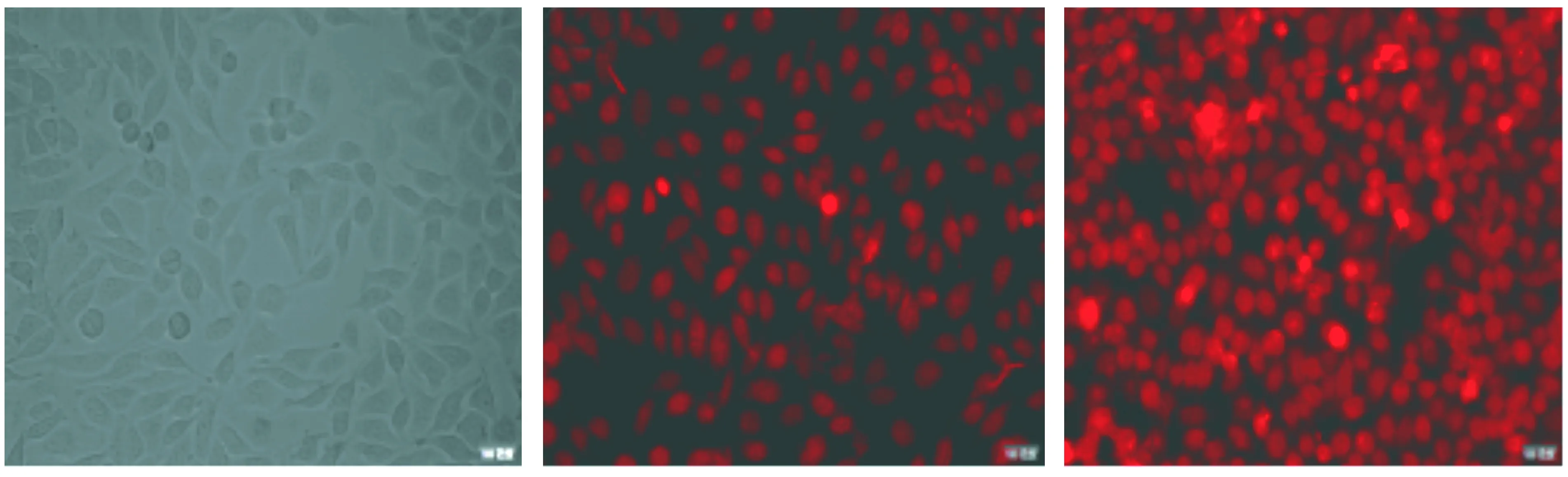
A.空白对照组B. 20 μmol/L EPIC. 20 μmol/L EPI+20 μmol/L AZD3965
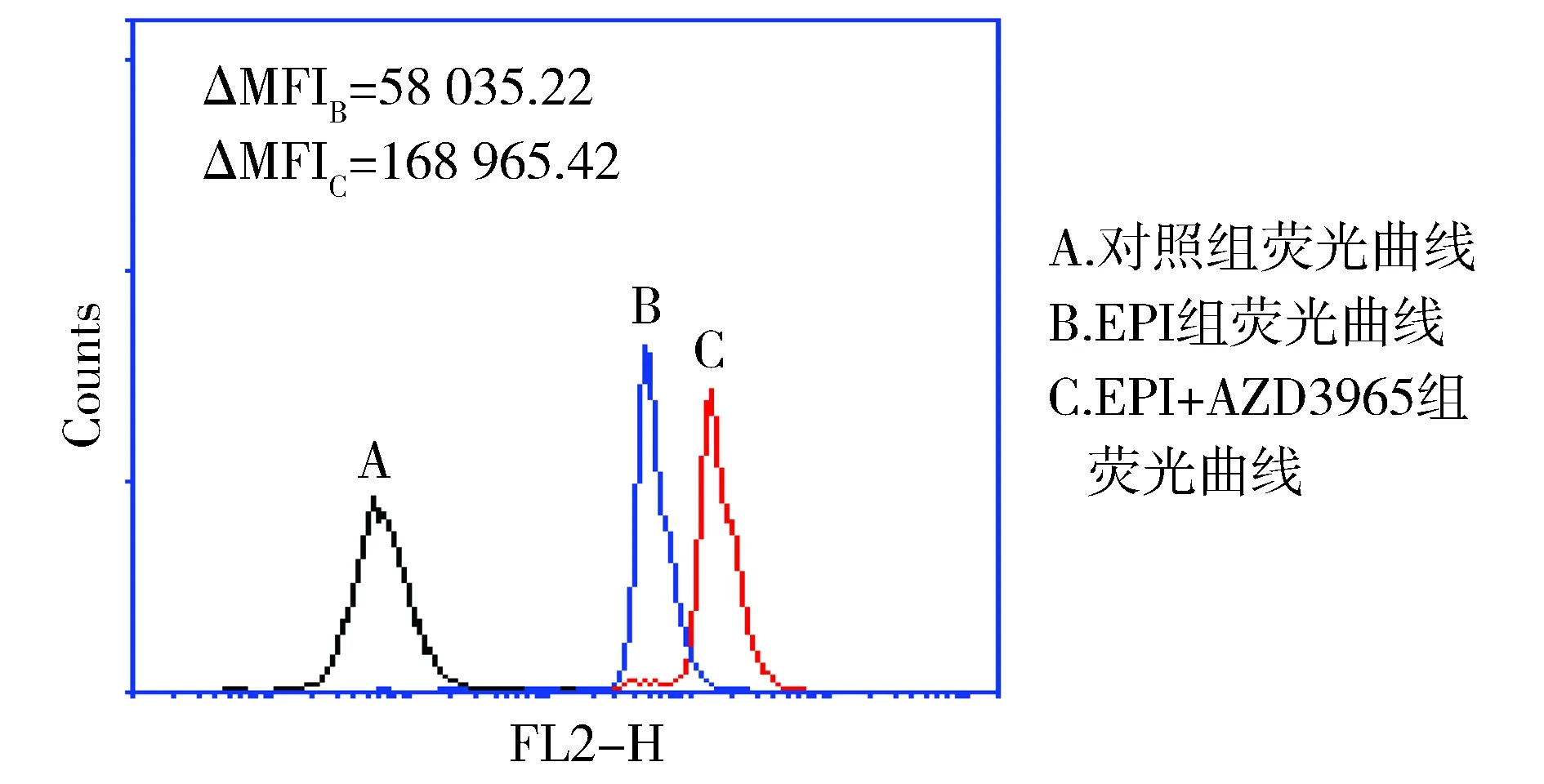
图4 AZD3965增强表柔比星在HepG2细胞内的积累Figure 4 AZD3965 enhanced the accumulation of epirubic in HepG2 cells
3 讨论
恶性肿瘤的治疗是世界性难题,寻找高效低毒的药物治疗方案是一个重要的研究方向。联合用药是提升药物抗癌效果的一种重要途径。
表柔比星(epirubicin,EPI)是蒽环类抗肿瘤药物阿霉素的衍生物,它能快速进入肿瘤细胞,抑制核酸合成和有丝分裂[6],已广泛用于多种肿瘤的防治,如急性白血病和恶性淋巴瘤、乳腺癌、支气管肺癌、卵巢癌、肾母细胞瘤、软组织肉瘤、膀胱癌、睾丸癌、前列腺癌、胃癌、肝癌包括原发性肝细胞癌和转移性癌等。但该药单独使用时,肿瘤细胞容易对其产生耐药性,从而影响了整体治疗效果。
肿瘤细胞耐药性的产生与细胞膜上P-糖蛋白的过表达密切相关[7,8]。P-糖蛋白能够与多种药物结合,由ATP提供能量,将肿瘤细胞内的药物逆浓度转运出细胞外,减少药物在肿瘤细胞内的积累,导致肿瘤细胞对化疗药物不敏感[9,10]。而表柔比星在肝癌细胞内蓄积的减少是肝癌细胞对其产生耐药性的主要原因。因此,通过联合用药的方法提高表柔比星在肝癌细胞内的积累是增强肝癌细胞对表柔比星敏感性的潜在方向。
单羧酸转运蛋白1(MCT1)是广泛分布于哺乳动物细胞膜上的一种跨膜转运蛋白,能将乳酸和H+以1 ∶1等摩尔的方式相偶联同向转运,从而消除糖酵解的终产物乳酸和H+,维持细胞的内稳态环境。由于肿瘤细胞比正常细胞的代谢更为旺盛,故更加依赖于糖酵解提供能量[11,12]。当抑制肿瘤细胞MCT1基因表达后,可导致肿瘤细胞内乳酸含量升高,进而反馈性抑制糖酵解[13]。由于P-糖蛋白在将药物外排过程中依赖ATP提供能量,故MCT1抑制剂可能会通过抑制糖酵解而抑制P-糖蛋白的活性,减少表柔比星从肝癌细胞内的外排。
实验中发现,当表柔比星和MCT1抑制剂AZD3965联合使用时,对肝癌细胞具有更加明显的增殖抑制作用。通过进一步发现AZD3965可使表柔比星在肝癌细胞内的积累量增加。其机制很可能是由于MCT1抑制剂通过抑制糖酵解而抑制P-糖蛋白的活性,减少表柔比星从肝癌细胞内的外排,使药物在细胞内的积累量相对增加,从而逆转了肝癌细胞对表柔比星的耐药性,增强药物的抗肿瘤效果。本研究为肝癌的临床治疗提供了新的治疗方法和思路,也为药物的联合使用提供了实验基础。但本实验仅选用了体外培养的细胞株,进一步的体内外药效还有待深入研究。
