高效液相色谱法测定单氨基四苯基卟啉衍生物的含量
2018-11-09纪海莹庞丽云刘天军
洪 阁,纪海莹,苏 喆,庞丽云,刘天军*
(1中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室,天津 300192;2唐山市妇幼保健院;*通讯作者,E-mail:liutianjun@hotmail.com)
单氨基四苯基卟啉衍生物(mono amino tetraphenylporphyrin derivative,DTP)化学名为((2-{[2-(二羧甲基氨基)-乙基]-羧甲基氨基}-乙基)-{[4-(10,15,20-三苯基卟啉-5-基)-苯基氨甲酰基]-甲基}-氨基)-乙酸,是本实验室用二乙基三胺五乙酸对单氨基四苯基卟啉进行结构修饰得到的光动力抗肿瘤候选新药[1]。药效学研究显示,DTP介导的光动力疗法(photodynamic therapy,PDT)对体外培养的人肝癌细胞HepG2、人胃腺癌细胞BGC-823、人胃癌细胞MGC803和人皮肤黑色素瘤细胞A375的增殖具有明显的抑制作用,而对正常人肝细胞HL-7702的毒性较小,同时对人胃腺癌BGC-823和人皮肤黑色素瘤A375移植瘤裸鼠亦有较好的治疗效果[2,3]。与以往上市的光敏药物相比,DTP具有化学性质稳定、抑瘤谱广、高效低毒等优点,值得作为一种新型的光动力抗肿瘤先导物进行成药性研究。由于DTP的化学结构中存在四个游离的羧基,改变了单氨基四苯基卟啉母核的脂水分布系数和紫外吸收波长,导致无法沿用现有的卟啉类光敏剂检测方法对其进行含量测定[4-6]。因此,急需建立一种适合的含量分析检测方法,为以后的研究提供定量分析的基础。笔者采用高效液相色谱(HPLC)法,建立了以低浓度的三氟乙酸水溶液和乙腈为流动相测定DTP含量的方法,试验证明此方法不仅适用于DTP原料药的鉴别、纯度检测、含量测定和有关物质检查等质量研究项目,而且可以为其药物代谢动力学研究提供必要的技术支持。
1 仪器与试药
1.1 仪器
Alliance高效液相色谱系统,包括e2695型高效液相色谱仪、2998型二极管阵列检测器和Empower 3工作站等(美国沃特世公司);G285型电子分析天平(瑞士梅特勒托利多公司);KQ2200DE型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
DTP对照品(深紫色固体粉末,本实验室自制,经HPLC面积归一化法检测纯度>99%);DTP样品(深紫色固体粉末,本实验室自制,批号:20150422、20150428、20150506);乙腈和N,N-二甲基甲酰胺为色谱纯(天津康科德科技有限公司);水为超纯水;其余试剂均为国产分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Waters Symmetry®C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.2%三氟乙酸水溶液(50 ∶50);检测波长:414 nm;流速:1 ml/min;柱温:30 ℃;进样体积:10 μl。
2.2 溶液的制备
2.2.1 对照品溶液的制备 取DTP对照品5 mg,精密称定,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为对照品储备液。精密量取对照品储备液2.5 ml,置10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,即得。
2.2.2 供试品溶液的制备 取DTP样品约5 mg,精密称定,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,作为供试品储备液。精密量取供试品储备液2.5 ml,置10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,即得。
2.2.3 空白溶液的制备 精密量取N,N-二甲基甲酰胺10 ml,置于10 ml量瓶中,即得。
2.3 方法学考察
2.3.1 系统适用性实验 分别取对照品溶液、供试品溶液和空白溶液,按“2.1”项下的色谱条件进行测定,记录色谱图。结果显示,对照品和供试品色谱按DTP峰计算理论塔板数均不低于5 000,主峰的保留时间一致(约为6.5 min),拖尾因子在0.95-1.05之间,DTP峰与各有关物质峰可以达到基线分离,分离度均大于1.5。空白溶液在DTP峰相应保留时间处无干扰吸收峰,对含量测定没有影响(见图1)。
2.3.2 线性关系考察 精密量取对照品储备液39,78,156,312,625,1 250,2 500,5 000 μl,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀。分别取上述不同浓度的对照品溶液10 μl进样测定,记录色谱图。以峰面积(y)为纵坐标、对照品溶液的浓度(x,μg/ml)为横坐标,进行线性回归,得回归方程:y=16 547.5x+3 189.4,r=0.999 9。

A.对照品溶液 B.供试品溶液 C.空白溶液
结果表明,DTP对照品溶液在1.95-250 μg/ml范围内线性关系良好。
2.3.3 精密度实验 精密量取对照品溶液10 μl,连续重复进样6次,记录色谱图,根据DTP峰面积计算RSD为0.28%(n=6),表明仪器精密度符合要求。
2.3.4 重复性实验 称取同一批号供试品(批号:20150422),按“2.2”项下方法平行制备6份供试品溶液,精密量取10 μl,分别进样测定,根据DTP峰面积计算RSD为0.64%(n=6),表明该方法重复性良好。
2.3.5 稳定性实验 取供试品溶液(批号:20150422)于室温下避光放置0,1,2,4,8,12,24 h,在每个时间点精密量取10 μl,分别进样测定,根据DTP峰面积计算RSD为0.63%(n=6),表明室温避光放置的供试品溶液在24 h内稳定良好。
2.3.6 检测限与定量限检测 取对照品溶液用N,N-二甲基甲酰胺稀释成不同浓度的溶液,精密量取10 μl,分别进样测定。当信噪比约为10 ∶1时,DTP的浓度为0.45 μg/ml,因此确定其定量限为4.5 ng。当信噪比约为3 ∶1时,DTP的浓度为0.15 μg/ml,因此确定其检测限为1.5 ng。
2.3.7 加样回收率实验 精密量取供试品储备液2 ml,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,即得浓度为100 μg/ml的供试品溶液,平行制备9份,分成3组,分别向每组溶液中加入0.8,1,1.2 mg的DTP对照品,超声使其完全溶解,分别进样测定,计算测得量及加样回收率。结果显示,三组供试品的平均加样回收率分别为98.6%,99.1%,98.2%,RSD分别为0.26%,0.32%,0.36%(见表1)。

表1 DTP加样回收率实验结果 (n=9)Table 1 Results of recovery test on DTP (n=9)
2.4 专属性考察
2.4.1 酸破坏实验 精密量取供试品储备液2.5 ml,置于10 ml棕色量瓶中,加1 mol/L盐酸2 ml,室温避光放置2 h,用1 mol/L氢氧化钠溶液调pH至中性,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为酸破坏样品,进样测定,记录色谱图。
2.4.2 碱破坏实验 精密量取供试品储备液2.5 ml,置于10 ml棕色量瓶中,加1 mol/L氢氧化钠溶液2 ml,室温避光放置2 h,用1 mol/L盐酸调pH至中性,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为碱破坏样品,进样测定,记录色谱图。
2.4.3 高温破坏实验 精密量取供试品储备液2.5 ml,80 ℃加热2 h,放至室温,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为高温破坏样品,进样测定,记录色谱图。
2.4.4 氧化破坏实验 精密量取供试品储备液2.5 ml,置于10 ml棕色量瓶中,加入10%过氧化氢溶液2 ml,室温放置2 h,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为氧化破坏样品,进样测定,记录色谱图。
2.4.5 强光破坏实验 精密量取供试品储备液2.5 ml,在4 000 lx光照条件下,室温放置2 h,置于10 ml棕色量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为强光破坏样品,进样测定,记录色谱图。
2.4.6 未破坏实验 精密量取供试品溶液2.5 ml,置于10 ml量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,作为未破坏样品,进样测定,记录色谱图。
结果表明,本品在强酸、强碱、高温、氧化和强光照条件下稳定性较好,与未破坏样品相比并无新的杂质产生。供试品溶液经破坏性实验后,主峰与有关物质、有关物质与有关物质之间分离良好,说明本方法专属性良好(见图2)。
2.5 样品含量测定
取3个批号的DTP样品,分别按“2.2”项下方法制备供试品溶液,分别进样测定,按外标法以DTP峰面积计算样品含量,结果显示,3批样品的含量分别为95.3%,95.8%,96.2%,RSD分别为1.02%,0.84%,0.76%(见表2)。
3 讨论
光动力疗法(photodynamic therapy,PDT)是20世纪70年代末问世的一项针对肿瘤、尖锐湿疣等增生性病变组织的选择性治疗新技术,它利用光敏剂在各组织中的半衰期不同,经过一定时间后可造成病变组织中光敏剂的浓度高于其周围正常组织,在适当波长的光照射下,光敏剂与生物组织中的分子氧反应,生成单线态氧、自由基等活性氧成分,破坏病变组织中的细胞和微血管,造成局部缺血和细胞坏死,从而达到治疗目的[7]。光敏剂、激发光和分子氧是光动力疗法必备的三个基本要素。其中,光敏剂起着至关重要的作用[8]。
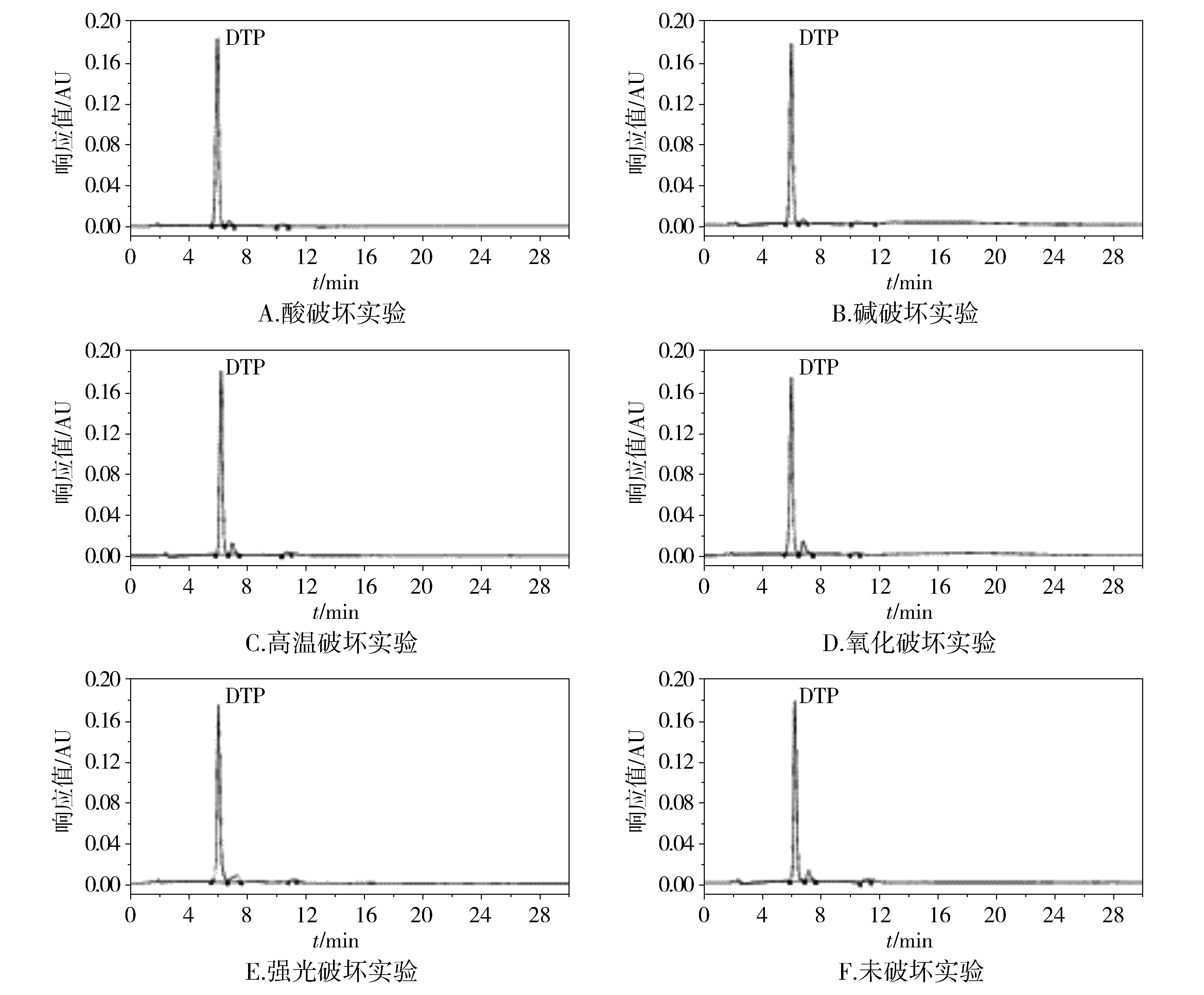
图2 含量测定方法的专属性实验高效液相色谱图Figure 2 HPLC chromatogram of specificity experiment for content determination method

表2 三批DTP样品含量测定结果 (n=3)Table 2 Results of content determination of DTP in three batches of samples (n=3)
DTP是本课题组自行合成的结构新颖、组分单一的单氨基四苯基卟啉衍生物,前期药效学研究显示其光动力抗肿瘤活性强,且对正常细胞毒性低,值得进行深入的抗肿瘤作用机制、安全性评价以及药代动力学研究,因此需要一种适当的检测方法对其进行纯度检查和质量监测。笔者通过查阅文献发现目前用于卟啉类光敏剂含量测定的高效液相色谱方法中流动相主要以甲醇[4,10]或乙腈[11,12]为有机相体系,低浓度的酸水溶液[4,10,11]为水相体系。参照文献报道的方法,我们首先使用相同的水相体系,考察不同比例的甲醇或乙腈分别作为有机相体系时DTP的洗脱效果,结果表明乙腈对DTP的洗脱能力较强,色谱柱几乎无残留样品,而甲醇不能将其完全洗脱,故选择乙腈作为有机相体系。然后,我们尝试分别将低浓度的甲酸、乙酸、磷酸和三氟乙酸水溶液作为水相体系,考察不同强度的酸水溶液对DTP分离效果的影响,结果显示以低浓度的乙酸和磷酸水溶液为水相体系时,色谱峰分叉或重叠现象严重,以低浓度的甲酸水溶液为水相体系时,色谱峰可以有效分离,但拖尾现象严重,提高酸的浓度亦无法有效改善色谱峰的峰形和分离度;而以低浓度的三氟乙酸水溶液为水相体系时,DTP主峰与杂质的分离效果较为理想,且色谱峰的对称性较好。为了减轻强酸水溶液对色谱柱硅胶基质的溶解作用,我们逐渐降低水相体系中三氟乙酸的浓度,发现当三氟乙酸的浓度低于0.2%时会降低流动相对DTP的洗脱能力。因此,最终我们选择乙腈-0.2%三氟乙酸水溶液(50 ∶50)作为检测单氨基四苯基卟啉衍生物含量的流动相。
DTP是单氨基四苯基卟啉的氨基与二乙基三胺五乙酸的一个羧基发生缩合反应,脱去一分子水形成的二元轭连物。由于它的基本结构中含有四个游离的羧基,使整个分子带上了负电荷,故DTP属于阴离子卟啉衍生物。据文献报道[13],卟啉分子与极性基团连接会使其特征吸收峰发生蓝移,我们使用紫外-可见分光光度计对DTP的流动相溶液(0.02 g/L)进行全波长扫描,发现其最大吸收峰蓝移至414 nm,此外还有4个较弱的特征吸收峰分别位于513,548,591,645 nm左右,与文献报道的现象一致。同时,基于DTP紫外最大吸收峰的位置,我们选择414 nm作为其含量测定方法的检测波长。
目前,已经上市或正在进行临床试验的光敏药物大多不含亲水性侧链,以阳离子或中性分子光敏剂居多,通常采用以有机相体系为主的流动相进行含量测定。最近几年,多项研究证实阴离子卟啉光敏剂具有更好的膜通透性,可以通过抑制拓扑异构酶和端粒酶的活性,诱导肿瘤细胞发生凋亡[14,15],具有较大的新药开发潜力,而有关阴离子卟啉光敏剂的HPLC分析方法研究报道相对较少。本文在以往研究报道的基础上,建立了一个新的阴离子卟啉光敏剂的含量测定方法,该法具有简单、快速、分离度好、专属性强的特点,可以满足单氨基四苯基卟啉衍生物定量分析的需要。
