二代测序技术检测房颤伴高度房室传导阻滞患者致病基因分析
2018-11-09马爱群王亭忠
杜 媛,王 娅,韩 秀,韩 克,马爱群,王亭忠
(西安交通大学第一附属医院心血管内科,陕西省分子心脏病学重点实验室,环境与疾病相关教育部重点实验室,西安 710061;*通讯作者,E-mail:tingzhong.wang@xjtu.edu.cn)
心房颤动(atrial fibrillation),简称房颤,是临床上最为常见的心律失常,可引起严重的心血管后果,如血栓栓塞、卒中、心力衰竭及死亡[1]。在普通人群中,房颤的患病率为1%-2%。与房颤有关的危险因素包括老龄、高血压、糖尿病、心肌缺血、心力衰竭以及结构性心脏病(如瓣膜性心脏病)。然而一些房颤患者并无以上易患因素,称之为孤立性房颤(lone atrial fibrillation),这些患者占整个房颤患者的10%-20%[2]。近10余年来,多个研究显示孤立性房颤实际上与遗传组分异常有关。目前已发现40余个与房颤有关的遗传变异体,其中包括心脏缝隙连接蛋白、离子通道及其β亚基[3]。
近期我们对1个房颤伴高度房室传导阻滞的家系应用高通量二代测序技术(next generation sequencing, NGS)结合Sanger测序法进行了分析,发现先证者及其1个女儿均携带KCNQ1基因c.407G>T(p.C136F)杂合突变,该突变为错义突变,导致对应位置氨基酸的替换。该基因突变在人类基因突变数据库(HGMD)数据库中未见报道,但生物信息学分析表明可能具有致病性。
1 研究方法
1.1 临床评估
研究对象为1个汉族家系,共3代17人。本研究获得西安交通大学第一附属医院伦理委员会的批准,所有研究对象均签署了知情同意书。临床资料包括病史采集、体格查体、12导联心电图、动态心电图、经胸心动超声等。对照为100例正常健康志愿者,各项检查均未见异常。
1.2 高通量二代测序检测
捕获芯片包含1 876个与遗传性心血管疾病相关的基因。捕获探针由美国Agilent公司设计,覆盖上述基因的全部外显子区域及相邻内含子区域(50 bp)。从受检者外周血中提取基因组DNA,经片段化、连接接头、扩增纯化后,使用SeqCap EZ MedExome Kit(Roche NimbleGen)杂交捕获人类全部基因的外显子区及相邻内含子区域(50 bp),捕获到的DNA经洗脱和扩增纯化后,使用高通量测序仪(Illumina)进行测序。
1.3 生物信息分析及突变验证
测序数据运用NextGene V2.3.4软件(Soft genetics, USA)与UCSC数据库提供的人类基因组hg19参考序列进行比对,并对目标区域的覆盖度和测序质量进行评估;然后利用人类基因突变数据库HGMD、千人基因组数据库、ESP正常对照人群数据库(NHLBI Exome Sequencing Project)、dbSNP数据库信息对找出来的变异位点进行注释,并用SIFT、PolyPhen2、Mutation-Taster等软件预测单核苷酸改变对蛋白功能的影响,然后进行Sanger测序验证及父母传递分析。
2 结果
2.1 先证者临床表现
房颤伴高度房室传导阻滞患者家系图和临床资料见图1A,表1。先证者(Ⅱ-3)为44岁男性,以“反复头晕、乏力4年余”主诉入我院。症状多于活动后出现,并伴有胸闷,无黑矇、晕厥。曾于外院心电图示房颤伴缓慢心室率,遂转入我院。患者既往体健,无高血压、糖尿病,无烟酒嗜好。入我院后复查心电图为房颤伴高度房室传导阻滞,平均心室率37次/min(见图1B);进一步行动态心电图示全程房颤心律,总心搏58 620次/24 h,最小心率31次/min,大于2 s的停搏有220个,最长RR间期为3 210 ms。心动超声示左室舒缓功能减低,左房前后径33 mm,左室舒张末前后径53 mm,左室射血分数74%。心肌ECT未见明显异常。因患者有活动后胸闷的症状,行冠脉造影示右冠2段40%狭窄,前降支6-7段30%狭窄,排除严重心肌供血不足。余胸片、生化(肝功、肾功、心肌酶等)、甲功、C反应蛋白、风湿、结缔组织全套等检查均未见明显异常。遂植入永久起搏器(VVI模式,美国圣犹达公司)。伤口愈合良好后给予华法林口服抗凝预防心房血栓形成。
2.2 家系临床资料分析
先证者的母亲(Ⅰ-2)于10余年前去世,死亡时49岁,生前患有“心脏病、心律不齐、心动过缓”(家人口述,无具体临床资料)。此次访视有3名家庭成员未到,故未采集到临床客观资料及血标本,但据亲属描述此三人平素体健。余各成员均无任何不适,亦未发现器质性心脏病证据。成员Ⅱ-1的心电图提示左前分支阻滞,Ⅱ-6的心电图提示完全性右束支传导阻滞,余患者心电图未见明显异常。
2.3 基因突变分析
通过二代测序发现先证者携带KCNQ1基因c.407G>T(p.C136F)杂合突变(见图2)。在KCNQ1基因的第2号外显子发现基因组核苷酸序列407位置的碱基G突变为碱基T,从而导致编码的第136位半胱氨酸(Cys)转换为苯丙氨酸(Phe),即p.C136F。Sanger测序验证发现家系中先证者的1个女儿(Ⅲ-4)也携带此突变。该突变在其他家庭成员及100例健康对照中均未检出。氨基酸序列保守性分析结果显示,KCNQ1蛋白136位点所对应的密码子氨基酸在不同物种之间具有保守性(见图2),提示该位点突变后的重要性。
2.4 生物信息学分析
KCNQ1基因c.407G>T导致了蛋白对应位置的氨基酸的替换(p.C136F),这一改变可能会导致蛋白质功能的异常。该突变HGMD数据库中未见报道,为了进一步分析其致病性,分别进行了生物信息学软件分析。如表2所示,PolyPhen-2软件、PROVEAN软件、SIFT软件及MutationTaster软件计算后得分分别为0.994,-9.927,0.00及0.999,提示p.C136F突变可能为有害突变,通过影响蛋白功能而致病。

图1 房颤伴高度房室传导阻滞家系图及先证者心电图Figure 1 Pedigree structure of the family with atrial fibrillation and high degree atrioventricular block

表1 房颤伴高度房室传导阻滞家系成员临床资料Table 1 Clinical information of a family with atrial fibrillation and high degree atrioventricular block
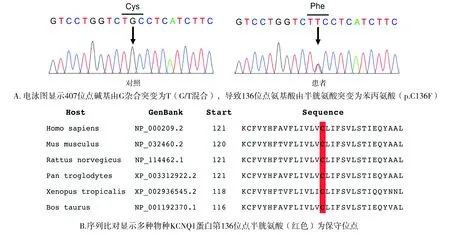
图2 二代测序技术证实患者携带KCNQ1基因c.407G>T(p.C136F)杂合突变Figure 2 The c.407G>T (p.C136F) mutation in KCNQ1 gene was identified in a patient using next generation sequencing

表2 生物信息学软件预测KCNQ1-C136F突变的致病性结果Table 2 The bioinformatics software’s prediction results of KCNQ1-C136F mutation
3 讨论
本研究采用二代基因测序新发现了KCNQ1基因c.407G>T(p.C136F)突变,以常染色体显性的方式进行遗传。生物信息学预测提示该突变具有致病性,很可能是孤立性房颤伴房室传导阻滞的新的致病基因。
KCNQ1基因位于染色体11p15.5,长约404 kb,其mRNA长2 031 bp,包括17个外显子,编码缓慢延迟整流钾通道电流IKs的α亚单位,参与心肌动作电位的3期复极[4]。1型长QT综合征(LQT1)由KCNQ1突变所致,占整个长QT综合征的40%-55%[5],目前已发现200余个KCNQ1突变位点[6]。其他与KCNQ1突变相关的疾病有:家族性心房颤动(ATFB3)[7]、Jervell-Lange-Nielsen综合征(JLNS1)[8]、短QT综合征(SQT2)[9]以及非胰岛素依赖性糖尿病(NIDDM)[10]。
2003年Chen等[7]首次发现1个汉族家族性房颤家系与KCNQ1基因S140G突变有关。此家系中16个携带KCNQ1-S140G突变的房颤患者中,13个同时合并房室传导阻滞。细胞电生理学研究发现,KCNQ1-S140G突变可引起IKs通道的功能获得(gain-of-function),致使通道失去电压依赖性,在整个生理电压下保持持续开放状态,这样通过突变通道的钾电流改变迅速,其表现类似于背景KCNQ1-KCNE2钾电流,最终缩短心房的动作电位时程及有效不应期,在心房易于形成折返,有利于房颤的诱发及维持[7,11]。随后,Yang等[12]采用心肌细胞特异表达人KCNQ1-S140G突变的转基因小鼠模型进一步研究KCNQ1-S140G突变与心律失常的关系。结果发现至少65%的转基因小鼠后代表现出Ⅰ度、Ⅱ度、高度以及完全性房室传导阻滞,而KCNQ1特异性阻滞剂HMR1556可终止该传导阻滞,故研究者认为人KCNQ1-S140G突变与心脏房室传导阻滞有关,其可能的离子电流机制为KCNQ1-S140G突变结合其亚基KCNE1在成年小鼠房室结和束支形成了异常的IKs[12]。在本研究中,先证者临床表现为房颤伴高度房室传导阻滞,这与以上研究中的发现相类似。该先证者携带KCNQ1基因c.407G>T(p.C136F)杂合突变。c.407G>T突变位于KCNQ1基因的第2号外显子,从而导致编码的136位半胱氨酸(Cys)突变为苯丙氨酸(Phe),即p.C136F,该突变同S140G突变一样,位于KCNQ1蛋白的S1跨膜区,在不同物种间高度保守。生物信息学软件分析提示p.C136F突变可能为有害突变,通过影响蛋白功能而致病。但该突变位点具体如何影响KCNQ1蛋白的功能、进而导致心房颤动及房室传导阻滞目前并不清楚,需要进行进一步的细胞生物学及电生理学研究来确认该点突变对心脏的影响。
Tester等[13]报道KCNQ1基因c.407G>T(p.C136F)突变导致LQT1,但在本研究中,所有携带C136F突变的成员其心电图均未表现出明显的QT间期延长。为何位于同一个基因的相同突变却导致了不同疾病的发生尚需进一步研究,可能与修饰基因的交互作用[14]以及环境因素[15]等有关。
本研究中,先证者母亲49岁因心脏疾患死亡,家属称生前患有心律不齐、心动过缓,推测极有可能为房颤伴房室传导阻滞,考虑先证者母亲为KCNQ1基因c.407G>T(p.C136F)突变的携带者。先证者的女儿也携带c.407G>T(p.C136F)突变,但临床上并无房颤及房室传导阻滞的表现。基因型-表型的关系非常复杂,并非所有携带同样突变基因的患者都有同样的表型。很多因素决定着基因的外显率和表现度,其中包括年龄与性别的差异、遗传调节因子以及背景修饰基因等[16,17]。先证者女儿目前无临床表现也可能与其年龄尚小(现年仅8岁)有关,日后需要进行严密随访,因此详细的临床评估及基因检测有助于识别那些无表型表达的突变携带者,对其加以重视并加强临床管理。
综上,本研究在1个房颤伴房室传导阻滞的家系中发现KCNQ1基因c.407G>T(p.C136F)杂合突变,其所在区域在物种进化上高度保守。生物信息学软件预测该突变通过影响蛋白功能而致病,故该突变位点可能是孤立性房颤伴房室传导阻滞的新的致病基因。
