索拉菲尼治疗进展期原发性肝癌患者有效性及安全性研究*
2018-11-09汪华赵亚宁
汪华,赵亚宁
原发性肝癌(primary liver cancer,PLC)患者早期无明显症状,一经诊断即已进入进展期肝癌(advanced PLC,aPLC)或中晚期,失去了手术治疗的机会,预后极差。射频消融术(radiofrequency ablation,RFA)是失去手术治疗机会的aPLC患者有效的治疗方法,但aPLC转移发生率高,治疗后复发多,5 a生存率在30%%以下[1,2]。索拉菲尼是一种新型的口服小分子靶向药物,我国于2013年3月批准其用于PLC的治疗,其对aPLC患者的治疗疗效已被至少两项全球多中心、随机、双盲临床试验证实[3]。但也有越来越多的研究报道,大剂量应用索拉菲尼可引发严重的不良反应,需要减量治疗或停药[4]。本研究观察了在RFA治疗后应用索拉菲尼治疗的41例aPLC患者的疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料 2013年4月~2016年12月在我院诊治的aPLC患者82例,男性64例,女性18例;年龄32~65岁,平均年龄为(52.6±7.6)岁。符合《原发性肝癌诊疗规范(2017年版)》的诊断标准[5],Child-Pugh A级42例,B级40例;病灶位于左肝39例,右肝43例;病灶直径≤3 cm 52例,>3 cm 30例。纳入标准:东部肿瘤协作组体能状态评分0~2分、预计生存期超过12周。排除标准:①合并严重的心、肾、脑或其他严重的器质性疾病;②对本研究所使用的药物存在过敏或禁忌证者;③转移性肝癌;④Child-Pugh分级C级。剔除标准:①未按医嘱完成治疗者或未完成治疗在3月内即死亡者;②失去随访者。将82例患者按入院顺序编号,采用电脑产生的随机数字法随机分为两组,每组41例,两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经我院医学伦理委员会批准通过,患者签署知情同意书。
1.2 治疗方法 使用美国Covidien公司生产的CTRF220型射频治疗仪,对所有患者实施RFA。根据病灶位置,取平卧位或左侧卧位,经多层螺旋CT扫描定位,确定肿瘤位置,选择穿刺点和进针方向。常规消毒,采用2%利多卡因局部浸润麻醉,采用三孔法,将射频消融电极针经皮下穿刺插入瘤灶内1~1.5 cm,消融范围超过病灶边缘1~2 cm,每次消融时间为12~15 min。每月行CT扫描复查,了解消融情况;在观察组,于RFA治疗前2周给予索拉菲尼(德国拜耳医药保健股份公司,国药准字H20090846)400 mg口服,2次/d。采用美国国家癌症研究所常见毒性反应标准(the national cancer institute-common toxicity criteria,NCI-CTC)[6]评价不良反应。对未出现不良反应者,维持剂量至RFA治疗前1~2 d;对出现不良反应者,则将药物剂量减半;对出现3/4级不良反应者,则停药。在停药1~2 d后实施RFA治疗。在RFA治疗3~7 d后,继续给予索拉菲尼400 mg口服,1次/d。对无明显不良反应者,在7 d后改为2次/d;对出现3/4级不良反应者,则暂停用药,待不良反应降至2级或以下后恢复400 mg口服,1次/d,持续治疗12 w。
1.3 检测、检查与疗效评价 采用ELISA法检测血清碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、 血 管 内 皮 生 长 因 子(vascular endothelial growth factor,VEGF,美国 BioRad 公司,检测设备为美国BioRad公司生产的BioRad450酶标仪)。常规行腹部B超、MRI或CT检查。在治疗12 w后,参考欧洲癌症杂志发布的新版实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[7],评价实体瘤控制情况,客观有效率=(完全缓解+部分缓解)/n×100.0%,疾病控制率=(完全缓解+部分缓解+稳定)n×100.0%。随访12个月。
1.4 统计学方法 应用SPSS 20.0软件包对数据行统计学分析,计量资料以(±s)表示,采用t检验,计数资料采用x2检验,采用Kaplan-Meier法计算无进展生存期(progression-free survival,PFS),并行Log-rank检验,比较两组差异。P<0.05为差异有统计学意义。
2 结果
2.1 入组患者剔除情况 2例观察组患者因未按医嘱完成治疗而被剔除,3例对照组患者失访,其余病例均完成治疗和随访。
2.2 实体瘤控制情况 在治疗12 w末,两组疾病控制率比较,差异无统计学意义(P>0.05),但观察组客观有效率显著高于对照组,差异有统计学意义(P<0.05,表 1)。
2.3 两组血清AFP和细胞因子水平比较 见表2。
2.4 两组肝功能指标变化的比较 见表3。
2.5 两组PFS比较 随访12个月,观察组中位无进展生存期(PFS)为10.2个月(95%CI为7.4~11.5),对照组为7.9个月(95%CI为 6.0~10.1),经Log-rank检验显示两组差异有统计学意义(P<0.05,图1)。

表1 两组实体瘤控制情况[n(%)]比较
表2 两组血清AFP和细胞因子水平(±s)比较

表2 两组血清AFP和细胞因子水平(±s)比较
与对照组比,①P<0.05
例数 AFP(μg/L) bFGF(pg/mL) VEGF(pg/mL)观察组 治疗前 41 464.4±15.3 8.7±2.1 264.5±32.5治疗后 39 184.7±10.5① 3.8±1.3① 172.3±25.4①对照组 治疗前 41 465.8±15.9 8.9±2.4 262.5±35.6治疗后 38 213.6±11.6 6.4±2.0 210.5±28.3
表3 两组肝功能指标水平(±s)比较

表3 两组肝功能指标水平(±s)比较
例数 TBIL(μmol/L) Alb(g/L)观察组 治疗前 41 16.9±2.2 43.3±3.8治疗后 39 22.0±3.1 34.5±3.9对照组 治疗前 41 16.4±2.5 43.1±3.6治疗后 38 23.5±3.6 35.5±4.1 AST(U/L)48.8±5.3 49.6±8.2 49.3±5.9 54.3±6.3 ALT(U/L)34.1±5.2 47.4±8.0 35.6±5.6 53.7±6.2

图1 两组Kaplan-Meier PFS曲线
2.6 两组不良反应发生情况 在治疗过程中,两组腹胀、疲劳和发热发生率比较差异无统计学意义(P>0.05),但观察组手足综合征、皮疹、白细胞减少、口腔黏膜炎、脱发和肝功能异常发生率显著多于对照组,差异有统计学意义(P<0.05,表 4),观察组个别患者在服药过程中出现一过性血清AST和ALT水平轻度升高,经对症处理后恢复。
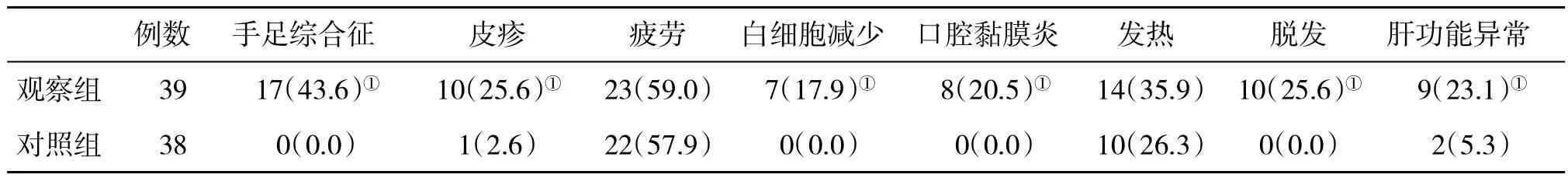
表4 两组不良反应发生率[n(%)]比较
3 讨论
控制癌细胞扩散及延长生存期是aPLC治疗的主要目的。研究发现,索拉菲尼可影响癌细胞的扩散而控制病灶转移及复发[8-11]。在大鼠肝癌模型用药也提示,与单独RFA或经导管肝动脉栓塞术处理相比,联合使用索拉菲尼可抑制肿瘤转移及复发。对于PLC患者加用索拉菲尼治疗后,患者实体瘤治疗后客观有效率为52.1%,显著高于对照组的33.3%[12-15]。本研究治疗后两组疾病控制率比较差异无统计学意义(P>0.05),但观察组肿瘤客观有效率显著高于对照组(P<0.05)。此外,在12个月的随访期内,观察组中位无进展生存期为10.2个月,显著长于对照组的 7.9 个月(P<0.05),与有关报道[16,17]相符,进一步说明在RFA治疗后给予索拉菲尼巩固治疗较单纯RFA治疗对实体瘤的控制效果更好,可有效延长患者无进展生存期。
索拉菲尼治疗PLC患者的疗效被临床多项研究所证实,但近年来也发现索拉菲尼可引发的不良反应,这方面的报道越来越多,严重的可发生肝衰竭等致死性不良反应[18]。索拉菲尼治疗PLC患者腹泻发生率为34%,皮疹发生率为35%、手足综合征发生率为27%,口腔黏膜炎发生率为19%[19]。索拉菲尼治疗PLC患者高血压发生率为42%[20]。本研究治疗后两组腹胀、疲劳、白细胞减少和发热发生率比较差异无统计学意义(P>0.05),但观察组手足皮肤综合征、皮疹、白细胞减少、口腔黏膜炎、脱发和肝功能异常发生率显著多于对照组(P<0.05)。此外,观察组在用药后部分患者血清AST和ALT一过性升高,存在一定的肝功能损伤的可能,但除了手足皮肤综合征外,其他不良反应均较轻微,减量用药及对症处理后均好转。
