虾青素对肝纤维化大鼠的保护作用及机制研究*
2018-11-09刘恩强陈果廖修用许美凤魏贵玉罗小平
刘恩强,陈果,廖修用,许美凤,魏贵玉,罗小平
肝纤维化的病理机制为肝组织胶原蛋白等细胞外基质的合成与降解失衡,导致胶原纤维沉积[1,2]。肝纤维化为肝硬化的必经阶段,并可能发展为肝癌[3,4]。大量研究表明,肝星状细胞的活化为肝纤维化的关键步骤,转化生长因子(TGF)-β1/Smad通路和ERK通路对肝星状细胞活化具有调节作用[5,6]。本课题组前期研究证明,虾青素对大鼠肝纤维化过程具有抑制作用,但其抑制机制并未明确。本研究探讨了虾青素是否通过调节TGF-β1/Smad通路或ERK通路抑制了肝纤维化的发生。
1 材料与方法
1.1 动物、试剂与仪器 雄性SD大鼠,体质量180~220 g,购自河北医科大学实验动物中心。动物喂养及处理均符合《关于善待实验动物的指导性意见》和《实验动物伦理学》的相关规定。本实验经我院动物医学伦理委员会批准。虾青素(astaxanthin,阿拉丁)和秋水仙碱(吉林紫鑫药业股份有限公司,批号 110809);四氯化碳(CCl4,淄博畅荣化工,批号120708);兔抗鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)、抗Ⅰ型胶原(collagenⅠ)、抗Smad2单克隆抗体(美国,Abcam 公司,批号为 ab224492、ab80424、Q16795 和G3507);苏木精-伊红(HE)染色液(北京索莱宝);10%甲醛固定液(上海歌凡);逆转录试剂盒(美国Thermo公司)。低温高速离心机(美国Thermo公司);光学显微镜(日本 OLYMPUS公司);Line Gene9600实时荧光定量PCR仪(北京中科盟科技有限公司);DYCZ-40K电泳仪、DYCZ-40G电泳槽和DYCZ转模仪(北京六一仪器厂)。
1.2 模型制备[7]将SD大鼠随机分为正常组、模型组、秋水仙碱组(0.1 mg·kg-1)、虾青素Ⅰ组(2 mg·kg-1)和虾青素Ⅱ组(4 mg·kg-1),每组 10 只。除正常组外,其余各组经大鼠背部皮下注射50%CCl4(1.0 ml·kg-1),每周 2次,持续 10 w。给予正常组同等剂量的花生油,在造模后第6 w,分别给予各组大鼠相应药物灌胃,1次/d,共6 w。在最后一次灌胃后,禁食12 h,处死动物。取肝组织,置于10%甲醛溶液中固定后切片,行HE和马松(Masson)染色,光镜下观察肝组织损伤和胶原纤维增生程度。采用Metavir分级法评价肝纤维化分期(S1~S4)[8]。
1.3 大鼠肝组织 CollagenⅠ、Smad2、TGF-β1 和p-ERK蛋白表达检测 采用Western blot法,取适量大鼠肝组织,加Trizol裂解液和PMSE(100:1)裂解肝组织35 min,4℃ 4000 r/m离心20 min。取上清液,置于-20℃冰箱保存。采用BCA蛋白试剂盒测定蛋白浓度。使用Image J软件测定条带IOD值。
1.4 大鼠肝组织 CollagenⅠ、Smad2、TGF-β1 和p-ERK mRNA检测 采用RT-PCR法,用液氮研磨肝脏组织,加入Trizol溶液提取总RNA。经核酸蛋白仪和琼脂糖电泳对提取的RNA进行分析。取总RNA 4 μL,82℃水浴5 min,加入反转录反应液,44℃孵育60 min,留取产物待测。扩增参数,95℃10 min,60℃50 s,72℃延伸 50 s,72℃最终延伸 10 min,10℃最终保存。基因水平分析采用2-△Ct法测定相对含量,将β-actin设为内参,取Ct值。计算公式为△Ct=Ct(目的基因)-Ct(β-actin)。引物序列见表1。
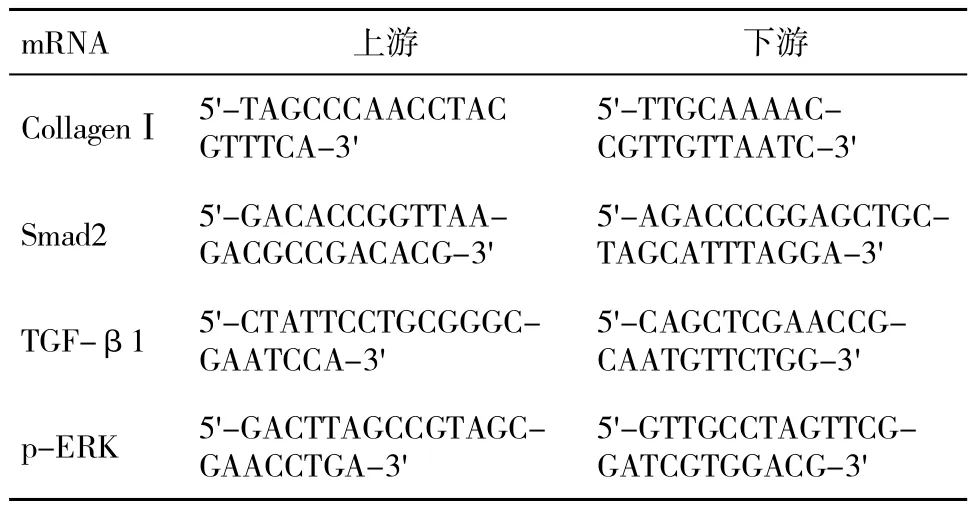
表1 引物序列
1.5 统计学分析 应用SPSS 19.0统计学软件处理,对服从正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间比价采用LSD-t检验。等级资料的比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝纤维化分期比较 与模型组比,应用虾青素干预后,肝纤维化S3期减少,S2期增多(表2),但两种剂量的虾青素干预组无显著性相差(P>0.05)。
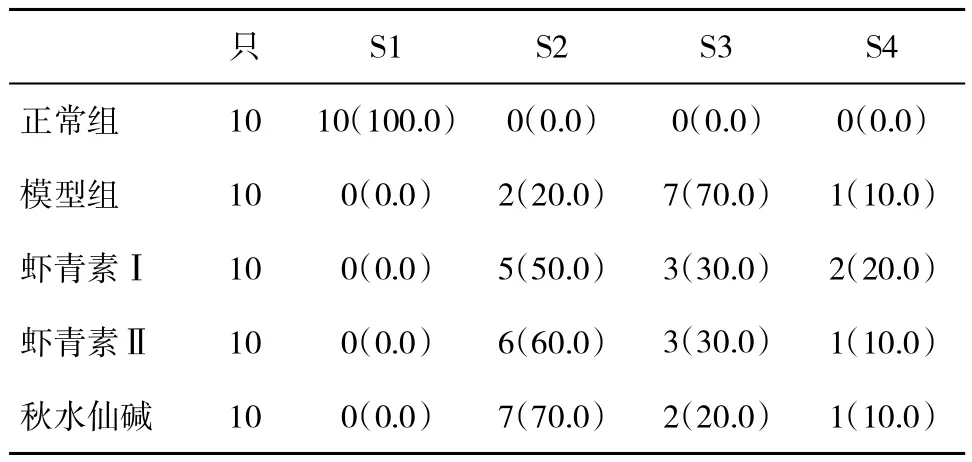
表2 各组大鼠肝纤维化分期(%)比较
2.2 各组大鼠肝组织形态学变化 在光学显微镜下观察可见,正常组大鼠肝组织无明显异常,其结构完整,细胞膜清晰,核仁明显且细胞质丰富,无胶原纤维增生沉积;模型组大鼠肝组织出现大面积脂肪变性,多数细胞核消失,纤维增生明显;与模型组比,虾青素Ⅰ组和虾青素Ⅱ组大鼠肝组织损伤表现呈好转趋势,大剂量虾青素处理组表现更明显(图1)。Masson染色观察,有少量细小的蓝色胶原纤维出现在正常大鼠肝组织汇管区周围,未见纤维增生,而在模型组大鼠,见肝组织大量胶原纤维增生,形成粗大的纤维间隔,将肝小叶分隔成大小不等的假小叶;给予虾青素和秋水仙碱干预后,肝组织胶原纤维增生明显减少(图2)。
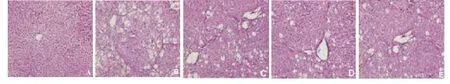
图1 各组大鼠肝组织病理学表现(HE,200×)

图2 各组大鼠肝组织病理学表现(Masson,200×)
表3 各组大鼠肝组织蛋白表达(±s)比较

表3 各组大鼠肝组织蛋白表达(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只 CollagenⅠ TGF-β1 Smad2 p-ERK正常组 10 0.4±0.1 0.5±0.1 0.5±0.1 0.4±0.1模型组 10 1.7±0.4① 1.7±0.4① 1.6±0.3① 1.6±0.5①虾青素Ⅰ组 10 1.4±0.3①② 1.4±0.4①② 1.3±0.4①② 1.2±0.4①②虾青素Ⅱ组 10 1.2±0.3①② 1.2±0.3①② 0.8±0.4①② 0.9±0.3①②秋水仙碱组 10 0.4±0.1② 0.6±0.1② 0.5±0.1② 0.5±0.1②
2.3 各组大鼠肝组织CollagenⅠ、Smad2、TGF-β1和p-ERK蛋白表达的变化 与正常组比较,模型组肝组织CollagenⅠ、Smad2、TGF-β1和p-ERK蛋白表达水平显著升高(P<0.05);与模型组比,虾青素Ⅰ组、虾青素Ⅱ组和秋水仙碱组大鼠肝组织四种蛋白表达水平明显下降(P<0.05,表 3、图 3~6)。
2.4 各组大鼠肝组织CollagenⅠ、Smad2、TGF-β1和p-ERK mRNA水平变化 与正常组比,模型组大鼠肝组织CollagenⅠ、Smad2、TGF-β1和p-ERK mRNA水平显著升高,差异有统计学意义(P<0.05);与模型组比,虾青素Ⅰ组、虾青素Ⅱ组大鼠肝组织CollagenⅠ、Smad2、TGF-β1和 p-ERK mRNA 水平显著降低(P<0.05),且随着剂量的增加,下降更明显(P<0.05,表 4、图 7)。

图3 各组大鼠肝组织CollagenⅠ蛋白表达的变化(免疫组化,200×)

图4 各组大鼠肝组织Smad2蛋白表达的变化(免疫组化,200×)

图5 各组大鼠肝组织TGF-β1蛋白表达的变化(免疫组化,200×)

图6 各组大鼠肝组织p-ERK蛋白表达的变化(免疫组化,200×)
表4 四组大鼠肝组织蛋白基因(m RNA)水平(±s)比较

表4 四组大鼠肝组织蛋白基因(m RNA)水平(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只 CollagenⅠ TGF-β1 Smad2 p-ERK正常组 10 1.0±0.1 1.0±0.1 1.0±0.1 1.1±0.1模型组 10 2.4±0.4① 2.5±0.5① 2.5±0.6① 2.6±0.5①虾青素Ⅰ组 10 2.0±0.4①② 2.1±0.4①② 2.0±0.5①② 2.1±0.4①②虾青素Ⅱ组 10 1.8±0.5①② 1.6±0.3①② 1.8±0.4①② 1.8±0.3①②秋水仙碱组 10 1.1±0.1② 1.2±0.1② 1.1±0.1② 1.1±0.1②

图7 各组大鼠肝组织蛋白基因(mRNA)水平变化
3 讨论
本研究通过注射四氯化碳制备肝纤维化大鼠模型,观察了虾青素干预对大鼠肝纤维化的影响,实验发现,不同剂量的虾青素干预大鼠6周后,肝组织胶原纤维增生程度降低,大鼠肝纤维化程度明显减轻,提示虾青素对肝纤维化进程具有抑制作用。
已有研究指出,肝纤维化形成的中心环节是肝星状细胞的活化[9-11]。ERK通路与肝星状细胞的功能关系密切,参与了肝纤维化进程的调节。在四氯化碳所致的肝纤维化大鼠,肝组织ERK基因表达明显增强[12,13]。应用MEK抑制剂处理大鼠后,ERK活性降低,且肝星状细胞的增殖也受到明显的抑制[14]。本实验发现,虾青素处理组大鼠肝组织p-ERK蛋白及其mRNA水平均呈下降趋势,并随着虾青素剂量的加大变得明显,提示虾青素对肝纤维化大鼠的保护作用可能与抑制ERK通路有关。
在肝星状细胞活化后,合成细胞外基质增多,Ⅰ型胶原等细胞外基质成分沉积增多[15,16]。TGF-β1/Smad信号通路在肝星状细胞活化过程具有重要作用。TGF-β1具有诱导细胞分化、促进肝星状细胞活化及细胞外基质合成分泌作用,Smad蛋白为TGF-β的受体后蛋白,在肝纤维化信号通路中起到信号转导作用[17,18]。TGF-β1/Smad 信号通路在致病因子的刺激下,表达增多,引起肝纤维化的形成。动物实验表明,Smad基因片段的缺失可对肝纤维化起到抑制作用[19]。本研究结果显示,虾青素能够显著下调Smad、Ⅰ型胶原和TGF-β1表达,减轻肝损伤,延缓肝纤维化进程。
