HCV感染相关干扰素L4真核表达载体的构建与表达
2018-11-09党引利
徐 溪,党引利,吴 朔
我国人群HCV感染率约为0.43%,有约1300万感染者。研究发现,HCV感染与患者自身的基因多态性(genetic polymorphisms)有关,而患者基因组特殊单核苷酸多态性(single nucleotide polymorphisms,SNP)的状况是影响预后的重要因素。前期研究发现,白细胞介素28B(IL-28B)基因多态性与慢性丙型肝炎(chronic Hepatitis C,CHC)患者持续病毒学应答率(sustained virological response,SVR)密切相关,宿主IL-28B基因rs12979860位点为CC纯合子表型的个体较CT和TT表型的个体有更高的自发 HCV 清除率[1,2]。2014 年,Prokunina-Olsson研究组在IL-28B基因区附近发现了一个新的SNP位点,此位点的SNP多态性可产生一个被称为干扰素 λ4(interferon-lambda 4,IFN-λ4或 IFNL4)的新基因[3,4]。这个SNP位点位于IFNL3和IFNL2之间,即ss469415590,具有ΔG/TT双核苷酸序列多态性。如果该位点为ΔG,则该区域可因此产生一个新的开放阅读框,而这个位点如果是TT,则这个开放阅读框将被提前终止。这个被创造或者提前终止的基因就是IFNL4。既往研究没有早期发现IFNL4的主要原因是通常它在细胞中的表达丰度较低,仅在特定类型细胞受到特殊刺激条件下才会转录和翻译,例如,正常肝细胞并不表达IFNL4,而当其受到HCV感染刺激后才产生一定水平的IFNL4。
本课题组从含人IFNL4基因序列的质粒pFC14A-p179中克隆了IFNL4基因片段,并构建了携带His标签的真核表达载体,为进一步研究IFNL4的功能并解释其与HCV感染的关系提供了依据。
1 资料与方法
1.1 细胞、菌株、质粒与试剂 293T细胞购自中科院上海细胞库;E.Coli DH5a由本实验室保存;真核表达载体pcDNA3.1-His购自Invitrogen公司;含人IFNL4基因序列质粒pFC14A-p179由美国癌症研究 所 (National Cancer Institute,NCI) 的 Ludmila Prokunina-Olsson博士馈赠。DMEM培养基购自GIBCO公司;胎牛血清购自杭州四季青工程材料有限公司;PrimerSTAR Max DNA聚合酶、T4DNA连接酶、限制性内切酶、DNA Marker、DNA电泳凝胶回收试剂盒、小量质粒提取试剂盒均购于大连TaKaRa公司;LipofectamineTM 2000购自Invitrogen公司;DNA中提试剂盒购自QIAGEN公司;抗鼠His-Tag单克隆抗体购自北京康为世纪生物公司。
1.2 pcDNA3.1-IFNL4-His重组真核表达载体的构建与鉴定 根据IFNL4基因序列,利用Oligo6.0软件分析设计了一对引物,其序列如下:上游引物为F1:5'-TAGCCGTCTAGAATGCGGCCGAGTGTCTGG GCC-3'(XhoI),下游引物为 R1:5'-AGCCTCGAG GAGGCAAGGCCCAGAGTGTGCAG-3'(XbaI),由上海桑尼生物科技有限公司合成。以质粒pFC14A-p179为模板,PCR条件为:98℃ 10 s,55℃ 15 s,72℃ 5 s,共35个循环。反应产物经
1.5 %琼脂糖凝胶电泳进行鉴定。分别用XhoI和XbaI双酶切PCR产物和表达载体,用DNA电泳凝胶回收试剂盒回收目的酶切产物,用T4 DNA连接酶在14℃连接16 h后转化。挑选Amp抗性克隆,摇菌后通过对菌液PCR初步鉴定出阳性克隆,小提质粒后用XhoI和XbaI双酶切验证出阳性克隆,送上海桑尼生物科技有限公司进行测序。将构建好的载体扩大培养后,用DNA中提试剂盒提取质粒,用紫外分光光度计测定其浓度。取对数生长期的293-T细胞,消化处理后接种于6孔板,每孔1×106个细胞,待细胞生长至90%融合时转染。首先,将载体与转染试剂按照1:3混合,在Opti-MEM培养基中,室温孵育20 min,同时将细胞用不含双抗和血清的DMEM培养基清洗3次,之后将DNALipofectamineTM2000复合物逐滴加入各孔。37℃,5%CO2温箱培养4 h,弃去复合物,PBS清洗细胞2次,换含10%FBS DMEM培养基,培养72 h,离心,收集细胞,设转染组和空白细胞组。加入RIPA细胞裂解液,提取蛋白,采用Bradford法进行蛋白定量。取等量的蛋白上样,用抗鼠His-Tag单克隆抗体进行Western-blot检测,鉴定IFNL4-His融合蛋白的表达。
2 结果
2.1 IFNL4目的基因的扩增 以pFC14A-p179质粒为模板进行PCR反应,模板量分别为100 ng和50 ng,扩增产物经琼脂糖凝胶电泳后,在540 bp左右的位置处均可见一明亮的条带,其大小与目的基因相符(图1)。
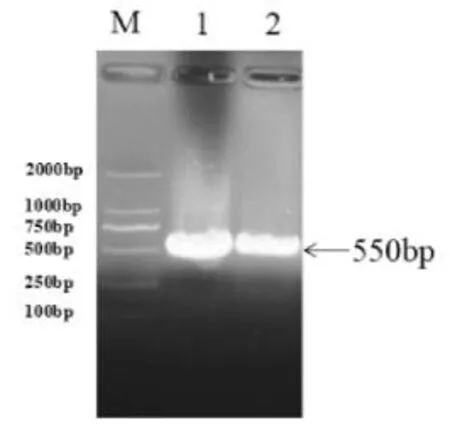
图1 IFNL4基因的PCR全长扩张
2.2 重组真核表达载体的酶切鉴定 因IFNL4基因片段约为540 bp,载体骨架约为5500 bp。分别用XhoI和XbaI双酶切阳性克隆后,经1.5%琼脂糖凝胶电泳,结果发现片段大小均与预期一致。测序结果显示目的基因序列正确,成功构建重组表达载体(图 2)。
2.3 IFNL4-His融合蛋白表达鉴定 将细胞裂解后提取蛋白,经Western blot检测重组质粒转染后细胞蛋白的表达情况,结果显示IFNL4-His融合蛋白在20 kD处出现单一目标条带,与推测的分子量大小相符,内参GAPDH在36 kD处出现单一目标条带(图 3)。
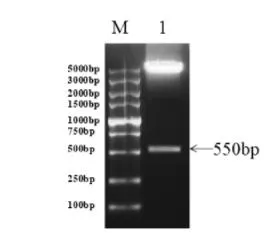
图2 构建重组真核表达载体插入片段的酶切鉴定

图3 IFNL4-His融合蛋白表达情况的western blot检测
3 讨论
在人类基因组中,一共有三个干扰素相关的基因区域,即 IFNL1、IFNL2和 IFNL3(IL29、IL28A、IL28B),它们的表达可通过JAK-STAT信号通路和干扰素刺激基因ISGs的调控抑制病毒的复制[3,5]。研究通过polyI:C刺激细胞后对细胞mRNA文库测序发现,除IFNL1、IFNL2和IFNL3外,在某些人群中还存在一个约150 kb的表达序列。应用5’RACE技术克隆出全长基因后发现,这个区域存在着一个SNP位点,即ss469415590(TT>ΔG)。这一位点定位在IFNL3上游3 kb的地方[6-9]。转录谱分析结果显示,这一区域存在10个不同长度的转录产物,其中最有意义的是p179蛋白,其与IFNL3有约40.8%的相似性,这个蛋白即之后被称为IFN-λ4或IFNL4的新基因[6]。蛋白结构分析显示,虽然IFNL4没有三型干扰素与IL10R2相互作用的D螺旋结构域,但其与IFNL3相似,都存在A和F螺旋结构域,而这是三型干扰素的核心部分[10-14]。
IFNL4的ss469415590位点多态性与IFN-α联合利巴韦林治疗慢性丙型肝炎患者疗效间存在负相关性[15-18],这种现象提示IFNL4在机体抗病毒免疫过程中发挥重要作用。进一步研究证实,IFNL4可通过诱导细胞STAT1和STAT2信号分子的磷酸化,激活下游的信号通路,对细胞骨架具有重要影响。研究认为,这种结构变化可能影响到细胞对HCV的敏感性及炎症应答方式。IFNL4可被PolyI:C刺激诱导产生,并进而激活多种干扰素诱导基因(ISGs)的表达[5,6],例如,干扰素刺激应答元件(interferon-stimulated response element,ISRE) 可 应 答IFNL4 刺激,调控包括 STAT1、ISG15、IFIHI1-MDA5、OAS1、MX1和DHX58-RIG-I等ISGs的表达,从而影响细胞代谢及抗病毒应答的不同方式[5,7]。
在IFNL4发现之前,一直很难解释为什么IL28B基因多态性位点rs12979860与HCV清除相关,因为这个位点并不引起编码蛋白质的改变[8]。尽管rs12979860可能通过影响基因调控,从而产生干扰素表达差异,但IFNL4的发现为这种免疫应答差异提供了一种更直接的解释。由于IFNL4位点ss469415590和IL28B的rs12979860紧密连锁,因此rs12979860不同基因型产生的免疫应答变化很可能在一定程度上只是ss469415590多态性变化的反映,细胞是否产生IFNL4可能是影响治疗丙型肝炎效果的直接原因。例如,不同ss469415590基因型(ΔG/TT)可决定细胞是否能够产生IFNL4,进而通过改变ISG表达变化,形成免疫应答的差异[6]。
值得注意的是,ss469415590位点的ΔG/TT在亚洲人中等位基因不平衡,在多数个体中该位点为TT型,尤其是在中国人中,几乎全部的个体均携带TT型的ss469415590。因此,多数亚洲人机体不能产生有功能的IFNL4蛋白。而在欧洲和非洲裔人种,TT和ΔG均在基因组中存在,TT为优势基因型,两种变体之间的ΔG约占总基因数的三分之一。因此,IFNL4可用来预测欧洲和非洲裔人种HCV感染的治疗效果。而对于亚洲人种而言,这种预测却是不可行的。但有趣的是,亚洲人接受pegIFN-α/RBV治疗后的疗效较欧洲和非洲裔人种更好,约90%亚裔患者在接受pegIFN-α/RBV治疗均可获得SVR,远高于欧洲和非洲裔人种的40%,这种现象在一定程度上也印证了IFNL4表达与治疗丙型肝炎疗效呈负相关的结论[5]。
IFNL4作为一种独特的干扰素分子,可能通过其对细胞的特异性信号激活通路对机体和免疫应答产生重要的影响,对其表达、纯化及功能研究可能对免疫治疗和新药开发具有重要意义[14]。另外,虽然该基因对肝实质细胞的影响已得到了充分研究[19,20],但其对免疫细胞功能的影响依然不清楚。本课题通过对人IFNL4基因的扩增、载体构建和真核表达,初步建立了IFNL4的表达体系,为后续研究IFNL4的功能和潜在的药用价值提供了实验基础。
