LATS2基因通过Wnt信号通路对H9C2心肌细胞保护的作用机制研究
2018-11-07聂明金培印
聂明,金培印
心肌缺血再灌注损伤(I/R)是一种在临床上常见的病理生理现象,常引起慢性心功能不全、心肌梗死体积增大、心律失常等情况,严重危害人类的生命健康[1]。缺氧复氧(H/R)是在细胞水平上模拟I/R损伤成熟的模型,H/R的体外模型目前在细胞分子机制研究中广泛应用[2]。大肿瘤抑制因子2(LATS2)是一种丝氨酸或酪氨酸激酶,是LATS家族中的一员,定位于13p11-q12,是P53下游的一个基因,可激活p53的活性,与多种肿瘤发生发展有关,也可通过调控心肌细胞的生长及凋亡影响心室大小,是心肌细胞一个负性调控因子[3,4]。研究显示,LATS2的表达可随大鼠心肌肥大变化降低,miR-31可通过调控LATS2影响心肌细胞的肥大[5]。目前LATS2对H/R诱导的心肌细胞的影响还未清楚,因此,本研究通过抑制或过表达LATS2后检测LATS2对H/R诱导的心肌细胞凋亡的影响,并研究可能的分子机制。
1 材料与方法
1.1 主要试剂和仪器DMEM培养基购自美国Hyclone公司;胎牛血清、LipofectamineTM2000、青链霉素均购自美国Invitrogen公司;胰蛋白酶购自美国Gibco;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒及流式细胞仪均购自美国BD公司;LATS2、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase-3)、β-连环蛋白(β-catenin)和c-myc抗体均购自美国abcam公司。
1.2 细胞及其培养H9C2大鼠心肌细胞株购自美国ATCC;细胞在DMEM高糖培养基(含有胎牛血清100 ml/ml、青链霉素各100 U/ml)中,置于37℃、5%体积分数的CO2及95%体积分数空气的混合气体中进行常规培养,细胞达80%以上生长融合时进行消化传代,实验为生长至对数期的细胞。
1.3 分组及LATS2 siRNA或LATS2过表达质粒转染H9C2细胞H9C2细胞分为正常对照组(Control组)、单纯缺氧复氧组(H/R组)、siRNA组、H/R+LATS2-siRNA组、pcDNA3.1组和H/R+pcDNA3.1-LATS2组。转染前1 d接种H9C2细胞于6孔板,细胞达80%以上生长融合时进行转染。转染参照LipofectamineTM2000试剂盒。pcDNA3.1-LATS2过表达质粒和空载体(vector组)及LATS2-siRNA和siRNA阴性对照转染H9C2 48 h后收集细胞,用于细胞中LATS2蛋白表达的检测。
1.4 H/R模型制备H9C2心肌细胞转染48 h后,换为在缺氧条件处理的低糖培养基,放入含5%体积分数的CO2及95%体积分数N2的无氧袋中,37℃孵育6 h,取出细胞,换为含血清的高糖DMEM培养液在37℃、5%体积分数的CO2及21%体积分数的O2中进行常规培养2 h。
1.5 LATS2的蛋白表达检测细胞加入适量裂解液提取转染48h的细胞总蛋白,蛋白定量后行10%的SDS-PAGE分离,每泳道加入50 μg蛋白样品,电转移至PVDF膜后封闭液(5%的脱脂奶粉)封闭,4℃孵育一抗过夜,LATS2抗体及内参GAPDF分别按照1:500和1:1000稀释,洗膜后孵育二抗,二抗为HRP标记的羊抗兔抗体(1:10 000稀释),洗膜,室温水平摇床摇动孵育1 h,洗膜,化学发光法在紫外凝胶成像仪上进行拍照分析。
1.6 细胞凋亡检测细胞凋亡采用Annexin V-FITC/PI双染法检测试剂盒,利用流式细胞仪检测。细胞经胰蛋白酶消化后,预冷的磷酸盐缓冲液洗涤细胞,收集1×105个细胞,加入500 μl结合缓冲液重悬细胞,再分别加入5 μl的Annexin V-FITC和5 μl的PI,充分混匀,置于避光室温环境孵育15 min,1 h内上流式细胞仪进行双色荧光细胞流式计数,观察各组细胞的凋亡百分比。实验重复3次。
1.7 活性氧(ROS)含量检测ROS含量检测参照中国碧云天ROS检测试剂盒,细胞进行流式细胞仪检测前,在所有孔中加2',7'-二氯二氢荧光素黄二乙酸酯(DCFH-DA)适量,孵育0.5 h后收集细胞至15 ml的离心管中,离心后弃去上清,洗涤细胞再次弃掉上清,磷酸盐缓冲液200 μl重悬细胞,转细胞于留式管中,流式细胞仪检测各组细胞的荧光强度,其中发射波长为525 nm,激发波长为488 nm。荧光强度的大小与ROS水平呈现正相关,因此可以用荧光强度间接反映细胞内的ROS水平。实验重复3次。
1.8 各组细胞中凋亡蛋白及Wnt信号通路蛋白表达检测通过Western blotting检测各组细胞中凋亡蛋白cleaved caspase3及Wnt信号通路β-catenin和c-myc的蛋白表达,方法参照1.5。
1.9 统计学方法所有实验数据采用SPSS 21.0软件进行分析,计量资料用(±s)表示,多组差异比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 转染后的细胞中LATS2的蛋白表达LATS2 siRNA或LATS2过表达质粒转染H9C2细胞48 h,Western blotting检测转染后的细胞中LATS2的蛋白表达,siRNA组和PcDNA3.1组LATS2的蛋白表达与Control组差异无统计学意义,而LATS2-siRNA组LATS2的蛋白表达显著低于Control组(P=0.002),pcDNA3.1-LATS2组LATS2的蛋白表达显著高于Control组(P=0.000)(图1,表1)。
2.2 LATS2基因对H/R诱导的H9C2心肌细胞凋亡的影响与Control组比较,H/R组细胞凋亡率显著升高(P=0.000),与H/R组比较,H/R+LATS2-siRNA组细胞凋亡率显著升高(P=0.000),H/R+pcDNA3.1-LATS2组细胞凋亡率显著降低(P=0.000)(图2,表2)。
2.3 LATS2基因对H/R诱导的H9C2心肌细胞ROS含量的影响荧光强度的大小与ROS水平呈现正相关,因此可以用荧光强度间接反映细胞内的ROS水平。与Control组比较,H/R组细胞ROS含量显著升高(P=0.000),与H/R组比较,H/R+LATS2-siRNA组细胞ROS含量显著升高(P=0.005),H/R+pcDNA3.1-LATS2组细胞ROS含量显著降低(P=0.001)(表3)。
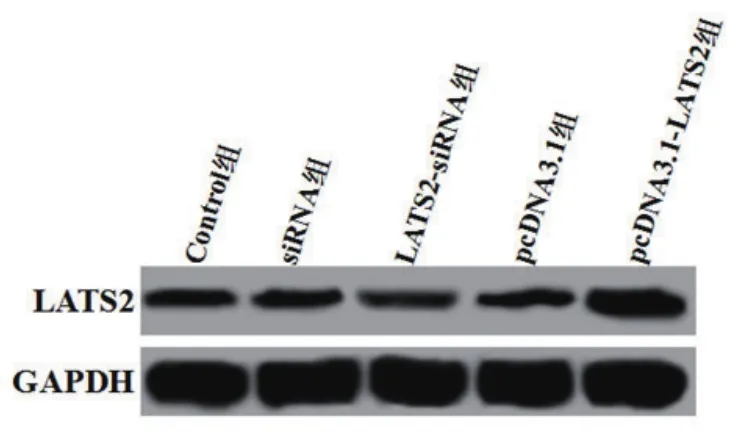
图1 转染后的细胞中LATS2的蛋白表达

表1 转染后的细胞中LATS2的蛋白相对表达量

图2 LATS2基因对H/R诱导的H9C2心肌细胞凋亡的影响

表2 LATS2基因对H/R诱导的H9C2心肌细胞凋亡的影响
2.4 LATS2基因对H/R诱导的H9C2心肌细胞凋亡蛋白及Wnt信号通路蛋白表达的影响通过Western blotting检测各组细胞中凋亡蛋白cleaved caspase3及Wnt信号通路β-catenin和c-myc的蛋白表达。与Control组比较,H/R组cleaved caspase3、β-catenin和c-myc的蛋白表达均显著升高(均P<0.05),与H/R组比较,H/R+LATS2-siRNA组细胞cleaved caspase3、β-catenin和c-myc的蛋白表达均显著升高(P均<0.05),H/R+pcDNA3.1-LATS2组细胞cleaved caspase3、β-catenin和c-myc的蛋白表达均显著降低(P均<0.05)(图3,表4)。
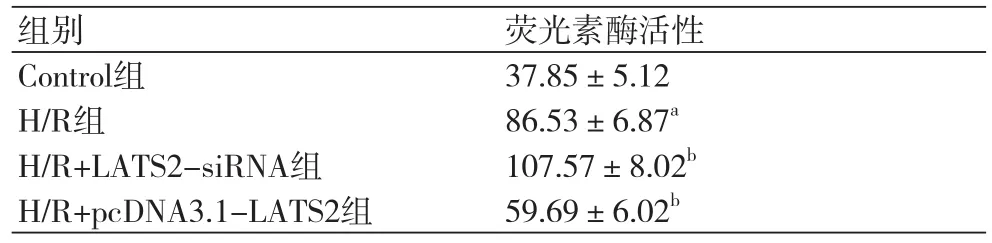
表3 LATS2基因对H/R诱导的H9C2心肌细胞ROS含量的影响
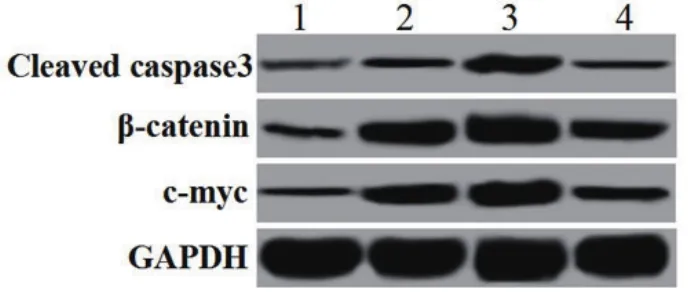
图3 LATS2基因对H/R诱导的H9C2心肌细胞cleaved caspase3、β-catenin和c-myc蛋白表达的影响。
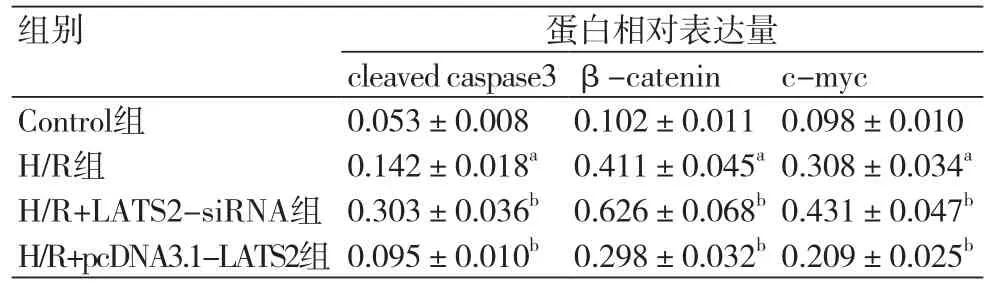
表4 LATS2基因对H/R诱导的H9C2心肌细胞cleaved caspase3、β-catenin和c-myc蛋白表达的影响
3 讨论
目前,冠状动脉旁路移植术、溶栓等方法已在心肌梗死等缺血性心肌疾病治疗中广泛应用,对心肌起到一定的保护作用,但仍无有效的避免心肌细胞凋亡[6],因此,探索心肌损伤过程中引起凋亡的机制对于提供临床治疗靶点有重要意义。LATS2是近些年来新发现的一个基因,参与调控多种信号转导通路而影响细胞周期转化。有研究发现,在心脏及骨骼肌中LATS2的表达升高,可负调控器官组织及心脏功能大小[7]。LATS2是否影响心肌细胞凋亡还未明确。本研究通过将LATS2 siRNA或LATS2过表达质粒转染H9C2细胞,并进行H/R处理,通过流式细胞仪检测LATS2对细胞凋亡的影响,发现H/R可诱导H9C2心肌细胞凋亡,抑制LATS2表达后细胞凋亡率更高,而过表达LATS2可显著降低细胞凋亡。提示过表达LATS2可对心肌细胞起到保护作用。
心肌I/R过程中的心肌细胞凋亡与线粒体损伤、氧自由基释放等多种因素有关,可引起心肌细胞发生DNA断裂,从而导致细胞凋亡,而活性氧引起的心肌氧化应激损伤是心肌I/R损伤的一个重要机制[8,9]。研究发现,ROS可由活化心肌细胞、中性粒细胞等产生,过量的ROS产生可引起细胞内DNA断裂,破坏核酸,最终引起细胞发生死亡[10]。抗氧化治疗可明显降低心肌I/R损伤[11]。此外,细胞凋亡还受到Caspase家族的调控,Caspase3为Caspase家族重要成员及关键酶,正常情况下Caspase3在胞浆中以无活性的酶原形式存在,活化的Caspase3可引起细胞凋亡[12,13]。研究发现,抑制Caspase3的激活可降低心肌细胞的凋亡[14]。本研究结果发现,H/R可提高心肌细胞ROS水平,上调cleaved caspase3表达,抑制LATS2表达ROS水平和cleaved caspase3表达高于H/R组,而过表达LATS2反之。提示LATS2可通过调节ROS水平及cleaved caspase3表达方式调节心肌细胞凋亡。
Wnt信号通路是一个可调节细胞凋亡和分化及机体衰老、生长发育等疾病的重要信号通路,在心脏发育中也发挥重要作用[15]。大量研究显示,在健康成人心脏中Wnt信号通路是沉默的,在心肌梗死后该通路可被持续激活,可诱导细胞凋亡,加速心室重塑的发展进程[16,17]。本研究检测LATS2基因对Wnt信号通路相关分子β-catenin和c-myc的表达,发现抑制LATS2表达β-catenin和c-myc的表达升高,而过表达LATS2可下调β-catenin和c-myc的表达。这提示LATS2可通过抑制Wnt信号通路调控心肌细胞凋亡。
综上所述,抑制LATS2基因表达可促进缺氧复氧诱导的心肌细胞凋亡及上调Wnt信号通路,而抑制LATS2基因表达反之。该研究为LATS2基因在心肌细胞中的作用研究奠定了一定的基础,也为基因治疗心脏疾病提供了新的途径。但本研究关于LATS2对心肌细胞的影响研究有限,还需进一步深入探讨。
