胰腺癌中KLK11的表达及其临床意义
2018-11-07杨旭东赵金钱胡丕波
杨旭东,陈 炯,赵金钱,胡丕波
消化道肿瘤中,胰腺癌属于恶性等级非常高的一类,死亡率一直居高不下,5年生存率不及5%[1]。在美国,该疾病在造成癌症死亡原因中位列第三,远高于乳腺癌[2]。目前认为胰腺癌患者长期生存唯一有效的方法是手术切除,15%~20%的病例是可能根治性切除的,但这些患者的5年生存率低于10%[3]。由于其发病隐匿,病情发展迅速,一经确诊大多处于晚期或发生了远处转移,往往丧失了最佳手术机会,因此治疗效果及预后极差。人类组织激肽释放酶(human tissue kallikreins,KLK)基因家族由15个成员(KLK1-KLK15)组成,是整个人类基因组中最大的连续的肽酶编码基因簇。KLK11位于染色体区域位点19q13.3-q13.4(16,25)。该研究通过免疫组织化学(immunohistochemistry,IHC)法检测KLK11在胰腺癌组织及癌旁正常胰腺组织中表达,并将KLK11的转录和蛋白质表达水平作为切入点,探究其在胰腺癌中的表达情况,再针对其和该疾病患者临床病理资料之间的关联性展开剖析,进一步分析KLK11的表达及其患者临床病理参数对胰腺癌预后的影响。
1 材料与方法
1.1病例资料选取安徽医科大学附属省立医院普外科2012年1月~2015年12月接收的实施根治性手术切除并经病理证实的胰腺癌组织(pancreatic carcinoma tissue,PCT)及其相配对的癌旁正常胰腺组织(non-carcinoma adjacent tissues of pancreatic carcinoma,Non-PCT)各75例。被研究者临床资料完整,术前无放化疗。其中:男44例,女31例;年龄36~ 79(62.17±9.02)岁,<60岁22例,≥60岁53例;胰头癌、胰体尾癌分别为54例、21例;高、中低分化分别为14例、61例;直径<2 cm者20例,≥2 cm的55例;恶性肿瘤分期(tumor node metastasis,TNM)Ⅰ期29例,Ⅱ期46例;淋巴结转移及未转移分别为48例、27例;神经侵犯33例,未被侵犯42例。本研究已经获取医院伦理委员会的许可,全体病患均知情并且同意。
1.2主要试剂TRIzol试剂购自美国Invitrogen 公司;逆转录试剂盒购自美国Thermo公司;KLK11一抗购自美国Proteintech公司;二抗、IHC试剂盒购自北京中杉金桥生物技术有限公司。
1.3方法
1.3.1实时荧光定量PCR(quantitative real-time PCR,qRT-PCR) 分别提取PCT及Non-PCT各50 mg,提取总RNA为模板, 按照逆转录试剂盒进行PCR扩增。内参照为GAPDH,上游引物:5’-GGGAAATCGTGCGTGACATTAAGG-3’,下游引物:5’-CAGGAAGGAAGGCTGGAAGAGTG-3’,产物大小180 bp;KLK11引物序列上游引物: 5’-TGGCAACAGGGCTTGTAGGG-3’,下游引物: 5’-GTAGCCGCGTCTTCTCGAAC-3’,产物大小105 bp。
1.3.2Western blot 分别将PCT及Non-PCT按照1 ∶10添进RIPA裂解液并使其完全分裂溶解,组织匀浆、超声以及离心,提取上清液后检测总蛋白浓度。上样量均为 25 μl,电泳、转膜、5%脱脂牛奶室温封闭之后,加入稀释一抗(1 ∶1 000),孵育洗涤后加入稀释二抗(1 ∶5 000)室温孵育2 h,TBST洗涤后显色、定影观察。
1.3.3IHC 石蜡包埋标本4 μm连续切片, 通过二甲苯脱蜡, 再水合并用磷酸盐缓冲盐水(PBS)洗涤。而后微波加热法将其置入柠檬酸钠缓冲液(pH 6.0)中,80 ℃保温20 min完成抗原修复。依次滴加3% H2O2、一抗稀释液(1 ∶200),4 ℃温育过夜,复温后加入二抗,最后显色、脱水后封片。根据整张病理切片低倍镜视野下染色细胞的百分比和染色强度半定量评估KLK11的表达。染色细胞百分比排列如下:0分为无染色,1分为1%~15%染色,2分为15%~45%染色,3分为>45%染色。细胞染色强度分为不同的评分:切片为棕黄色、黄色、淡黄色、未着色依次记成3、2、1、0分。染色细胞的百分比与染色强度两项得分的乘积是最后得出的分数,低于3则判定为表达较低,反之则为表达较高。全部切片的评估活动都由两名具有丰厚经验的病理科医师共同开展,二者对于对方的评估互不知晓。
2 结果
2.1PCT、Non-PCT中KLK11的mRNA表达利用qRT-PCR方法分别检测配对的PCT及Non-PCT各10例,平均表达水平分别为(1.413±0.659)、(0.488±0.324)。PCT组KLK11 mRNA 的表达水平明显高于Non-PCT组,差异有统计学意义(t=3.979,P<0.01)。
2.2PCT、Non-PCT中KLK11的表达
2.2.1Western blot检测KLK11的表达情况 分别检测PCT及Non-PCT各10 例, PCT 组KLK11的表达明显高于Non-PCT组,PCT 组KLK11相对表达量为1.83±0.18,显著高于Non-PCT组(1.00±0.08),差异有统计学意义(P<0.01)。见图1。

图1 两组中KLK11的表达水平
2.2.2IHC检测KLK11的表达 检测75例PCT及相配对的Non-PCT,结果显示PCT组KLK11阳性表达的有58例(77.33%),高于Non-PCT组(20%),差异有统计学意义(P<0.01)。见图2。
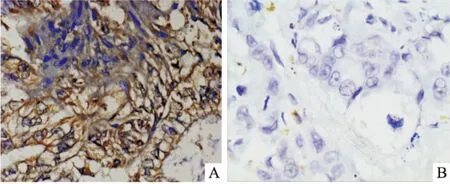
图2 KLK11在PCT和Non-PCT中的表达 SP×400
A:KLK11在PCT中的表达;B:KLK11在Non-PCT中的表达
2.3KLK11和胰腺癌患者临床病理资料间的关联性IHC表明KLK11的表达和胰腺癌的淋巴结转移以及TNM存在明显的相关性(P<0.001)。但是和患者其余临床资料之间无明显相关性。见表1。

表1 KLK11表达与胰腺癌临床病理特征的相关性
2.4生存分析
2.4.1KLK11的表达与OS和DFS的关系 Kaplan-Meier分析显示,KLK11在胰腺癌组织中高表达的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)(平均DFS:7.217个月,平均OS:14.318个月)比KLK11低表达的DFS和OS(平均DFS:16.939个月,平均OS:22.776个月)显著缩短,差异有统计学意义(P<0.01)。见图3。
2.4.2KLK11的表达和胰腺癌患者临床病理参数及胰腺癌预后的关系 单因素分析与OS和DFS相关的因素结果表明,KLK11在胰腺癌组织中的高表达,淋巴结转移以及TNM分期与胰腺癌不良预后显著相关,差异有统计学意义(P<0.01)。见表2。而多因素分析结果表明KLK11在胰腺癌组织中的高表达是胰腺癌预后的独立因素[OS:风险比(hazard ratio,HR)=4.903; 95%CI:1.641~14.649;P=0.004;DFS:HR=5.437; 95%CI:1.816~16.275;P=0.002)]。见表3。
3 讨论
研究[4]表明,各类肿瘤诊断及监测的生物标志物KLK受到的关注度日渐提升。被称为前列腺特异性抗原(prostate-specific antigen,PSA)的KLK3在临床中使用率较高,在前列腺癌的筛查中发挥着不可替代的作用[5]。KLK11是KLK基因家族成员之一,多种肿瘤中检测到异常,包括前列腺癌、卵巢癌、胃癌、乳腺癌以及直肠癌在内的许多癌症中异常表达[6-7]。而KLK11在胰腺癌中的病理生理作用却极少被提起。本研究借助对75例PCT与Non-PCT中KLK11的表达进行IHC检测,结果显示KLK11的强阳性表达主要集中于PCT导管细胞的细胞质之中,而在Non-PCT导管细胞中却没有明显的表达,虽然它在后者中的腺泡及胰岛两类细胞中有所表达,但是表达程度明显弱于胰腺导管细胞。同时它的表达与胰腺癌的淋巴结转移以及TNM分期有明显的相关性(P<0.01),但是和患者其余临床资料之间没有明显的相关性。Western blot和qRT-PCR实验显示KLK11及其mRNA在PCT中的表达较高,而在Non-PCT中却比较低。由此可见, KLK11在PCT导管细胞中的表达偏高,究其根本可能是和胰腺癌的发病存在一定的相关性。 另外,该研究通过Kaplan-Meier分析,结果表明KLK11高表达的生存时间比KLK11低表达的生存时间明显缩短。进一步通过分析KLK11的表达及其他临床病理参数对胰腺癌预后的影响,单因素分析显示KLK11在胰腺癌组织中的高表达、淋巴结转移以及TNM分期与胰腺癌不良预后具有一定的相关性,而通过COX回归模型多因素分析得出的结论是KLK11在胰腺癌中的阳性表达是胰腺癌预后的独立因素。

图3 Kaplan-Meier分析KLK11的表达与OS和DFS的关系

变量患者例数(n)OS中位生存期(月)χ2值P值DFS中位生存期(月)χ2值P值年龄(岁)0.0560.8130.0590.808 <602216.3677.467 ≥605315.8677.433性别3.2560.0714.7950.029 男4417.0338.133 女3115.7337.333肿瘤部位0.5650.4522.1210.145 头部5416.1338.100 体尾部2115.7337.267肿瘤直径(mm)3.0790.0792.7580.097 <202017.2678.267 ≥205515.3337.333分化程度0.9610.3270.9610.327 中低6115.4677.433 高1417.2679.333神经侵犯0.0350.8520.1720.679 阴性4216.3677.900 阳性3315.3337.333淋巴结转移23.641<0.00126.924<0.001 阴性2720.36712.833 阳性4815.1337.133TNM分期24.678<0.00128.698<0.001 Ⅰ2920.36710.600 Ⅱ4615.0337.033KLK1125.614<0.00129.837<0.001 低表达1727.46711.233 高表达5815.3337.233
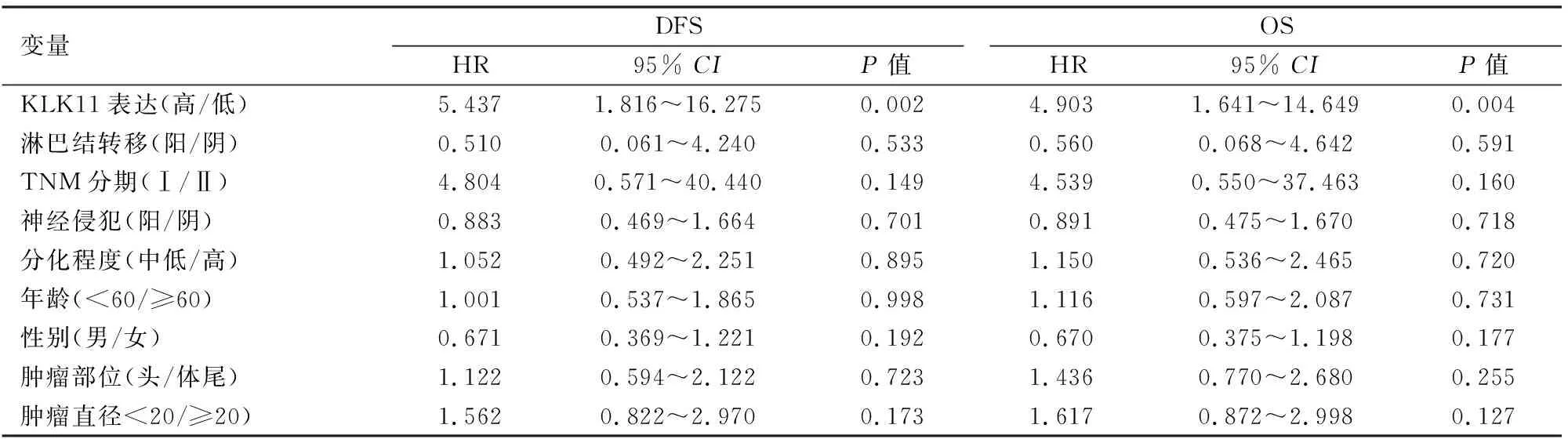
表3 多因素分析与OS和DFS相关的因素
诸多恶性肿瘤侵袭转移及其预后都和KLK11存在密切的相关性。 Alexopoulou et al[8]采用qRT-PCR技术对120例原发性结直肠腺癌患者的120例癌性和41例非癌性结直肠组织标本进行KLK11 mRNA表达研究,结果显示结直肠腺癌组织当中的KLK11转录物出现了明显的增加。同时在对KLK11 mRNA表达和结直肠腺癌临床病理特点之间的相关性加以探究之后,发现其表达和肿瘤浸润深度、组织学亚型以及分级都具有一定的相关性。KLK11 mRNA表达可被认为是结直肠腺癌新的预后生物标志物,对高侵袭性肿瘤和(或)淋巴结阳性患者具有更高的预后价值。Unal et al[9-10]研究了KLK11在胃癌和非转移性非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中的表达情况。通过对55例手术和辅助放化疗治疗的胃癌患者的肿瘤组织进行IHC切片。结果显示在55例患者中,35例(63.6%)为KLK11表达阳性,20例(36.4%)为KLK11表达阴性,KLK11阳性患者的DFS和OS(DFS:24个月,OS:29个月)显著高于KLK11阴性患者(DFS:11个月,OS:13个月)(P<0.05)。研究[9]表明胃癌中KLK11的阳性表达可能是胃癌的预后生物标志物。在对44例NSCLC患者的研究中,同样利用IHC方法检测KLK11的表达,再通过Kaplan-Meier分析显示KLK11强阳性患者 DFS高于KLK11弱阳性患者DFS(12个月/9个月,P=0.113),差异无统计学意义, 但KLK11强阳性患者OS明显高于KLK11弱阳性患者OS(20个月/11个月,P=0.032)。多变量Cox回归分析显示KLK11在NSCLC患者中的强弱表达与患者OS显著相关(P=0.032)。研究[10]推测KLK11也可能作为NSCLC的预后生物标志物。
KLK11在诸多恶性肿瘤中发挥着不可替代的作用。本研究结果表明KLK11的异常表达与胰腺癌的发生发展密切相关,对胰腺癌的转移监测及其预后具有潜在应用价值,但在胰腺癌中的作用机制还有待研究。后期课题组将通过细胞转染及基因敲除技术深入研究KLK11在胰腺癌中发挥的作用。
