二甲双胍联合索拉菲尼对肝癌HepG2细胞的协同抗肿瘤作用
2018-11-07刘国东单深良刘付宝
刘国东,张 雪,林 群,方 强,单深良,谢 坤,刘付宝
肝细胞肝癌是肝脏肿瘤最常见的类型,其死亡率高,占肿瘤相关性死因的第三位[1]。全球每年有500 000例以上新诊断的患者,其中约50%来自中国[2]。尽管肝移植、手术切除和局部消融等治疗方式改善了早期肝癌的预后,但肝癌的整体预后仍不理想,因为大多数患者诊断时已处于晚期阶段。索拉菲尼(sorafenib,Sor)是FDA批准的晚期肝癌的标准治疗药物,但由于复发和转移,药物的反应率有所限制。二甲双胍(metformin,Met)是2型糖尿病的常见治疗药物,它的抗肿瘤作用被广泛研究,结果表明,Met可抑制肿瘤细胞增殖、诱导细胞凋亡以及增加化疗和靶向药物的敏感性[3]。该研究将探讨Met与Sor联合对肝癌细胞HepG2增殖及凋亡的影响,为肝癌的有效治疗提供理论依据。
1 材料与方法
1.1实验材料肝癌细胞株HepG2由安徽医科大学第一附属医院实验室馈赠;Sor购于美国MCE生物公司;二甲双胍、DMSO、MTT购于美国Sigma-Aldrich公司;DMEM培养基购自英国Hyclone 公司;Annexin V-FITC/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒购于上海贝博生物公司;胎牛血清、SDS-PAGE凝胶配制试剂盒购自北京碧云天生物公司;免疫印迹化学发光试剂ECL购自美国Millipore 公司;抗β-actin抗体、抗Erk抗体、抗p-Erk抗体、抗Akt抗体、抗p-Akt抗体购于美国CST公司;抗Bcl-2抗体、抗Bax抗体、HRP标记山羊抗小鼠和抗兔二抗购于北京中杉金桥生物技术公司。
1.2细胞培养将HepG2细胞株复苏后培养于37 ℃、5% CO2的恒温无菌培养箱中,使用的培养基为含10%胎牛血清、1%青-链霉素的DMEM。定期换液(1~2 d/次),显微镜下观察细胞形态,待细胞长至80%左右胰酶消化传代,取对数生长期的细胞制备细胞悬液,用于实验。
1.3MTT检测Met及Sor对HepG2细胞增殖的影响实验分为空白组、阴性对照组、药物组。将HepG2细胞(密度1×105个/ml)均匀接种于96孔板中,细胞贴壁后作相应处理,Met组药物浓度为1.25、2.5、5、10、20、40 mmol/L。Sor组药物浓度为1.25、2.5、5、10、20、40 μmol/L,联合组取上述各单药组浓度组合。72 h后加入5 mg/ml的MTT液(20 μl/孔),避光孵育4 h后弃上清液,加入DMSO(200 μl/孔),震动10 min,于酶标仪上读取490nm和655 nm双波长处的吸光度(optical density,OD)值,计算增殖抑制率,抑制率(%)=[1- (实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。计算单药的半数抑制浓度(IC50)及两药联合时的联合指数(combination index,CI),CI<1表示两种药物有协同效应,CI=1表示两种药物有相加效应,CI>1表示两种药物有拮抗效应。后续各实验取IC50作为单药及联合给药的药物浓度。实验重复至少3次。
1.4荧光染色法观察细胞凋亡形态学变化将细胞悬液均匀接种于6孔板中,待细胞贴壁生长至60%左右时,对照组细胞仅换液,实验组包括Met组(10 mmol/L)、Sor组(6 μmol/L)、Met+Sor组(10 mmol/L+6 μmol/L),药物处理24 h后PBS洗涤2次,每孔依次加入Annexin V结合液500 μl、AnnexinV-FITC 5 μl,避光孵育10~15 min,再加入10 μl PI染液,避光孵育5 min,显微镜下观察光镜及荧光镜下细胞凋亡形态学改变,拍照记录。
1.5流式细胞术(flowcytometry,FCM)检测细胞凋亡率实验分组及处理同1.4项,药物处理24 h后,胰酶消化收集细胞,冷PBS洗涤2次,按细胞凋亡试剂说明书进行FCM检测,FlowJo7.6.1软件分析各组细胞凋亡率。
1.6Westernblot检测p-Erk、p-Akt、Bcl-2、Bax蛋白表达水平将上述4组细胞培养24 h后收集细胞,制备蛋白样品,配胶上样,SDS-PAGE凝胶电泳(浓缩胶80 V,20 min;分离胶120 V,80 min),转膜(220 mA,100 min),5%脱脂牛奶封闭1 h,一抗室温孵育1 h或者4 ℃过夜,洗膜3次(10 min/次),二抗室温孵育1 h,洗膜3次(10 min/次),加入ECL发光液,暗室中显影、定影,烘干保存胶片。
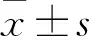
2 结果
2.1Met、Sor及双药联合对肝癌HepG2细胞的增殖抑制作用MTT法结果显示细胞的增殖抑制率随着药物浓度的升高而升高,Met和Sor单药作用72 h的IC50分别为(9.87±1.52)mmol/L和(5.65±0.71)μmol/L(图1)。计算各浓度单药联合时的CI值,结果均小于1,提示Met与Sor联合具有协同作用,制作效应(Fa)-联合指数(CI)图(图2)。
2.2荧光显微镜下观察各组细胞的凋亡形态变化与对照组相比,Met与Sor处理组可见明显处于早期凋亡的细胞(绿色荧光);联合组细胞凋亡更加显著,细胞核或细胞质内可见增多的浓染的红色荧光(晚期凋亡),贴壁细胞数量大量减少,细胞间隙增大,细胞变瘦,呈现出明显的凋亡特征(图3)。
2.3FCM检测各组细胞凋亡率各组细胞作用24 h后,Met、Sor及联合组的细胞凋亡率分别为(13.94±0.40)%、(16.54±0.09)%、(42.09±1.12)%,与对照组相比,差异有统计学意义(F=1 536.00,P<0.01)(图4)。
2.4Westernblot检测相关蛋白表达水平与对照组相比,Met及Sor单药均可一定程度地降低p-Erk蛋白、 p-Akt蛋白及抗凋亡蛋白Bcl-2的表达,增加促凋亡蛋白Bax的表达,两药联合上述效应更显著,差异有统计学意义(F=195.08、38.87、40.47、487.95,P<0.01)(图5)。
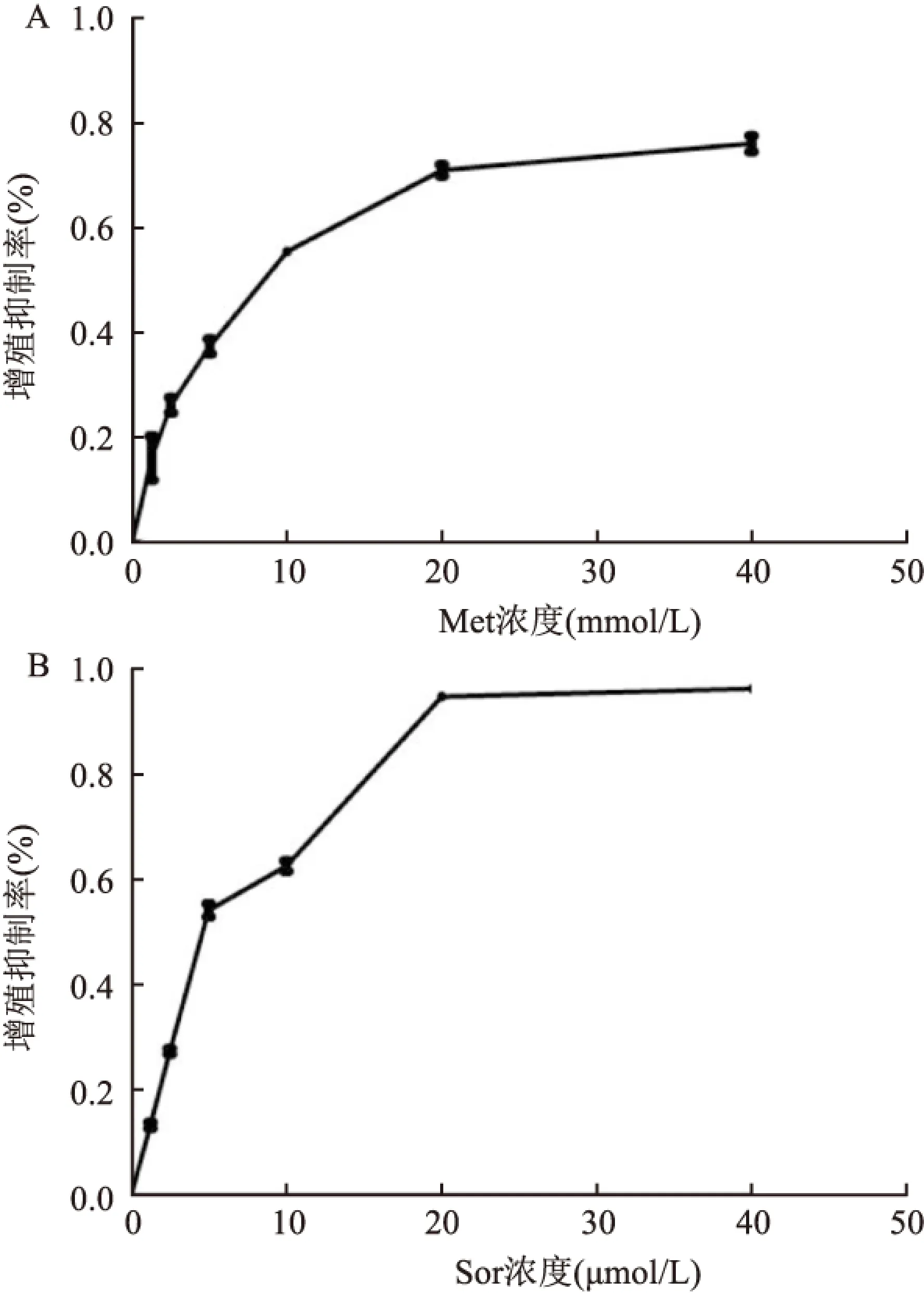
图1 MTT法检测Met和Sor对HepG2细胞增殖的影响

图2 Met和Sor对HepG2细胞的协同效应
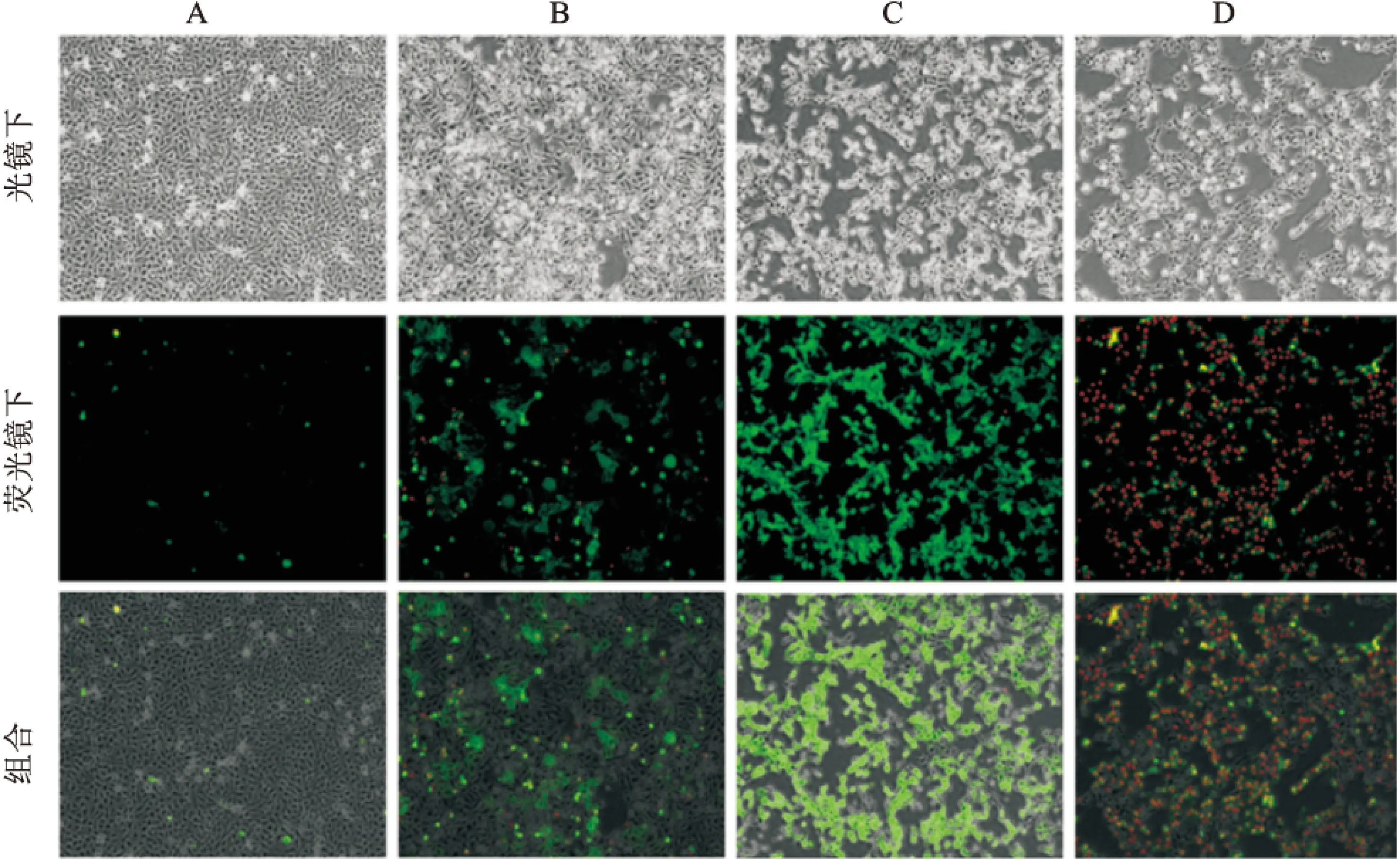
图3 荧光显微镜下观察各组细胞凋亡的形态学变化 ×400

图4 流式细胞术检测各组细胞的凋亡率
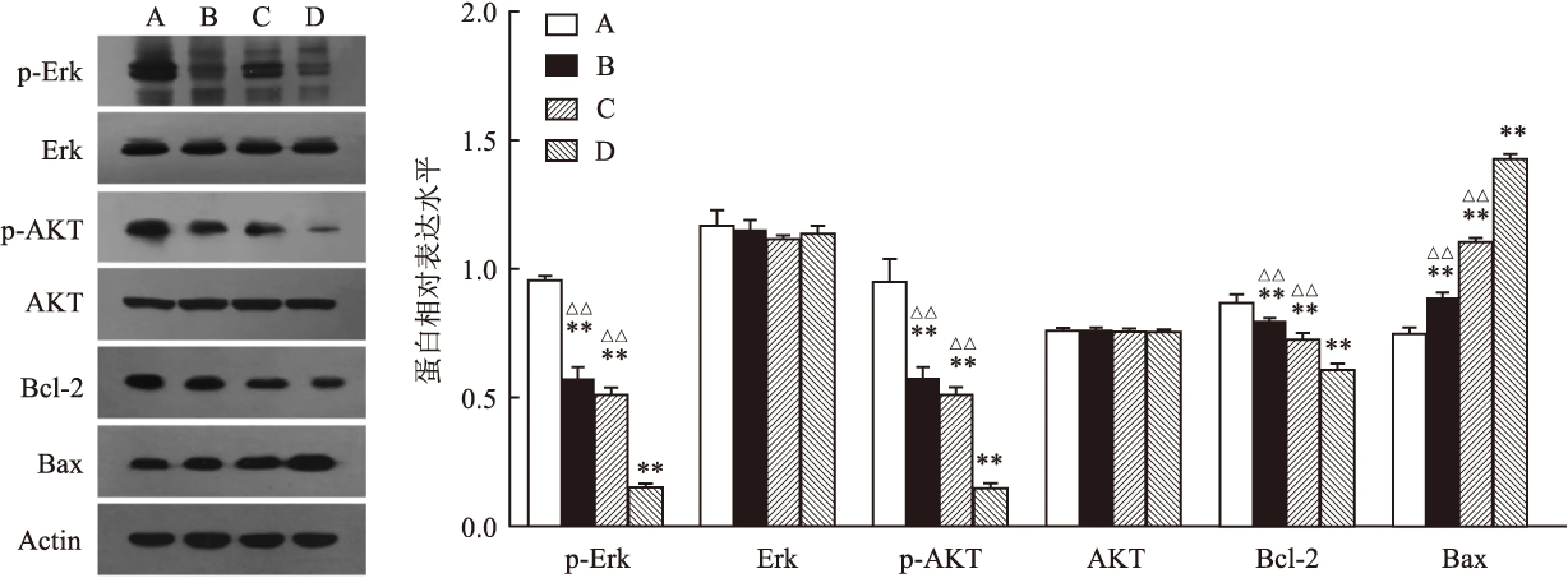
图5 Western blot检测p-Erk、p-Akt、Bcl-2、Bax等蛋白表达水平
3 讨论
近年来,Met的潜在抗肿瘤作用被广泛报道,包括肝细胞肝癌, 研究[4-6]表明,Met与化疗或放疗等方式联合应用于多种肿瘤细胞中具有协同效应,在并且可能增强放疗介导的肝细胞肝癌的凋亡作用、逆转肝癌细胞的多药耐药性。Bhalla et al[7]的研究显示,食用含有Met食物组的小鼠患肝癌的比例比对照组低57%,服药后仍患肿瘤的小鼠其肿瘤平均体积比对照组小37%,说明Met对肝癌的预防和治疗具有一定作用。
Met主要通过活化腺苷酸活化蛋白激酶(AMPK)进而下调m-TOR信号通路发挥抑制肿瘤细胞生长的作用[8]。mTOR蛋白是一种非典型的丝氨酸/苏氨酸蛋白激酶,在调节细胞生长、增殖、细胞周期等多个方面扮演着重要角色,mTOR的上游信号传导途径主要有两条:① 经典的PI3K/Akt/mTOR信号通路。PI3K可被激活的Ras通路以及一些生长因子及细胞因子激活,进而激活Akt,活化的Akt可以直接磷酸化mTOR[9]。② 非依赖PI3K/Akt 途径:越来越多的研究显示AMPK与mTOR的活性调节有关。另外,Met可通过胰岛素样生长因子(insulin like growth factor,IGF)及其下游信号分子抑制肿瘤生长,Met可抑制肠道细胞吸收葡萄糖发挥降糖作用,有效降低胰岛素水平,通过胰岛素样生长因子1(IGF-1)通路抑制肿瘤细胞增殖[10-11]。而PI3K/Akt/mTOR信号通路为胰岛素样生长因子受体(IGFR)下游一条重要信号通路,故Met也可通过抑制IGFR来抑制PI3K/Akt/mTOR信号通路,从而抑制mTOR信号通路。
该研究将Met与Sor联合,结果显示两者均可抑制肝癌细胞的增殖、诱导细胞凋亡,两药联合具有协同效应,荧光染色法观察两药联合后细胞凋亡形态学变化较单药组更加明显,Western blot检测抗凋亡蛋白Bcl-2的表达减弱,促凋亡蛋白Bax表达增强,进一步探究发现Met及Sor单药均可降低p-Erk和p-Akt的表达,联合应用上述效果更显著。Met可通过减少肝糖原异生,增加周围组织对胰岛素的敏感性、抑制肠道细胞吸收葡萄糖发挥降糖作用,有效降低胰岛素水平,通过抑制IGFR信号通路进而抑制p-Akt,使细胞增殖受到抑制,发生凋亡,并且Met还可抑制线粒体氧化呼吸链复合体Ⅰ的功能,使ATP合成减少,AMP水平升高,间接激活AMPK[12]。Sor是一个多靶点的小分子激酶抑制剂,它可以通过抑制Raf激酶、血管内皮生长因子受体(VEGFR) 和血小板衍生生长因子(PDGF)等多个途径发挥抗肿瘤作用[13]。该研究发现Sor可直接抑制Raf/MEK/ERK信号通路,降低p-Erk的表达,并且其可能通过抑制Ras/Raf的活性继而抑制PI3K/Akt/mTOR信号通路。
本研究结果证实Met和Sor联合可共同抑制PI3K/Akt/mTOR和Raf/MEK/ERK信号通路,发挥协同抗肿瘤作用,为肝癌新的治疗方式提供理论依据,然而,药物的抗肿瘤机制十分复杂,是否有其他机制参与其中尚需进一步研究。
