蛇床子素对大鼠肾脏缺血再灌注损伤的保护作用研究
2018-11-07李贵森
张 炯,王 佳,王 芳,李贵森
肾脏缺血再灌注损伤(renal ischemia reperfusion injury,RIRI)是临床上常见的一种临床病理生理过程,是由于肾脏缺血及重获血流灌注或氧供应后, 对所产生的损伤作用。常继发于肾移植、休克、心脏体外大循环手术等,是引发急性肾损伤乃至急性肾衰竭的常见原因[1-3],严重影响患者预后。如何减轻RIRI,成为改善肾功能的关键。蛇床子素(Osthole)是从天然植物蛇床中提取的一种单体,研究[4-5]显示其具有抗病毒、抗氧化、抗炎、抗凋亡、增强免疫等多种生物学功能,并且毒副作用低,具有良好的临床应用前景。现就蛇床子素在肾脏缺血再灌注损伤中的作用及潜在机制进行探讨。
1 材料与方法
1.1材料30只健康雄性SD大鼠,体质量220~250 g,由四川大学实验动物中心提供。Osthole购自中国药品生物制品检定所,纯度99.9%。Cleaved-Caspase3、Caspase3、Cleaved-Caspase9、Caspase9、Bax、BCL-2、Cyt C一抗均购于美国CST公司;ATP活性试剂盒、活性氧(reactive oxygen species,ROS)试剂盒和线粒体膜电位试剂盒均购于美国Ebioscience公司;水合氯醛、聚乙二醇、细胞质和细胞核提取试剂盒均购于武汉谷歌公司。
1.2方法
1.2.1动物分组与模型制备 30只SD大鼠随机均分为假手术组(Sham组)、肾脏缺血再灌注损伤组(RIRI组)和蛇床子素组 (Osthole组)。Osthole组在术前45 min分别给予腹腔注射药物Osthole(40 mg /kg),此剂量依据文献[6]。Sham组和RIRI组在术前45 min给予腹腔注射等体积量的生理盐水。参照Xie et al[6]建立大鼠RIRI模型。
1.2.2标本收集 肾脏恢复血流再灌注24 h后,收集各组大鼠血清和左侧肾脏, 离心,送四川省人民医院检验科利用全自动生化分析仪检测血清肌酐(creatinine, Cr)和血清尿素氮(blood urea nitrogen, BUN)的水平,取部分左侧肾置于-80 ℃冰箱保存,用于Western blot蛋白检测,其剩余肾组织置于10%的多聚甲醛以便利用HE染色观察肾脏病理形态。
1.2.3HE染色组织学检查 将多聚甲醛固定的肾脏组织行石蜡包埋,切片,HE染色,光镜下观察肾组织病理形态学变化,损伤评分标准参见文献[6]。并按照试剂盒说明书利用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)染色检测肾脏细胞凋亡,具体步骤参见说明书。
1.2.4Western blot检测各组蛋白的表达 取-80 ℃冰箱保存的肾组织,按照试剂后说明书提取细胞质、细胞核和总蛋白。利用BCA试剂盒测定蛋白浓度,然后上样,电泳,转膜,孵育一抗[Cleaved-Caspase3抗体(1 ∶500),Caspase3抗体(1 ∶1 000), Cleaved-Caspase9抗体(1 ∶500),Caspase9抗体(1 ∶1 000), Bax抗体(1 ∶500), BCL-2抗体(1 ∶500), CytC抗体(1 ∶500) 和β-actin抗体(1 ∶3 000)],然后在4 ℃冰箱孵育过夜。洗涤, 37 ℃孵育二抗(IgG)1 h,洗涤,利用ECL显影剂显影,Bio-Rad成像并分析灰度值,具体步骤参考说明书和文献[7]。
1.2.5线粒体的提取和线粒体膜电位测定 按照试剂盒说明书提取肾脏线粒体和检测线粒体膜电位(ΔΨm),单位为毫伏(mv),具体步骤参见说明书。
1.2.6肾脏活性氧(ROS)含量和ATP酶活性 提取肾组织匀浆按照试剂盒说明书检测ROS含量和ATP酶活性。
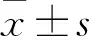
2 结果
2.1蛇床子素对RIRI大鼠肾功能的影响与Sham组相比,RIRI组血清中Cr和BUN表达量明显增加(P<0.05);与RIRI组相比,Osthole组Cr和BUN表达量明显降低(P<0.05),提示蛇床子素对肾脏缺血再灌注损伤有保护作用,见表1。

表1 蛇床子素对Cr和BUN影响
与Sham组比较:***P<0.001;与Osthole组比较:#P<0.05
2.2蛇床子素对RIRI大鼠肾脏病理形态影响RIRI组与Sham组相比,肾小管明显扩张,管腔大量阻塞,肾小管大量坏死、脱落、大量蛋白管型、肾间质大量炎性细胞浸润;与RIRI组相比,Osthole组肾小管扩张、管腔阻塞、坏死、脱落、肾间质炎性细胞浸润均明显减少,具体损伤评分见图1。提示蛇床子素可减少肾脏病理损伤。
2.3蛇床子素对RIRI大鼠肾脏线粒体膜电位的影响与Sham组相比, RIRI组线粒体膜电位(ΔΨm)明显降低(P<0.05); 而Osthole组与RIRI组相比, 线粒体膜电位(ΔΨm)明显增高(P<0.05)。提示蛇床子素可增加线粒体膜电位,见图2。

图1HE染色检测蛇床子素对肾脏病理形态的影响×200
A:Sham组;B:RIRI组;C:Osthole组;与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
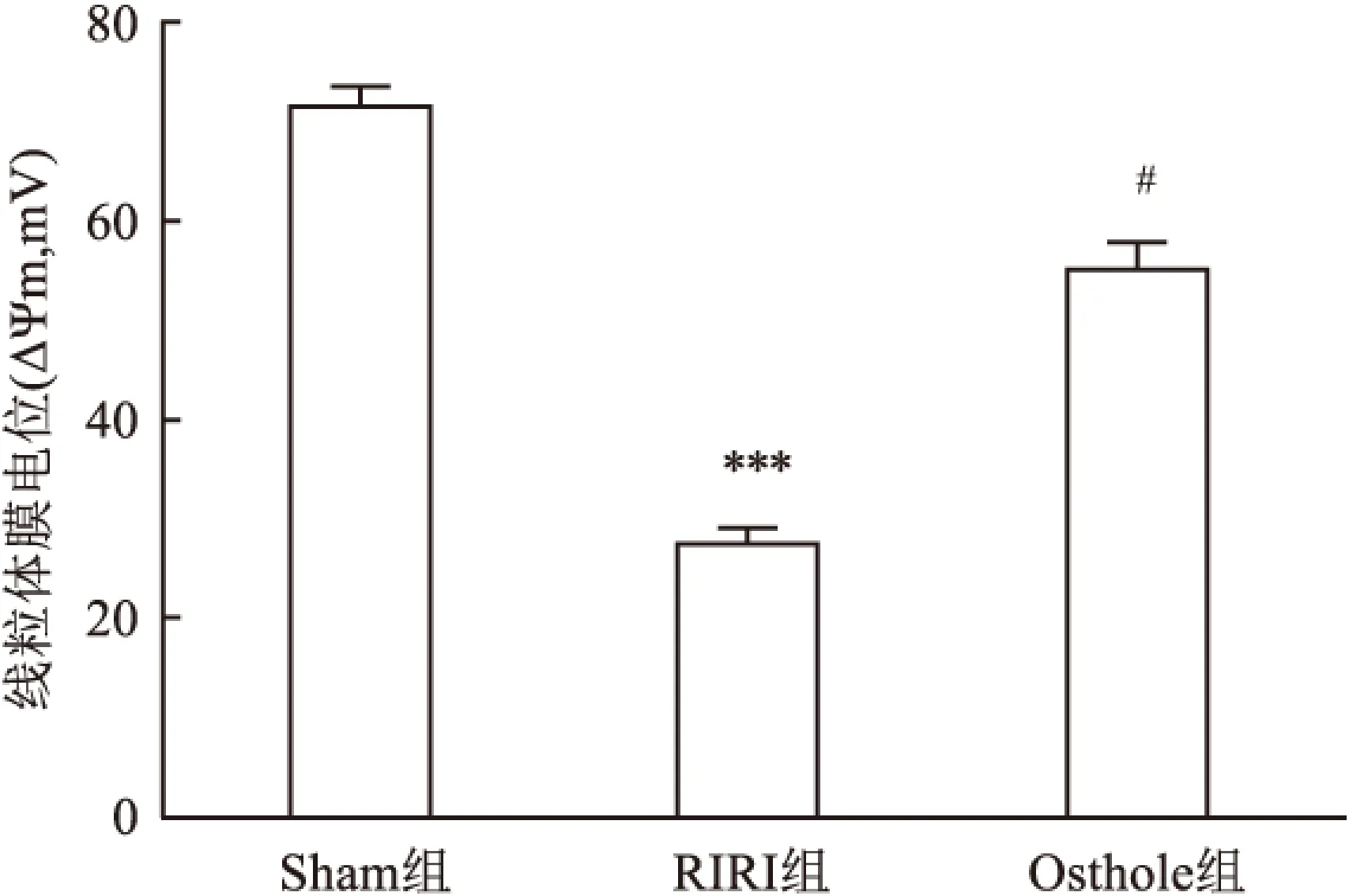
图2 流式检测蛇床子素对线粒体膜电位影响
与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
2.4蛇床子素对RIRI大鼠肾脏ROS含量影响与Sham组相比,RIRI组ROS含量明显增高(P<0.05); 而Osthole组与RIRI组相比,ROS含量明显降低(P<0.05)。提示蛇床子素可减少ROS含量,见图3。

图3 荧光分光光度法检测蛇床子素对ROS含量的影响
与Sham组比较:**P<0.01;与RIRI组比较:#P<0.05
2.5蛇床子素对RIRI大鼠肾脏线粒体ATP酶活性影响与Sham组相比, RIRI组ATP酶活性明显降低(P<0.05); 而Osthole组与RIRI组相比,ATP活性明显升高(P<0.05),见图4。提示蛇床子素可增加线粒体ATP酶活性。
2.6蛇床子素对肾缺血再灌注损伤大鼠肾脏凋亡信号通路的激活与Sham组相比, RIRI组Cleaved-Caspase9和 Cleaved-Caspase3表达均明显增高(P<0.05),而Caspase9和Caspase3表达均明显降低(P<0.05)。而Osthole组与RIRI组相比,Cleaved-Caspase9和 Cleaved-Caspase3表达均明显降低(P<0.05),而Caspase9和Caspase3表达均明显增高(P<0.05), 见图5。提示蛇床子素可抑制凋亡信号通路的激活。
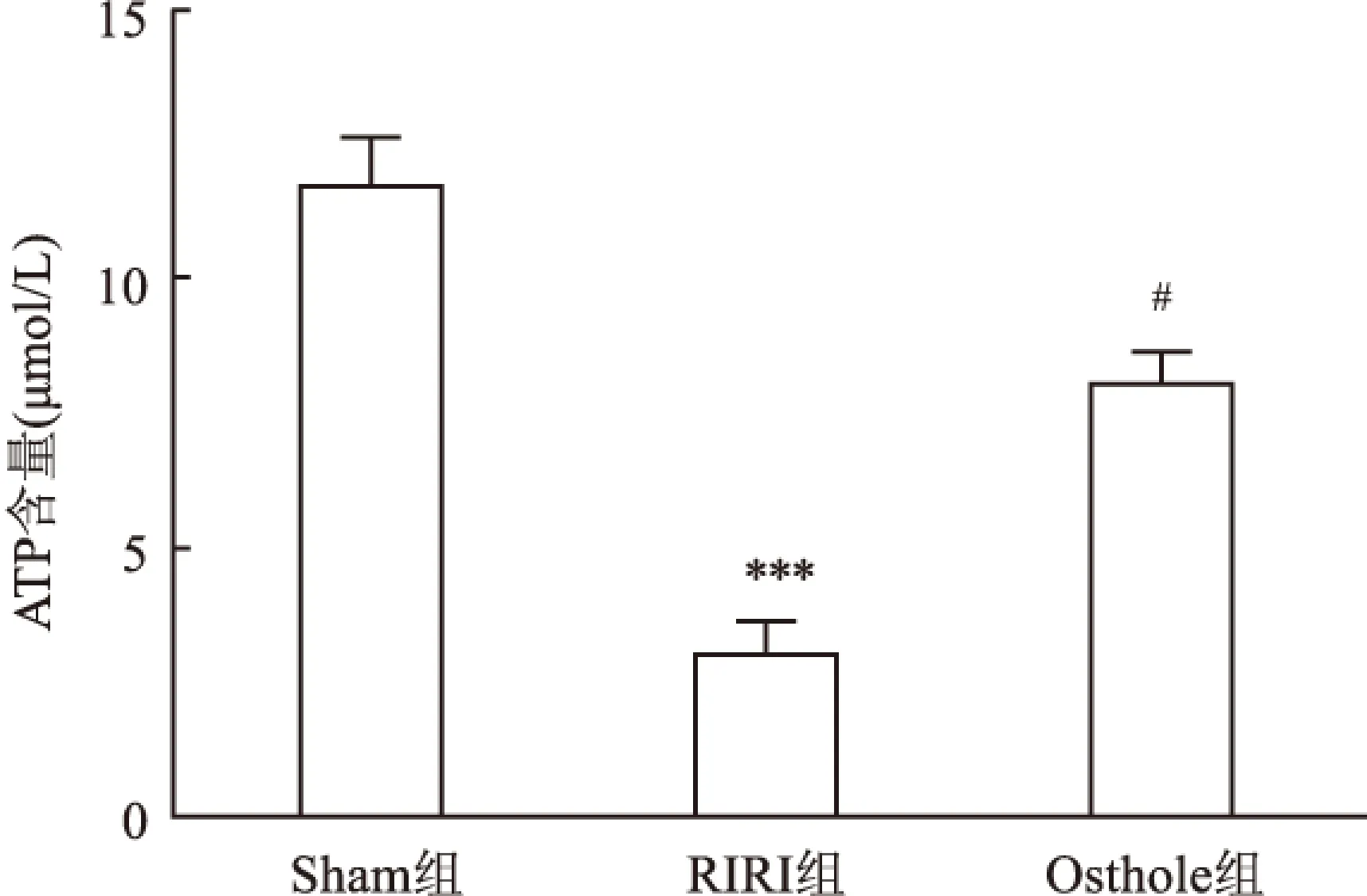
图4 ATP酶法检测蛇床子素对ATP活性的影响
与Sham组比较:*P<0.05;与RIRI组比较:#P<0.05
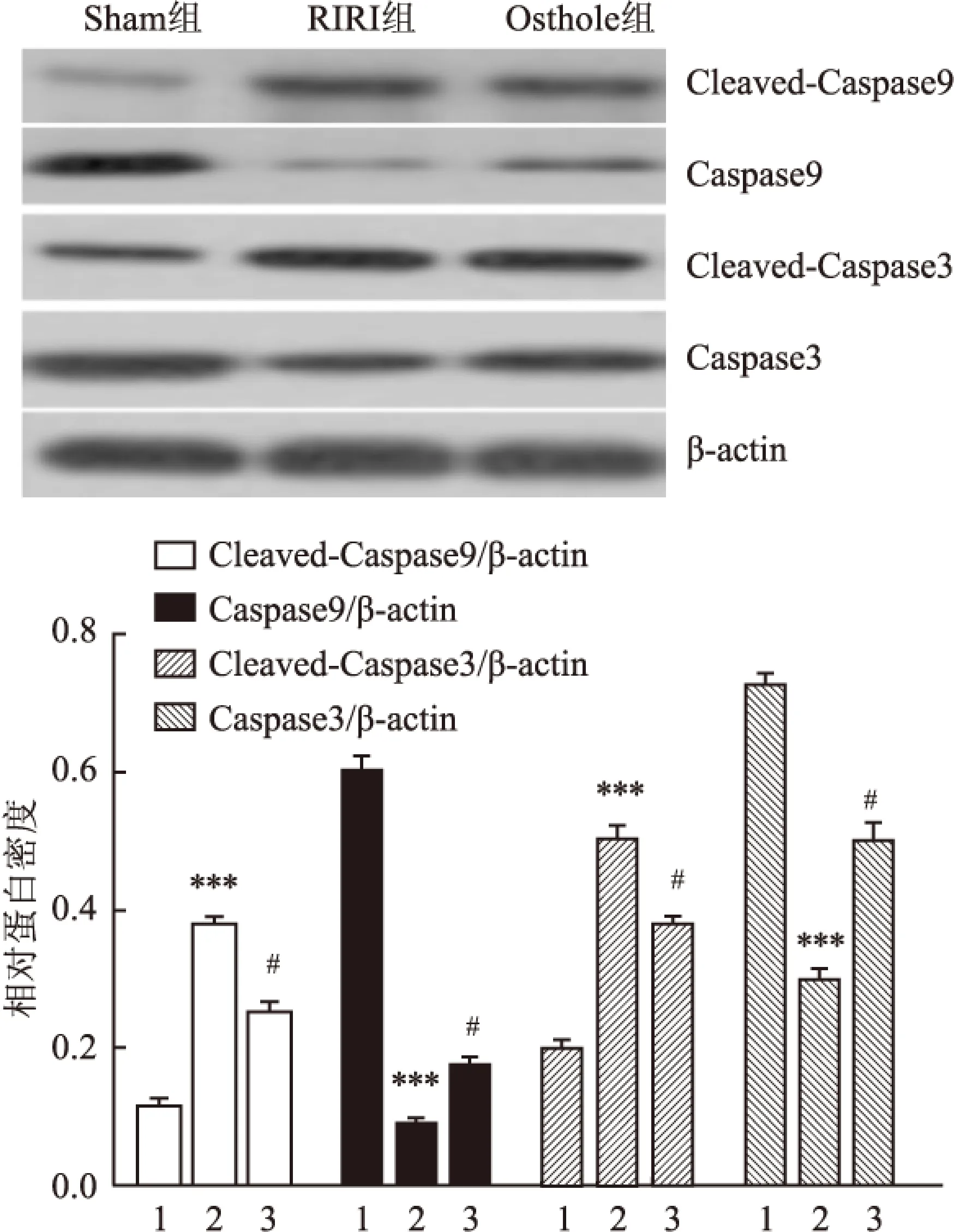
图5 Western blot 检测蛇床子素对Caspase9、Cleaved-Caspase9、Cleavaed-Caspase3和Caspase3 蛋白表达的影响
1:Sham组;2:RIRI组;3:Osthole组;与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
2.7蛇床子素对RIRI大鼠肾脏凋亡相关蛋白表达影响与Sham组相比,RIRI组BCL-2表达明显降低 (P<0.05),而Bax表达明显增高(P<0.05)。而Osthole组与RIRI组相比,BCL-2表达明显增高(P<0.05),而Bax表达明显降低(P<0.05), 见图6。提示蛇床子素可减少凋亡相关蛋白表达。
2.8蛇床子素对RIRI大鼠肾脏细胞质CytC表达影响与Sham组相比,RIRI组胞质中CytC表达水平明显增高(P<0.05); 而Osthole组与RIRI组相比,胞质中CytC表达水平明显降低(P<0.05),见图7。提示蛇床子素可减少细胞质CytC的表达。
1:Sham组;2:RIRI组;3:Osthole组;与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
2.9蛇床子素对RIRI大鼠肾脏凋亡细胞表达影响与Sham组相比,RIRI组TUNEL表达水平明显增高(P<0.05); 而Osthole组与RIRI组相比,TUNEL表达水平明显降低(P<0.05),见图8。提示蛇床子素可减少细胞凋亡。

图7 Western blot检测蛇床子素对细胞质 CytC蛋白表达的影响
与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
3 讨论
线粒体是胞内能量合成和储存的主要场所, 对缺血缺氧刺激特别敏感[ 8]。机体在正常生理状况下, 通过线粒体代谢途径消耗了90%以上的氧, 但其中2%的氧气未能完全还原, 而是与呼吸链底物端逸出的电子结合生成超氧阴离子等ROS。因此线粒体是胞内ROS生成的主要场所, 正常情况下,机体有完善的线粒体防御体系,体内ROS处于生成和清除的动态平衡中, 不损伤线粒体以及机体[8]。肾缺血时线粒体结构被破坏,有氧氧化受阻, 线粒体ATP产生不足, 恢复血液再灌注时血超氧化物阴离子等明显增强,导致ROS表达明显增多,超过了机体ROS的清除能力,过量的ROS损害线粒体的抗氧化应激以及自由基清除酶系统, 导致自由基大量产生, 形成恶性的循环,导致过量的ROS蓄积[9]。而过量的ROS可攻击线粒体,引起线粒体膜结构的改变,导致抗凋亡蛋白BCL-2表达的降低和促凋亡蛋白Bax表达的增加以及Bax/BCL-2比率的上调。而Bax/BCL-2比值的上调可促进Bax与维生素B8(腺嘌呤核苷酸)的转位酶相结合,导致ΔΨm的减少和线粒体膜通道孔(MPTP)的大量开放,进而引起CytC等多种细胞蛋白从线粒体迁徙入胞质。进入胞质的CytC与胞质中的凋亡诱导因子(AIF)结合可引起Caspase9的激活,而激活的Caspase9(Cleaved-Caspase9)可通过Caspase级联反应促进Caspase-3激活,激活的Caspase-3(Cleaved-Caspase3)可促进下游的DNA 依赖性蛋白激酶裂解,进而引发细胞凋亡[9-12]。在本研究中肾脏缺血45 min,再灌注24 h后Cr、BUN、Cleaved-Caspase3、Cleaved-Caspase9、Bax、ROS、线粒体胞质中AIF和CytC表达水平和肾组织病理改变以及TUNEL表达水平均明显增加,而Caspase3、Caspase9和BCL-2的表达水平以及线粒体膜电位和ATP酶的活性均明显减少。这与既往研究[9]结果相一致。

图8TUNEL检测蛇床子素对细胞凋亡的影响×200
A:Sham组;B:RIRI组;C:Osthole组;与Sham组比较:***P<0.001;与RIRI组比较:#P<0.05
药理学研究[5]发现蛇床子素可通过抑制线粒体途径减轻脑缺血再灌注损伤并具有清除ROS的作用。本实验选用蛇床子素(40 mg/kg)对RIRI及线粒体凋亡信号通路的影响。结果显示蛇床子素预处理可减轻血清Cr和BUN的表达,减少肾脏病理结构改变,进一步证实了蛇床子素对RIRI有保护作用。对其与线粒体凋亡信号通路的关系深入研究发现,蛇床子素预处理可减少Cleaved-Caspase9、Cleaved-Caspase3、Bax、ROS、TUNEL以及线粒体胞质中AIF和CytC的表达水平,但可明显增加Caspase3、Caspase9和BCL-2的表达水平,线粒体膜电位和ATP酶的活性。其作用机制可能为蛇床子素可通过减轻线粒体肿胀和结构的改变,促进线粒体有氧氧化代谢途径,增加ATP的生成和ROS的清除能力,从而减少Bax与维生素B8的结合,促进ΔΨm的升高和抑制MPTP开放,导致CytC迁徙和与AIF相结合的减少以及Caspase级联反应激活受阻,进而减少Caspase下游的DNA依赖性蛋白激酶的裂解,肾脏细胞凋亡乃至肾功能受损。
综上所述,蛇床子素可通过减轻RIRI后ROS介导的线粒体结构改变而减少线粒体内CytC 的释放,并抑制Caspase级联反应激活,减轻缺血再灌注损伤诱导的肾脏细胞凋亡,保护受损肾脏细胞,这可能是蛇床子素抗肾脏缺血再灌注脑损伤的机制之一。
