RGDC肽修饰的金纳米粒子协同光热疗法杀伤胰腺癌细胞的研究
2018-11-07杨席席韦瑞玲
任 乐,陈 军,杨席席,韦瑞玲,许 朝,余 跃
胰腺癌被认为是最致命的恶性肿瘤,5年生存率不足5%[1]。由于其早期症状隐匿且不典型,大多数患者在初次被确诊的时候已经到了中晚期,失去了手术治疗机会。临床上大多采用药物化疗(如吉西他滨)、放射治疗以及生物治疗等方法。但由于副作用多、靶向性差等弱点限制了这些方法的应用。光热疗法(photothermal therapy,PTT)在肿瘤治疗领域具有重要的应用价值。金纳米粒子(gold nanoparticles,AuNPs)由于其独特的性质被认为可以作为PTT 的理想材料[2]。研究[3]显示精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)在动物肿瘤实验中表现出良好的肿瘤靶向性。也有研究[4]报道富含半胱氨酸(cysteine)的酸性蛋白可增加胰腺癌对吉西他滨化疗敏感性。该研究旨在观察精氨酸-甘氨酸-天冬氨酸-半胱氨酸(Arg-Gly-Asp-Cys,RGDC)修饰的AuNPs协同PTT杀伤人原位胰腺癌细胞BxPC-3的效果,为AuNPs体内外抗胰腺癌提供新的方法参考。
1 材料与方法
1.1材料氯金酸、柠檬酸钠购自上海国药集团化学试剂有限公司;RGDC购自美国MedChemExpress公司;人胰腺癌细胞系BxPC-3细胞购自中科院上海细胞库;RPMI-1640购自美国Invitrogen公司;噻唑蓝(MTT)购自美国Sigma-Aldrich公司;钙黄绿素乙酰甲酯(calcein,AM)和溴乙非啶豪莫二聚体(ethidium homodimer-1)购自美国赛默飞世尔公司 。
1.2方法
1.2.1RGDC肽修饰的AuNPs(RGDC/AuNPs)制备 取50 ml 1 mmol/L的氯金酸在剧烈搅拌(1 000 r/min)条件下煮沸。随后迅速加入5 ml,38.8 mmol/L的柠檬酸钠,待颜色由浅黄变成紫红色,继续煮沸10 min,AuNPs制备完毕,冷却待用。取400 μl的上述AuNPs和400 μl RGDC(1 mmol/L)分散在5 ml的超纯水中,置于28 ℃的水浴锅中过夜,随后用超纯水6 000 r/min离心5 min去除多余的RGDC(重复3次),RGDC/AuNPs粒子制备完毕。
1.2.2细胞培养 使用RPMI-1640 培养液(含有10% PBS和1%的双抗),将BxPC-3细胞置于5% CO2细胞培养箱中37 ℃培养,贴壁达到80%~90%时,利用0.25%的胰酶消化传代。
1.2.3电感耦合等离子体质谱仪(inductively coupled plasma mass spectrometry, ICP-MS)检测RGDC肽修饰前后的金纳米粒子被细胞摄取的情况 待BxPC-3细胞孵育至对数期,用胰酶消化吹打重悬,种24孔板,每孔5×106个放置温箱培养24 h,用RPMI-1640培养液分别配置AuNPs粒子和RGDC/AuNPs粒子,浓度分别为5、10、20 μg/ml,将不做任何处理的细胞孔作为空白对照,将上述溶液分别加入孔板中,每组设置3个复孔,在37 ℃温箱中孵育24 h。之后吸出上清液,弃去含AuNPs 的培养基,PBS冲洗3遍,胰酶消化并计算细胞密度;1 500 r/min离心10 min;超声裂解细胞,高速离心20 min;吸出上清液,烘干,用王水溶解、超纯水定容,用 ICP-MS 测量AuNPs 含量。用测得的AuNPs含量除以总的细胞数量得到平均细胞摄取量。
1.2.4MTT法检测光照后各组对细胞的杀伤作用 收集对数期BxPC-3细胞,置37 ℃、5% CO2温箱孵育24 h,每孔加入10 μl不同纳米粒子组溶液,浓度分别为5、10、20 μg/ml,同时设置不含纳米粒子的对照孔,每组设定3复孔,继续培养24 h。洗掉孔板中培养液,加入新的培养液。分别用波长532 nm的光0.5 W/cm2的功率照射各组细胞5 min,在一次照射停止后,直至分散液的温度恢复到室温之后再重复照射,累计3次。光照结束后继续培养4 h,加入配好的MTT(1 mg/ml),继续温箱培养4 h,加入20% 十二烷基硫酸钠裂解液 (sodium dodecyl sulfate,SDS),高速震荡10 min,再用酶标仪(570 nm波长)检测各孔吸光度(optical density,OD)值。以如下公式计算细胞存活率(%)=(实验组OD值-调零组OD值)/(对照组OD值-调零组OD值)×100%。
1.2.5活死细胞染色法检测光照后各组对细胞的杀伤作用 进一步通过活死细胞染色直观地观察这种低功率光强下的MTT杀伤胰腺癌细胞的效果,种板方法同MTT检测,培养24 h后洗净原有培养液,加入新的完全培养液,实验分为3组,即不加AuNPs的空白对照组、10 μg/ml AuNPs组和10 μg/ml RGDC/AuNPs组,分别用波长532 nm的近红外光0.5 W/cm2的功率照射三组细胞5 min,继续放入温箱培养8 h,随后加入用PBS配置好的活死细胞染色液钙黄绿素乙酰甲酯(calcein,AM)2 μm/ml和溴乙非啶豪莫二聚体(ethidium homodimer-1,4 μm/ml),每孔100 μl,室温下孵育30 min,荧光显微镜拍照保存,最后用Image J统计各张图片中的死细胞及活细胞数。
2 结果
2.1纳米粒子的成功制备电镜视野下可观察到数个致密的球形形貌,平均粒径在45 nm左右。见图1。 RGDC/AuNPs粒子及单纯AuNPs粒子的紫外吸收峰值,RGDC/AuNPs粒子和AuNPs粒子吸收曲线存在明显不同,提示了RGDC/AuNPs粒子制备成功。见图2。

图1 透射电镜检测AuNPs粒子的颗粒大小及形貌

图2 RGDC四肽修饰前后AuNPs粒子紫外吸收变化
2.2细胞对RGDC修饰前后的金纳米粒子的摄取情况两组金纳米粒子(AuNPs组和RGDC/AuNPs组)分别在2.5、5、10、20 μg/ml的浓度下与BxPC-3细胞孵育24 h,随后利用ICP-MS检测细胞对不同浓度条件下两组纳米粒子的摄取含量。随着浓度梯度的增加,BxPC-3细胞对两组纳米粒子的摄取含量呈增长趋势。在不同浓度梯度下,RGDC/AuNPs组的摄取量均多于AuNPs组,差异有统计学意义(P<0.01)。见表1。
2.3光照前后各组对细胞的杀伤作用在未进行光照的情况下,各组中BxPC-3细胞的细胞存活率都
在80%以上,且组间存活率比较差异无统计学意义(P>0.05),见图3A。进一步采用波长为532 nm,功率密度为0.5 mW/cm2的激光照射两组细胞5 min,照射停止后,待分散液的温度恢复到室温之后再重复照射,累计3次,继续培养6 h后检测了各组的细胞数量。在3个不同浓度梯度下,RGDC/AuNPs组对胰腺癌细胞BxPC-3杀伤效果明显强于AuNPs组(P<0.01),表明RGDC/AuNPs粒子可能通过光热协同效应来抑制胰腺癌细胞BxPC-3,见图3B、表2。

表1 不同浓度的两组纳米粒子和胰腺癌细胞共同培养后对两组纳米粒子摄取的量的比较
2.4热疗法对各组细胞抑制的情况通过活死细胞染色进一步直观地观察光热疗法抑制细胞增长的效果。在活死细胞染色中,活细胞被标记为绿色,死细胞被标记为红色。选取激光波长为532 nm,功率密度为0.5 W/cm2,经过照射后发现未加入AuNPs的空白对照组基本无红色标记的死细胞出现,见图4A;10 μg/ml AuNPs组有少量死细胞,见图4B;而10 μg/ml RGDC/AuNPs组则从出现大面积的死细胞,见图4C。计数结果显示RGDC/AuNPs组对细胞的抑制率明显高于AuNPs组,差异有统计学意义(P<0.01)。见表3。
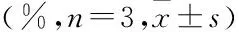
表2 光照下各组纳米粒子对胰腺癌细胞生长抑制率的影响
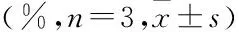
表3 活死细胞染色法检测各组对胰腺癌细胞生长抑制率的影响
与AuNPs组比较:**P<0.01
3 讨论
AuNPs具有独特的表面等离子体共振的特性及光热转换效率显著,在PTT抗肿瘤上被越来越多地研究[5]。由于AuNPs通过胞吞作用进入细胞较难,细胞摄取率较低,限制了其临床应用。如何通过对纳米粒子的表面修饰增加对特定肿瘤细胞的靶向性,从而更有效地杀灭肿瘤细胞仍然是一个巨大挑战。
整合素被认为在肿瘤发展中发挥着关键的作用,而RGD序列被认为是绝大多数整合素的特异性配体,可控制及介导细胞在生物材料上的粘附行为[6]。Han et al[7]研究发现对RGD肽一级序列后引入新的氨基酸可改变其对不同组织的亲和性。前期研究[8]显示胰腺癌细胞及其周围的基质分泌大量的已知的具有与紫杉醇疗效相关性的蛋白质,富含半胱氨酸。并且,该富含半胱氨酸的蛋白是一种分泌性细胞基质糖蛋白,是一个潜在的细胞周期抑制因子,在接近70%的胰腺癌患者中存在表达[9]。因此,本实验从如何对纳米粒子表面功能化,开发出针对性的增强胰腺癌细胞对纳米粒子的摄取等方面出发,制备了RGDC/AuNPs纳米粒子。由于通过金巯键和AuNPs之间的共价连接形成较强的耦合,纳米粒子的表面等离子体共振峰向近红外区域移动,从而使这种纳米平台可被有效的用于PTT中[10]。

图3 MTT法检测各组粒子光照或非光照对胰腺癌细胞BxPC-3细胞的杀伤作用
A:未光照的两组粒子对胰腺癌细胞BxPC-3细胞孵育6 h的毒性;B: 光照6 h后两组粒子对胰腺癌细胞BxPC-3细胞的杀伤作用;与AuNPs组比较:**P<0.01

图4 活死细胞染色法检测各组之间光照后对细胞的杀伤效果 ×200

图5 AuNPs和RGDC/AuNPs在光热条件下杀伤胰腺癌细胞的效果图
进一步观察RGDC/AuNPs较普通AuNPs的优势,ICP-MS定量检测直接证实了RGDC肽修饰的AuNPs被胰腺癌细胞摄取率显著提高,接近单纯金纳米粒子的2倍,其中的原因可能归结于RGDC肽对胰腺癌有主动的靶向性。另外,经过PTT照射后,RGDC/AuNPs颗粒能够显著增加光热效率,原因可能是经光照射后,巯金键断裂,更多的AuNPs和RGDC游离在细胞内,提高对细胞的损伤作用[11]。由于金巯键通常较为稳定,既可以减少纳米粒子的非靶向释放,同时这种化学键可与硫醇反应和(或)发生热裂[12]。Piao et al[13]通过将金纳米笼与细胞膜抗菌肽组成的协作纳米系统作为光热抗癌剂,在近红外光照射下,该纳米系统所产生的有效光热杀伤了癌细胞,这可能是由于通过由金纳米笼的光热启动细胞内的硫醇反应使得金巯键断裂进而释放抗菌肽,进一步起到膜损伤的作用。同时有研究[14]发现RGDC修饰的二氧化钛 (titanium dioxide, TiO2)在紫外辐射下对海拉细胞(HeLa)具有更高的杀伤效果。本研究结果显示RGDC/AuNPs组对细胞的抑制率明显高于AuNPs,这可能归因于RGDC四肽本身对胰腺癌细胞表面整合素的靶向性以及RGDC四肽富含半胱氨酸,其对AuNPs杀伤胰腺癌细胞也具有一定的协同作用。具体的模拟图见图5。
综上所述, 通过引入带有巯基的半胱氨酸形成RGDC的四肽,使得半胱氨酸引入的巯基直接通过金巯键修饰到RGDC/AuNPs表面,由于这种RGDC四肽修饰后的纳米粒子具有对胰腺癌细胞的靶向性,增加了胰腺癌细胞对这种纳米粒子的摄取率, 同时实现了RGDC/AuNPs在热响应性情况下可发生巯基断裂从而释放RGDC四肽,增加了胰腺癌细胞内富含半胱氨酸的RGDC四肽的游离浓度,增强胰腺癌细胞对吉西他滨化疗敏感性,进一步达到在光热治疗时对胰腺癌细胞的协同杀伤作用,为AuNPs体外抗胰腺癌提供新的方法参考。但RGDC/AuNPs在体内应用效果有待进一步研究。
