血清类黏蛋白的功能和临床意义
2018-11-05王志学侯晓丹金新源宋明明杨义力
王志学,侯晓丹,金新源,宋明明,刘 霞,杨义力
(1. 苏州市立医院北区烧伤整形科,江苏 苏州 215008;2. 中国医学科学院系统医学研究中心苏州系统医学研究所,江苏 苏州 215123;3. 第二军医大学药学院药理学教研室,上海 200433)
类黏蛋白(orosomucoid,ORM)是血清中含量较高的糖蛋白,又称α1-酸性糖蛋白,在人体内因糖基化程度不同而有约20种亚型。ORM对参与天然免疫和获得性免疫的多种细胞均有调节作用。炎症时ORM的升高伴随着其糖链末端果糖化的增加。在炎症的起始阶段,ORM的功能是促进炎症和免疫反应的发展;而在炎症的晚期,ORM促使炎症和免疫反应消退。因此,ORM的表达变化与疾病的发生、发展密切相关。另外,ORM也可调节神经、肌肉等细胞的功能,参与能量代谢和肌肉功能的调节。文章对近几年ORM的研究成果进行了综述,评价其作为临床检测指标的意义和必要性。
1 ORM的结构特征
ORM是一种主要由肝脏合成的糖化蛋白,等电点为2.8~3.8。因糖基化程度的不同,ORM的相对分子质量从37 000~54 000不等。正常人血浆ORM水平为0.6~1.2 mg/mL(占血浆蛋白的1%~3%)[1]。人类基因组中相邻的基因分别编码ORM1(占正常人血浆总ORM的75%)和ORM2。与ORM2不同,ORM1在人群中存在一定的多态性,ORM1*S和ORM1*F1基因携带者广泛存在于世界各地,而ORM*F2基因携带者在欧洲、北非和西亚较常见[2]。
在肝细胞内,首先合成为包含201个残基的ORM1前体,在切除含18个氨基酸的信号肽后,成熟的ORM1含183个残基,并形成分子内的2个二硫键。ORM2和ORM1仅有22个氨基酸不同。ORM1的多态性是由第32~46位之间的氨基酸变化导致的。晶体结构分析表明,未糖基化的ORM1含有1个典型的由8个β-折叠组成的脂质转运结构域,形成开口的疏水性分子结合区,可与多种分子结合;入口处的2个精氨酸残基和多个糖基化位点对与该区域结合的分子有重要的调节作用[3]。见图1。
人血浆分离的ORM1通常含有5个通过天冬酰胺 (Asn-15、Asn-38、Asn-54、Asn-75、Asn-85) 连接的异多糖链,组成的单糖包括甘露糖、半乳糖、果糖、葡萄糖等。这些糖链的组成及长度各不相同,且有不同分支,末端的单糖往往为唾液酸或神经氨酸。值得一提的是,ORM糖基化由多种不同的转移酶催化,人体内约有20种不同糖基化的ORM。有研究显示,炎症时ORM的升高伴随有糖链末端果糖化的增加[4],α1-3果糖化增多或许能作为胰腺癌的生物标志物[5]。
2 ORM的合成与调节
ORM主要在肝脏中合成,随后被释放进入血液以及关节液、黏膜液、胃液和胆汁液等其他体液中。ORM基因在肺、乳腺、肾和脂肪等组织中均持续表达,包括乳腺上皮细胞、肺泡Ⅱ型上皮细胞、血管内皮细胞、脂肪细胞和多种白细胞均表达ORM,但T细胞和B细胞似乎是例外。结直肠肿瘤、睾丸和肌肉组织也可在特定条件下产生ORM。这些肝外来源的ORM是否能影响血中ORM的水平还有待进一步研究。脂肪细胞分泌的ORM可能在局部发挥作用。另外,神经组织也可表达ORM1和ORM2,这可能是生理和病理情况下脑脊液中ORM水平变化的主要原因[6]。
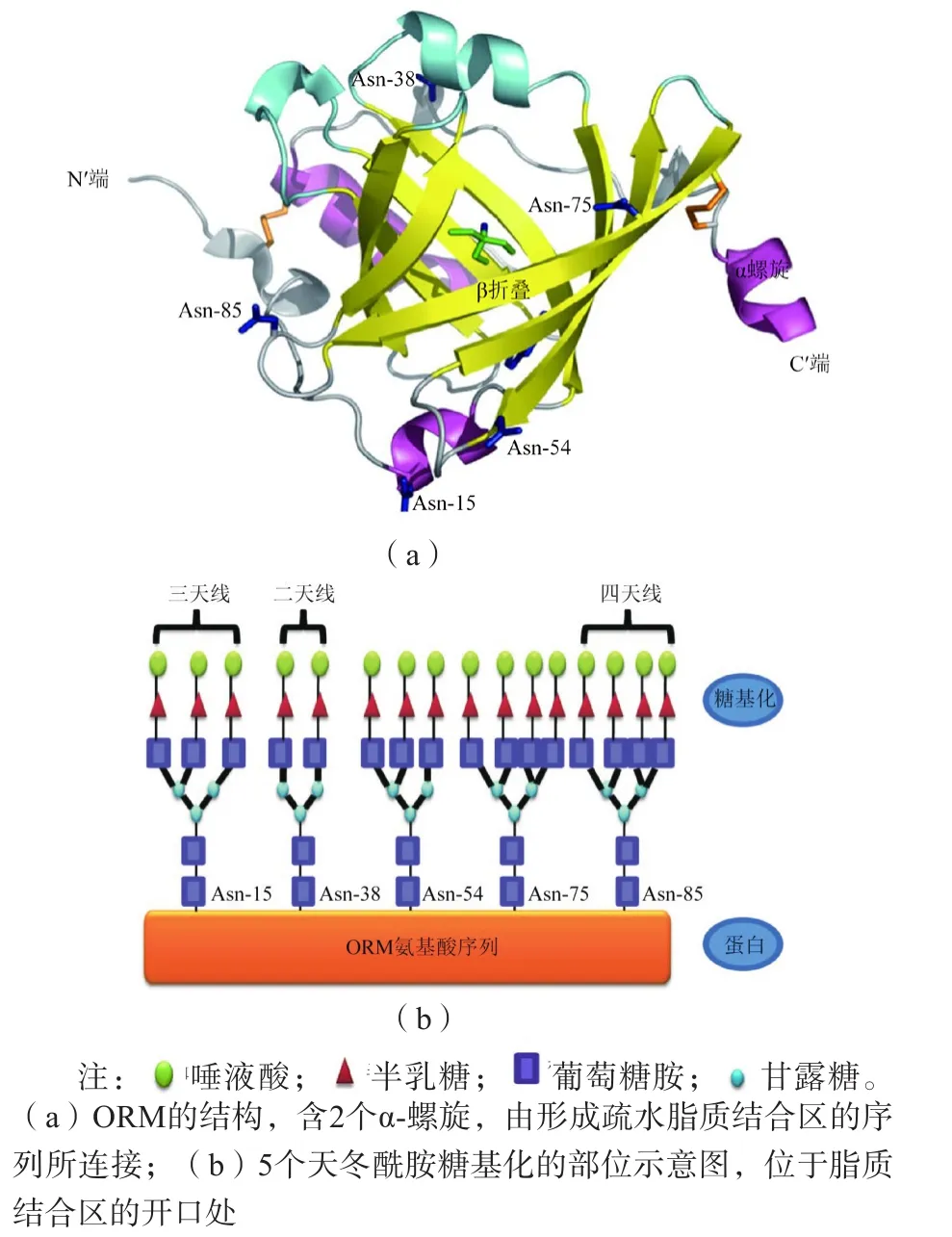
图1 ORM的结构和糖基化示意图[3]
许多应激性刺激,如创伤、细菌感染及其他炎症刺激均可导致血中ORM的水平显著上升。动物实验结果显示,ORM在应激刺激24 h后可升高10~200倍[7]。进一步研究证明,糖皮质激素及多种核受体激动剂、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6、IL-8和IL-11等均能调节肝细胞中ORM基因的表达,小分子药物如鲁米那、利福平、儿茶酚胺、β阻断剂等也能使血中ORM水平升高[1]。CAI等[8]分析了ORM基因的调节序列,发现IL-1和IL-6的作用是由启动子的远端调节序列介导的,而糖皮质激素的反应序列则位于近转录起始点。有研究结果显示,维甲酸能通过维甲酸受体α(retinoic acid receptor alpha,RARα)和维甲酸X受体(retinoid X receptor,RXR)调节ORM转录,维生素D和胆汁酸则通过维生素D受体(vitamin D receptor,VDR)和法尼酯X受体(farnesoid X receptor,FXR)发挥调节ORM的作用;在ORM基因的上游可发现相应的核受体的反应序列[6,8-9]。在其他参与ORM调节的转录因子中,核因子κB(nuclear factor-kappa B,NF-κB)可能是炎性细胞因子调节ORM作用的主要介导者,而CCAAT增强子结合蛋白β(CCAAT-enhancer-binding protein beta,C/EBPβ)的结合位点则与糖皮质激素的反应序列部分重叠。有趣的是,大环内酯类抗菌药物,尤其是克拉霉素能够增加肝脏ORM基因转录,使血中ORM水平升高,但这一作用在很大程度上是由糖皮质激素反应成分介导的[10]。
3 ORM的生物活性和生理功能
3.1 血中小分子的重要转运蛋白
在人血液中,白蛋白是酸性药物的主要载体。而由于低等电点和含脂质转运结构,ORM可和众多的小分子药物及内源性分子结合,包括伊马替尼、氯丙嗪、他莫西芬、心得安等碱性药物,甾体激素和麻醉药物等脂溶性分子以及若干蛋白酶抑制剂。与ORM的结合影响了这些分子的有效血药浓度,改变了这些药物的代谢动力学特征,也影响了药物通过血脑屏障和肾小球过滤。值得考虑的其他因素还包括:(1)ORM的水平在应激情况下可能升高10倍以上;(2)ORM和药物的结合不但是可饱和的,而且能被其他药物置换;(3)和膜的结合影响了ORM的结构,使其与碱性分子和甾体分子的结合降低;(4)药物对ORM1和ORM2有一定的选择性,如华法令、伊马替尼等药物优先结合ORM1,而美沙酮、达舒平等则对ORM2有选择性。因血中ORM1的水平至少是ORM2的3倍,所以临床在使用这些药物时应充分考虑该因素[11]。
3.2 机体炎症和免疫的自稳调节
ORM对参与天然免疫和获得性免疫的多种细胞均有调节作用。ORM对炎症和免疫细胞有抑制作用,表现为:抑制中性粒细胞的吞噬能力、迁移、趋化和对血管内皮细胞的黏附,并减少超氧歧化物的产生;抑制单核细胞产生促炎症因子TNF-α和IL-6;抑制T淋巴细胞的增殖和IL-2产生;诱导白细胞产生IL-1受体拮抗分子。但在不同的实验条件下,ORM也可以产生促进炎症的作用,表现为促进白细胞释放TNF-α、IL-1、IL-6及IL-12[6,12];并且IL-1和TNF-α又能增加ORM的产生,因而可能形成一个正反馈的环路[13]。虽然这些不同活性的分子机制尚不清楚,但很可能是ORM在维持机体自稳中作用的体现。在炎症的起始阶段,ORM的功能是促进炎症和免疫反应的发展,而在炎症的晚期,ORM可促使炎症和免疫反应消退。与此一致的是,高表达ORM的转基因小鼠对急性结肠炎高度敏感,与正常小鼠相比,局部髓过氧化酶、炎症评分和细菌浓度均显著升高,血清IL-6和淀粉样P成分水平亦升高[14]。此外,ORM的双重作用也与其主要调节物质——糖皮质激素对炎症和免疫反应的效应类似,因此ORM在糖皮质激素效应中的作用值得进一步探讨。
ORM对维持肠系膜、肌肉、脑和肾小球等许多组织和器官毛细血管的通透性有重要作用[15]。在药物诱导的肾小球受损模型中,ORM能恢复足细胞的形态,增加肾小球滤过率,减少蛋白尿。动物实验结果显示,外源性的ORM可以增强脑血管内皮和血脑屏障的完整性[15]。这些作用的机制尚不清楚,很可能与ORM对内皮细胞的直接相互作用、对毛细血管表面电荷的改变以及拮抗炎性介质的作用有关。由此可以推测,以上效应也是ORM抗炎和自稳作用的重要机制之一。
3.3 与细胞受体的相互作用
ORM糖基化的多糖中含有唾液酸化的路易斯抗原,能与中性粒细胞表面的选择蛋白结合,诱导细胞内的Ca2+增加。这一效应能被特异性抗多糖或选择蛋白抗体阻断,用神经氨酸酶改变多糖则可大大降低ORM的效应作用,说明这种选择蛋白是ORM的受体。此外,选择蛋白也是巨噬细胞表面介导ORM抑制作用的受体[16]。参与肝脏清除ORM的受体包括肝细胞膜上的血红蛋白β链和无唾液酸糖蛋白受体,分别能识别ORM的蛋白和多糖成分[2,17]。
有研究结果显示,细胞因子受体——CC趋化因子受体5(C-C chemokine receptor type 5,CCR5)介导了ORM对单核/巨噬细胞、肌肉细胞的作用,ORM的蛋白和多糖部分均参与了和CCR5的相互作用[17]。ORM与肌肉细胞的CCR5结合后,通过一磷酸腺苷(adenosine monophosphate,AMP)激活的蛋白激酶增强糖原储存和肌肉耐力[18]。此外,低水平ORM能刺激促甲状腺素受体,增加细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP),释放甲状腺素,但高水平ORM可抑制促甲状腺激素的信号传导[19]。虽然这种差异的分子机制尚不清楚,但与ORM参与机体内环境稳定的功能相一致。
ORM的多样性功能还表现在对脂质代谢、蛋白质质量控制和能量平衡调节方面。ORM能和鞘脂类合成限速酶——丝氨酸软脂酰转移酶结合,从而减少鞘磷脂的合成[20]。ORM缺少会导致细胞的内质网应激,诱导细胞的未折叠蛋白质反应。ORM的这些功能与其磷酸化密切相关。ORM与下丘脑的瘦素受体结合,可激活酪氨酸激酶(Janus kinase,JAK)信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路,进而调节机体的能量平衡。而ORM缺失则会导致动物体重和脂肪增加[21]。
总之,ORM不但能调节机体的炎症和免疫反应,也可与多种不同的细胞表面受体以及细胞内的蛋白结合,影响多种细胞的糖、脂肪和蛋白质的合成、代谢和质量控制,调节机体的能量和物质平衡,进而在多个层次上参与维持机体内环境的稳定[22]。
4 检测ORM的临床意义
作为机体主要的急性时相反应蛋白之一,各种组织损伤均可导致细胞及血中ORM显著升高。怀孕、药物和感染,尤其是人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染可以使ORM水平升高[23]。因此,许多研究探讨了测定组织、体液,尤其是血液中的ORM水平与疾病发生、发展的关系。目前,大部分研究采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测ORM水平。不同的研究结果显示,ORM可作为阻塞性睡眠呼吸暂停的诊断标志物[24],是炎性肠病诊断和治疗的生物标志物[25],能够帮助发现亚临床的炎症和维生素及微量元素缺乏[26]。还有研究结果显示,虽然在肠癌发生的过程中ORM的变化不明显,但一旦发生肝转移,血中ORM水平就会显著升高[27]。值得关注的是,血中ORM、白蛋白、柠檬酸盐水平以及极低密度脂蛋白颗粒大小是预测心血管疾病、癌症和非血管性疾病人群5年生存率的有效指标[28]。由此推测,ORM的有效性与其受炎性细胞因子、应激激素的调节密切相关。
人体的急性时相反应蛋白还包括C反应蛋白(C-reactive protein,CRP)、补体、纤维蛋白原、淀粉样蛋白A等,这些蛋白与机体的炎症及免疫反应、凝血功能等密切相关,是机体防御反应的组成部分,见图2。在临床上,作为急性时相反应的一个极灵敏的指标,CRP水平在急性心肌梗死、创伤、感染、炎症、外科手术、肿瘤浸润时迅速升高,24~48 h达到高峰。结合临床病史,CRP也有助于风湿病、系统性红斑狼疮、白血病等的随访。值得注意的是,由于CRP在血中的半衰期仅为5~7 h,因此CRP水平往往不能反映炎症和疾病,尤其是慢性炎性疾病的持续、进展和消退情况[29]。目前,临床一般采用红细胞沉降率监测炎症和疾病的进程,但其敏感性和便捷性远不如免疫测定。由图3可见,在炎症的进程中,ORM水平升高较慢,但在炎症的多个阶段均持续增高。因此,同时检测CRP和ORM能更好地监测病情,了解疾病的发生、发展阶段,指导治疗。降钙素原(procalcitonin,PCT)是用于诊断和监测细菌感染的项目,适用于检出早期炎症,既可定性也可定量,具有快速、敏感的特点。ORM作为炎症持续和发展的指标,能监控炎症的发展进程,适用于长期监测。有研究结果显示,测定血中ORM水平能鉴别诊断系统性炎症反应和败血症,也能够了解败血症的严重及预后[30]。
越来越多的研究表明,无症状的炎症也存在于其他疾病过程中,在糖尿病、肥胖和微量元素缺乏等情况下,ORM水平均可明显升高。动物实验结果显示,ORM有抗疲劳作用[18]。在慢性疲劳综合征患者中,虽然血中糖皮质激素、IL-1和IL-6无明显变化,但ORM水平明显升高[18]。因此,测定ORM可能为发现、治疗相关疾病提供新的线索。新的更敏感、更精确的ORM检测方法也将为更大规模的临床研究和验证奠定基础。
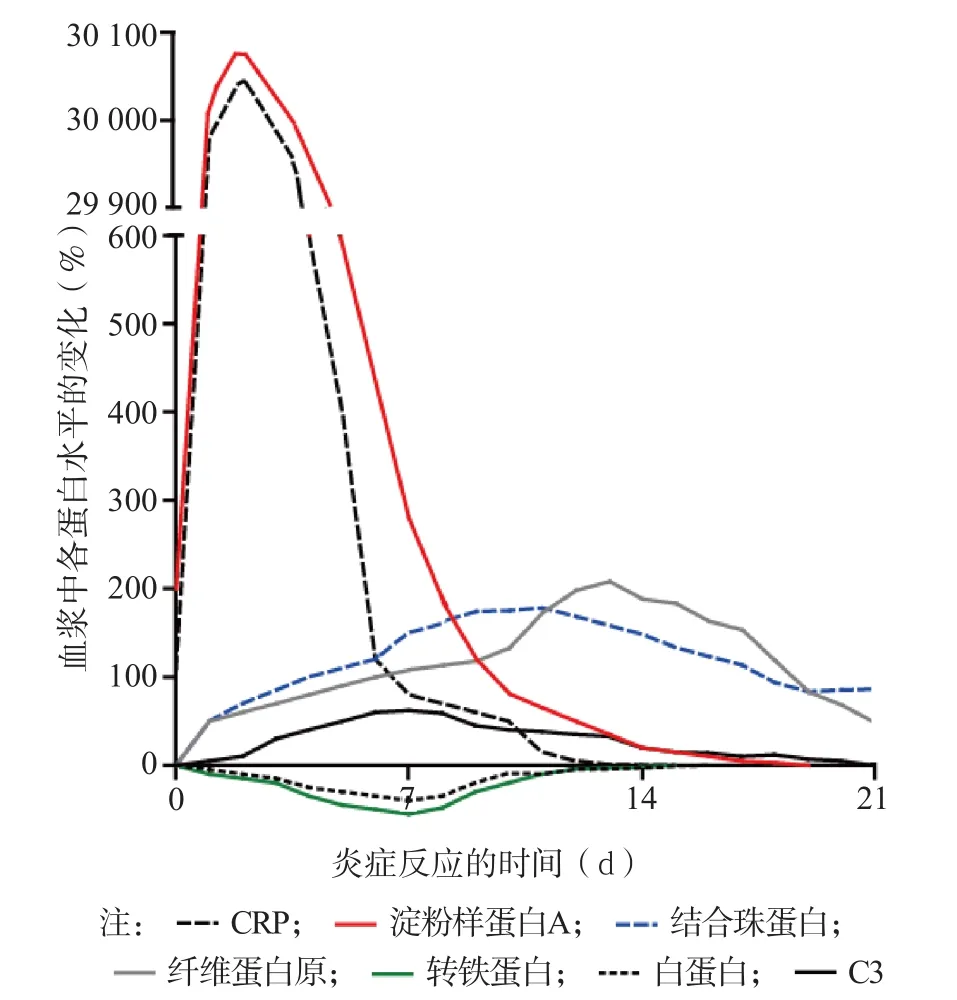
图2 血中急性时相反应蛋白水平的变化[23]
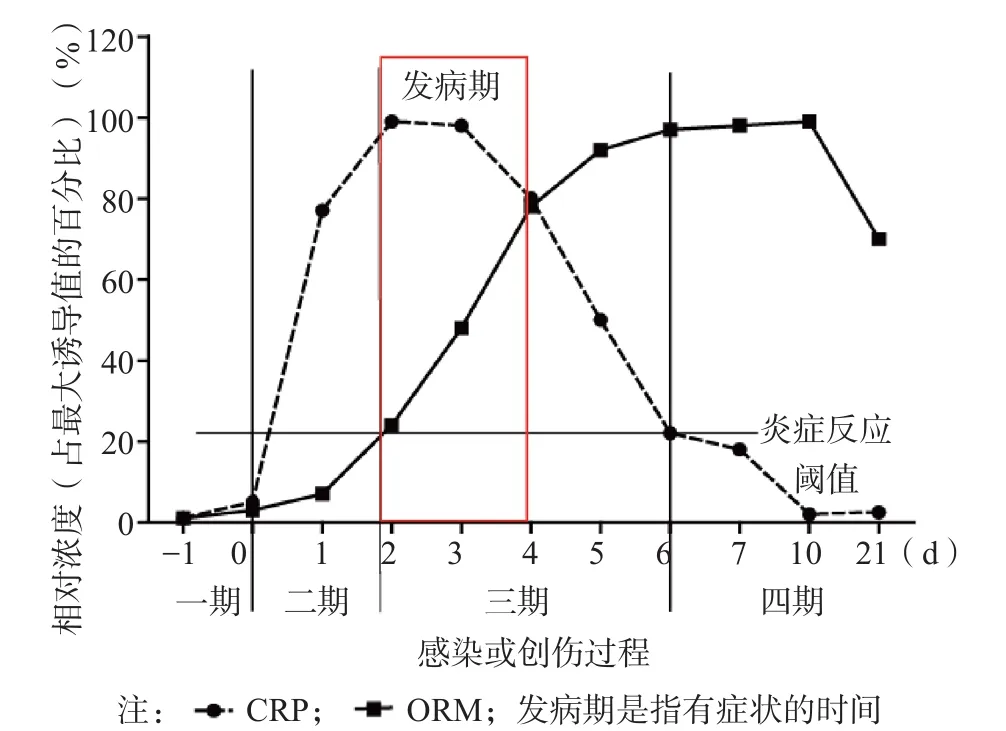
图3 感染或创伤过程中CRP和ORM的变化示意图
