羊骨髓肽-钙螯合物对诱导分化的破骨细胞形成和吸收的影响
2018-11-02陈静姚薇韩克光郑明学古少鹏张鼎田文霞霍乃蕊
陈静,姚薇,韩克光*,郑明学,古少鹏,张鼎,田文霞,霍乃蕊*
(1. 山西农业大学动物科技学院,山西 太谷 030801; 2. 山西农业大学食品与工程学院,山西 太谷 030801)
骨质疏松(osteoporosis,OP)是一种常见的全身性骨代谢病[1],正常的骨代谢过程中,骨吸收和骨形成处于动态平衡。研究表明OP发生时,OC过度形成和活化,骨吸收活性异常增加,导致骨流失加快,骨量减少,骨质劣变[2-3]。因此抑制OC形成及其骨吸收活性是OP防治的一个重要策略。钙制剂在OP防治中的作用,已被大量研究证实[4]。作为第四代钙制剂,肽钙螯合物溶解性和解离性好,生物利用度高,且其中的肽可促进钙离子的转运和吸收[5]。
课题组前期研究结果已证实了羊骨髓肽(sheep bone marrow polypeptides,MP)及其钙螯合物(MP-Ca)对去卵巢大鼠骨质疏松的防治效果[6]。本研究将以RAW264.7为破骨前体细胞,建立OC的RANKL诱导体系,研究MP和MP-Ca对OC诱导形成和活性的影响,并将二者的效果进行比较,揭示其抑制OP发生的机制,为OP防治药物研发奠定理论基础。
1 材料与方法
1.1 试剂与仪器
MP由内蒙古锡林郭勒盟肽好生物制品有限责任公司生产、分离和纯化,以干基计,蛋白含量为96%。小鼠单核巨噬细胞系RAW264.7和RPMI 1640不完全培养基购自南京凯基生物科技发展有限公司。完全培养基在不完全培养基中补充10%的胎牛血清(浙江);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒、TRAP酶活性检测试剂盒和BCA蛋白浓度测定试剂盒均购自南京建成科技有限公司;MTT试剂盒与Triton X-100为Solarbio产品;RANKL和0.25%胰蛋白酶-EDTA消化液分别为美国Peprotech和Sigma产品;茚三酮试剂。
JEOL JEM-6490LV扫描电子显微镜(日本电子光学实验室,日本);6孔和24孔细胞培养板(Corning,美国);Olympus CX21倒置相差显微镜;MC721酶联免疫检测仪(上海箐华科技仪器有限公司)。
1.2 MP-Ca的制备与鉴定
以MP和CaCl2为原料,按照实验室优化的螯合工艺制备MP-Ca冻干粉[7-8]。对MP-Ca鉴定时,先对其进行纯化,除去样品中的游离的氨基酸和肽,具体操作为:在MP-Ca溶液中加5~8滴茚三酮试剂,加热至沸腾,若溶液变为蓝紫色,说明样品中仍有游离的氨基酸或小肽,需要继续对样品进行醇沉纯化,直至加入茚三酮试剂不再变色。溶解纯化后的MP-Ca样品,加入过量的硫化钠,振荡摇匀,放置一段时间,若有硫化钙沉淀生成,说明钙离子来自于肽钙螯合物,过滤掉沉淀,滤液中加入茚三酮试剂,如果颜色变为蓝紫色,说明溶液中的肽来自肽钙螯合物。
取适量MP和MP-Ca样品送至山西农业大学实验中心,进行扫描电镜分析。
1.3 破骨细胞诱导体系的建立
RAW264.7细胞用完全培养基于37℃,5% CO2培养箱中培养48 h,换液培养。待细胞贴壁达到瓶底面积70% ~80%时,以0.25%胰蛋白酶-EDTA消化,收集消化液,1000 r/min离心5 min,细胞用完全培养基重悬后传代。
取对数期的RAW264.7细胞用含RANKL(终浓度为50 ng/mL)的完全培养基制成浓度为104个/mL的细胞悬液。在6孔培养板小孔中预置无菌盖玻片(1 cm × 1 cm)和骨片(0.5 cm × 0.5 cm,厚20 μm),每孔加入1 mL上述细胞悬液,培养约4 h,待细胞贴壁后在小孔中补加含50 ng/mL RANKL的培养基,隔天换液,期间观察细胞形态。
于培养第3天开始,每24 h取出一枚盖玻片和骨片,盖玻片按TRAP染色试剂盒说明进行TRAP染色,骨片超声清洗后,梯度乙醇脱水,自然晾干,1%甲苯胺蓝室温染色3~4 min,蒸馏水洗。将盖玻片和骨片置光镜下观察,确定破骨细胞诱导形成的时间。
1.4 MTT法测定细胞生长曲线及受试物的最适干预浓度
96孔板上,RAW264.7细胞(104个/mL)的接种量为100 μL/孔,诱导组小孔中RANKL的终浓度为50 ng/mL,对照组小孔不加RANKL。每组8个平行,每个平行5个复孔,每天取一个平行进行测定,各孔按照MTT试剂盒说明进行操作,并测定OD490值,绘制细胞生长曲线,确定OD490峰值所对应的检测天数,并以此作为确定各受试物最适作用浓度时的检测时间。
按1.3建立诱导体系,以不同浓度的受试物干预RANKL诱导的RAW264.7细胞向OC分化的过程。MP,MP-Ca浓度分别为0,10,102,103,104,105μg/mL,17β-雌二醇(E2)浓度为0,1,10,102,103,104μg/mL,于培养第5天用MTT法进行检测,确定各受试物的最适作用浓度。
1.5 最适作用浓度下受试物对破骨前体细胞分化增殖的影响
按1.3建立诱导体系,以等体积最适作用浓度的MP,MP-Ca及E2干预RAW264.7的RANKL诱导分化的过程,同时设空白组,每组10个平行,每个平行5个复孔,每隔24 h进行MTT测定,记录OD490值并绘制各组细胞生长曲线。其中一个平行与骨磨片共培养,于第5天进行骨吸收陷窝计数,另取一个平行于第5天测定TRAP活性。
1.6 TRAP活性的测定
吸弃培养基,细胞用PBS洗涤两次,每孔加入200 μL 0.2% Triton X-100裂解细胞。取100 μL细胞裂解液,按TRAP酶活性检测试剂盒说明进行操作,测定OD405值。另取100 μL细胞裂解液按BCA蛋白浓度测定试剂盒进行操作并测定OD562值。按式(1)将OD562值换算成细胞裂解液总蛋白浓度,式中标准样品浓度为563 μg/mL。
定义在pH 4.8、37℃条件下,每分钟水解para-nitrophenyl phosphate(PNPP)显色底物产生1 μmol p-nitrophenol呈色物所需的酸性磷酸酶的量为一个酶活力单位(U)。以总蛋白浓度作对照,TRAP活性以TRAP比活力表示,按式(2)进行计算。

(1)
(2)
1.7 骨吸收陷窝的计数
骨片取出后,按1.3描述经1%甲苯胺蓝染色后,100倍光镜下计数整张骨片的吸收陷窝数。
1.8 统计学方法
数据采用SPSS 21.0统计软件和Sigma Plot 10.0软件处理,组间比较采用t检验,P< 0.05时认为差异显著。
2 结果分析
2.1 MP-Ca的鉴定
制备的MP-Ca经纯化后加入过量Na2S,生成了CaS沉淀和游离肽(显色反应呈阳性),说明钙离子和肽结合形成了螯合物。在扫描电镜下,MP与Ca2+螯合后,其疏松的片状结构表面增加了颗粒性物质,类似于盐的结构,这表明MP与钙离子发生了螯合,形成了羧酸盐和胺盐。(见图1)
2.2 破骨细胞鉴定
RAW264.7细胞加入RANKL培养24 h,光镜下可见部分细胞开始融合,培养72 h出现了具有典型OC形态的细胞,可观察到胞体较大,边缘不整齐,周围有刷状缘(褶皱),有伪足的细胞(图2-左),第5天观察时视野中基本都是此类细胞。第6天部分细胞胞体缩小,第7天细胞数目明显减少,细胞裂解。第3天检测时,共培养的盖玻片经TRAP染色可观察到胞浆内形成棕红色沉淀(图2-中);诱导培养至第5天,共培养的骨片经甲苯胺蓝染色可观察到清晰的吸收陷窝(图2-右)。
综上,破骨前体细胞RAW264.7培养4 h贴壁后,以50 ng/mL RANKL诱导培养96 h,分化形成具有典型细胞形态特征和骨吸收活性的成熟OC,所以第5天检测到的细胞为成熟的OC。
2.3 细胞生长曲线
由图3可以看出,第1天检测时,诱导组和对照组的OD490值大致相同,两组细胞都在第5天达到峰值,随后直接进入凋亡期。第2天检测时,对照组细胞直接进入对数期,而诱导组细胞的OD490值没有升高。对数期内诱导组每个检测点的OD490值均低于对照组。此结果与2.2中的形态学观察结果吻合,所以在确定各受试物的最适作用浓度时,选择第5天作为MTT法的检测点。

图1 MP(左)和MP-Ca(右)的扫描电镜图片(×2000)Figure 1 Scanning electron microscopic images of MP (left) and MP-Ca (right) (×2000)
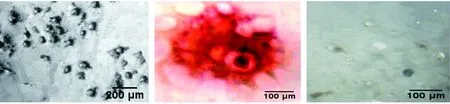
图2 RANKL诱导的RAW264.7细胞形态(左,×40)、TRAP染色结果(中,×100)及骨吸收陷窝(右,×100)Figure 2 Morphology (left, × 40), TRAP staining (middle, ×100) of RANKL-induced RAW264.7 cells, and pits formed in bone slice (right, ×100)
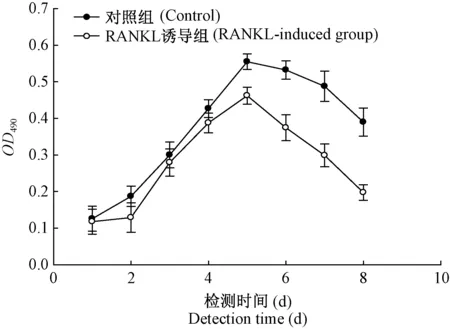
图3 经RANKL诱导和未经RANKL诱导的RAW264.7细胞生长曲线Figure 3 Growth curves of RANKL-induced and non-induced RAW264.7 cells
2.4 MP和MP-Ca对OC诱导形成的影响
以不同浓度的受试物干预诱导过程,于第5天进行检测,由图4可知,随着浓度的增加,MP、MP-Ca、E2组的OD490值总体呈下降趋势,达到最低值后,OD490值保持相对稳定,因此确定MP和MP-Ca的最适作用浓度为103μg/mL、17β-雌二醇为10 μg/mL。
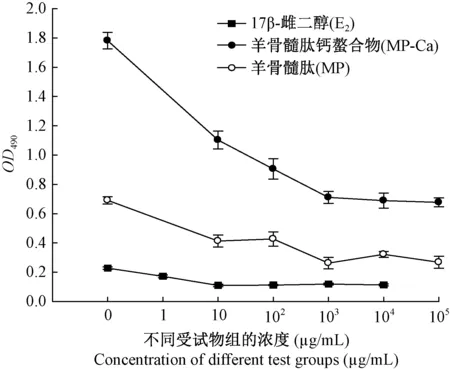
图4 各受试物的不同浓度对破骨细胞诱导形成的影响Figure 4 Effects of test substance concentration on the formation of RANKL-induced osteoclasts
在含等量RAW264.7细胞的诱导体系中添加最适作用浓度的受试物,MTT法测定并绘制细胞生长曲线,如图5(A~C)所示,E2、MP和MP-Ca干预组的OD490起始值相同,但在第2~8天OD490值均低于空白组,说明各受试物对破骨前体细胞的诱导分化和增殖均有抑制作用。由图5-D可知,各干预组第5天的OD490值均显著低于空白组,且MP-Ca组显著低于MP组,但显著高于E2组(P< 0.05)。
2.5 MP和MP-Ca对TRAP活性和骨吸收陷窝数的影响
图6中各干预组细胞裂解液中的TRAP活性均显著低于空白组(P< 0.05)。E2组TRAP活性最低,MP-Ca组显著低于MP组(P< 0.05)。各干预组的骨吸收陷窝形成数均显著低于空白组(P< 0.05),E2组陷窝数最少,MP组显著低于MP-Ca组(P< 0.05)。
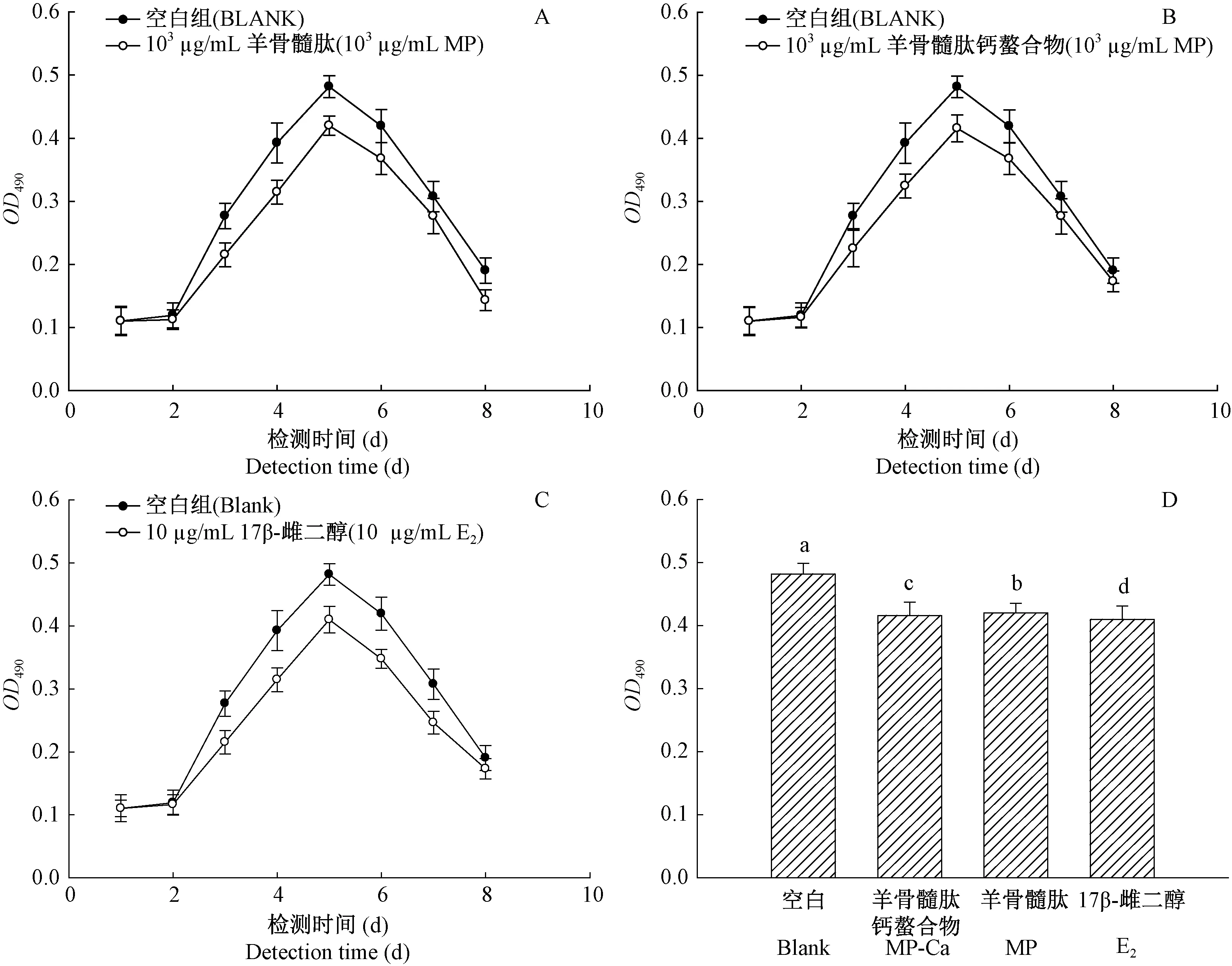
注:5-D中柱上方不同的字母表示各组之间差异有显著性(P< 0.05),图6与此相同。图5 MP、MP-Ca、E2干预组细胞的生长曲线(A~C)及第5天各组OD490值比较(D)Note. Different lower case letters above each column in 5-D indicate statistically significant differences (P< 0.05), The same as in Figure 6.Figure 5 Growth curves of MP-, MP-Ca-, and 17-β-estradiol-intervened RAW264.7 cells that were induced with RANKL (A-C) and comparisons of the OD490 of different groups on day 5 (D)
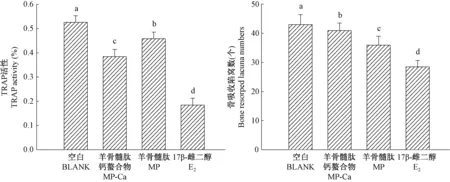
图6 MP、MP-Ca、E2干预组细胞的TRAP活性和骨吸收陷窝数比较Figure 6 Comparison of TRAP activity and lacuna numbers formed in the MP-, MP-Ca-, and 17-β-estradiol-intervened groups
3 讨论
肽与钙结合可形成稳定的肽钙螯合物[9]。茚三酮化学反应法和电镜观察结果均表明MP与Ca2+发生了螯合,证明MP-Ca制备成功。MP-Ca既可满足动物对氨基酸的需求,又可促进钙的吸收[10]。
目前抑制骨吸收的药物多为双磷酸盐类、激素类药物及中药等[11]。尽管许多研究证实了多肽钙制剂对大鼠骨质疏松症的防治效果[7,12],但有关其对骨吸收抑制作用的研究,报道较少[13]。
TRAP被认为是破骨前体细胞向OC分化过程中产生的标志性酶,其活性高低能反映OC的分化程度[14]。融合形成的多核巨细胞虽然呈TRAP阳性,但不具有骨吸收活性,只有最后真正成熟的OC方具有骨吸收活性[15]。本研究在第2天观察时个别细胞发生融合,第3天便可检测到TRAP活性,但处于此分化阶段的细胞没有骨吸收活性,第4天开始,具有刷状缘的成熟OC细胞数开始增多,第5天达到高峰并可检测到骨吸收陷窝。
MTT法是检测活细胞数目和细胞增殖情况的常用方法[16]。本研究表明最适浓度的受试物只减少破骨前体细胞分化过程中的活细胞数目,不改变生长曲线中峰值出现的时间,此结果与吴庆儒等[14]相同。本研究MTT法及TRAP活性检测结果表明,相同最适作用浓度时,MP-Ca对OC诱导形成的抑制作用强于MP。活跃的OC会分泌酸性物质和酶对矿化的骨基质进行分解吸收[17],骨吸收陷窝的数量、大小和深度能直接反应OC的骨吸收能力[18]。MP及MP-Ca均能显著减少骨吸收陷窝的数目,MP组陷窝数目显著少于MP-Ca组,但单一的数目变化不足以说明OC骨吸收活性的变化,并不表明MP组的骨吸收活性一定低于MP-Ca组,除骨吸收数目外,还应考虑吸收陷窝的面积和深度。
综上,在RAW264.7的RANKL诱导体系中,MP和MP-Ca均可抑制破骨前体细胞的增殖和分化,并抑制OC的骨吸收功能,并且MP-Ca对OC诱导形成的抑制作用强于MP,具体机制有待进一步研究。
