温补脾肾法对脾肾阳虚型UC大鼠结肠组织趋化因子信号通路的影响
2018-11-05殷银霞刘永华吴玉泓谢守嫔程小丽田一虹王园园李海龙
殷银霞,刘永华,吴玉泓,谢守嫔,程小丽,田一虹,王园园,李海龙
(1. 北京中医药大学深圳医院,广东 深圳 518116; 2. 甘肃中医药大学, 兰州 370000; 3. 甘肃中医药大学临床医学院, 兰州 730000; 4. 甘肃省中医方药挖掘与创新转化重点实验室,甘肃省中药药理与毒理学重点实验室, 兰州 730000; 5. 兰州市第一人民医院, 兰州 730000)
溃疡性结肠炎是以腹痛、腹泻、里急后重及黏液脓血样便为主的常见炎症性肠病。前期研究表明[1],理中汤合四神丸中药复方颗粒可抑制MyD88、IRAK1的表达,影响MyD88信号通路的传导, 达到治疗脾肾阳虚型UC的目的。在UC等炎症性肠病(inflammatory bowel disease,IBD)中,肠道屏障受损,肠上皮细胞(intestinal epithelial cells,IECs)表现出趋化因子的差异性表达[2-3]。有研究发现[4],在结肠炎结肠组织活检中的同一趋化因子组占总黏膜反应的主导地位,UC组的表达更为明显。因此,趋化因子在溃疡性结肠炎中起着重要作用。为进一步验证其在脾肾阳虚型UC发病机制中的调控作用,本实验基于第二代测序技术筛选脾肾阳虚型UC的差异表达基因,观察趋化因子信号通路(chemokine signaling pathway)中相关趋化因子的基因的表达变化情况,从中寻找温补脾肾法中药治疗溃疡性结肠炎的特异性靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级Wistar大鼠96只,雌雄各半,体重(170±20) g,由甘肃中医药大学实验动物中心提供【SCXK(甘)2015-0002】,饲养于实验中心SPF级环境内【SYXK(甘)2015-0005】。所有操作均符合实验动物伦理原则(伦理审批号:2015-079)。
1.1.2 药物、试剂
大黄水煎液(甘肃中医药大学附属医院中药房,批号20170306),氢化可的松注射液(国药集团容生制药有限公司,批号1406418-A11),三硝基苯磺酸(Sigma公司,批号SLBP08899 V),柳氮磺胺吡啶肠溶片(上海信谊制药公司,批号09141010),RNAiso PLUS 荧光定量试剂盒(美国Promega公司,批号0000231060),理中汤合四神丸复方颗粒(甘肃众友健康医药股份有限公司,批号20140721),4%多聚甲醛(北京Solarbio公司,批号20160315),逆转录试剂盒(美国Promega公司,批号0000232248),CXCL1基因上下游引物(批号:CHPN132-05/ CHPN132-06),CXCL2基因上下游引物(批号:CHPN132-07/ CHPN132-08),CXCL6基因上下游引物(批号:CHPN132-03/ CHPN132-04),CCL7基因上下游引物(批号:CHPN132-11/ CHPN132-12),CCL12基因上下游引物(批号:CHPN132-13/ CHPN132-14),CXCR2基因上下游引物(批号:CHPN132-01/ CHPN132-02),所有引物均由大连宝生物工程有限公司提供。
1.1.3 实验设备
电子天平(德国赛多利斯,CPA124S),台式高速冷冻离心机(凯达集团成员高科技公司,TGL16 M),实时荧光定量PCR(美国Bio-rad公司,CFX96),高速冷冻离心机(上海天美生化仪器设备工程公司,CT14RD)。
1.2 方法
1.2.1 动物实验
将96只Wistar大鼠雌雄各半分开按照随机数字表法分为空白组、模型组、高剂量组、中剂量组、低剂量组、SASP组雌雄各8只(造模成功后分组给药治疗模型组不给药)。本研究采用本课题组前期的研究成果所建立的脾肾阳虚型UC病证结合模型制备方法[5]复制脾肾阳虚型UC大鼠模型。造模成功后,第2天开始灌胃给药,1次/日,连续21 d。根据体型系数,大鼠给药剂量换算为成人剂量之10、5、2.5倍,即高、中、低剂量给药剂量分别为13.5,6.75,3.375 g/kg的生药剂量,SASP组为0.2 g/kg,空白组、模型组给予等体积生理盐水灌胃,体积为10 mL/kg。观察大鼠每天的精神、饮食、毛发色泽、大便性状等情况,记录各组大鼠体重,1次/周。模型组大鼠在造模14 d末、其他各组大鼠在用药21 d末,禁食24 h,用水合氯醛麻醉后,打开腹腔,剪取8 cm结肠组织,沿纵轴剪开,用预冷的生理盐水冲洗干净,置于滤纸上吸干水分,根据Strober等[6]提出的大鼠结肠黏膜损伤评分标准,观察各组大鼠黏膜组织的充血、水肿、溃烂程度进行评分。留取病变的结肠组织,一部分用4%多聚甲醛溶液固定,常规HE染色后制作病理切片,另一部分用冻存管保存于-80℃超低温冰箱,将用于后期检测。
1.2.2 病理切片的制备、观察
取出固定于4%多聚甲醛溶液中的病变结肠组织,石蜡包埋后制作病理切片,再进行HE染色。参照Geboes 等[7]提出的评分标准,在光学显微镜下对切片进行观察评分。
1.2.3 高通量测序
分别选取空白组大鼠结肠组织与模型组大鼠病变部位结肠组织进行高通量测序,高通量测序以及基因差异表达分析、差异表达基因GO富集分析和Pathway富集分析由上海伯豪生物技术有限公司完成。根据q-value0.05,Fold-change1.5的条件筛选差异基因。
1.2.4 Real Time-qPCR法检测差异表达基因
常规提取RNA,合成cDNA。各基因的上下游引物序列、产物长度如表 1。扩增反应:总体系为10 μL,预变性,PCR反应循环40次,溶解,每个样本重复4孔,PCR反应结束后分析熔解曲线,判断扩增产物是否有非特异性扩展;分析扩增曲线,得出CT值,按照相对定量法调用机器附带软件包计算相对表达量。
1.3 统计学方法
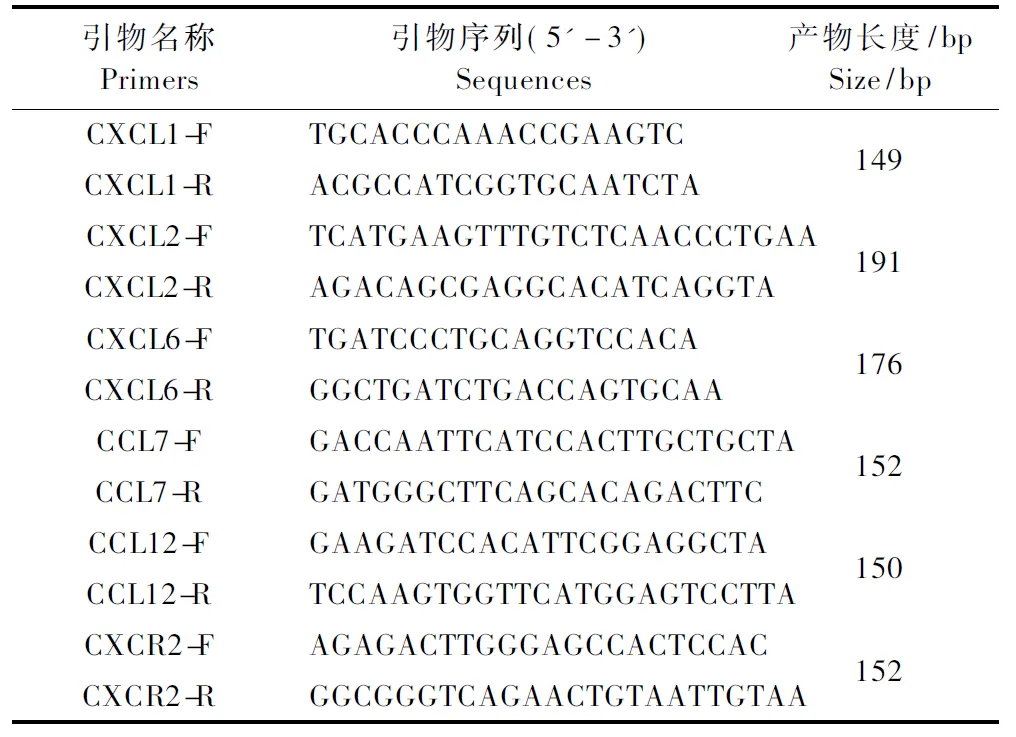
表 1 基因的引物序列Table 1 Primer sequences used for each gene
2 结果
2.1 一般生存情况
模型组大鼠普遍精神不佳、畏寒扎堆,进食量下降,毛发疏散、色泽枯槁,出现黏液、脓血大便,体重下降。空白组大鼠表现如常。各治疗组大鼠经治疗后普遍好转,精神转佳,反应灵活,活动增加,饮食增加,除个别大便偏软,其余基本成形,毛发出现光泽。(大鼠死亡情况:模型组3只,高剂量组2只,中剂量组1只,低剂量组1只,SASP组3只)。
2.2 大鼠结肠黏膜组织形态学变化
2.2.1 肉眼观察空白组与模型组大鼠结肠黏膜组织形态变化
模型组大鼠黏膜充血水肿、肠壁增厚,可见溃疡及糜烂。与正常的空白组大鼠结肠组织相比较,模型组大鼠结肠组织评分为(4.67±0.58),差异有显著性(P<0.05)。
2.2.2 光学显微镜下观察空白组与模型组大鼠结肠组织病理切片结果
模型组大鼠结肠组织可见黏膜层及黏膜下层有大量中性粒细胞和淋巴细胞浸润,肌层见胶原纤维与成纤维细胞形成的肉芽组织,部分上皮组织脱落、坏死。空白组大鼠结肠组织黏膜层组织完整,可见黏膜表面的单直管状腺体,基本未见炎症细胞浸润。见图1。
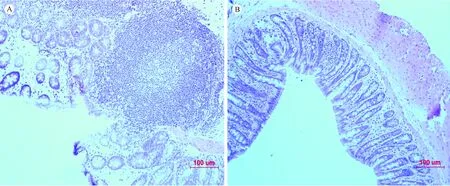
注:A) 模型组大鼠结肠组织病理切片结果;B) 空白组大鼠结肠组织病理切片结果。图1 病理切片结果Note. A) Rat model group. B) Rat blank group.Figure 1 pathological changes in the rat colon tissues
按照镜下大鼠结肠黏膜组织损伤评分标准进行评分,与空白组相比较,模型组大鼠评分为(13.67±0.58),差异具有显著性(P< 0.01)。
2.3 大鼠结肠组织样本总RNA质量控制
对送检的大鼠结肠组织样本进行检测发现,各样本RNA在18 s、28 s处见明显峰值(见图2),RIN(RNA完整系数)≥6.0且28 s/18 s≥0.7,说明RNA样本无真核或原核生物污染;无DNA或蛋白污染;无过多的5 s rRNA。质检结果类别为A1,符合电泳结果,总量达2次及以上,可进行后续实验。
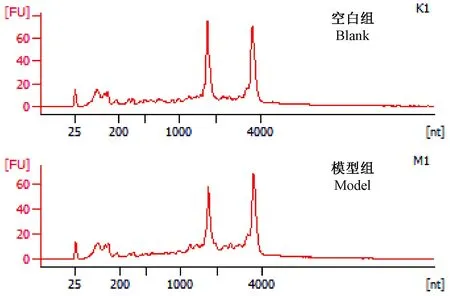
图2 RNA样本电泳图Figure 2 RNA electrophoregram
2.4 空白组大鼠与模型组大鼠相应结肠组织基因的差异性表达分析
根据高通量测序结果,与模型组大鼠相比较,根据q-value0.05,Fold-change1.5筛选出空白组大鼠差异表达的基因216个,其中下调166个和上调84个。相对于模型组大鼠,表达下调的基因明显多于表达上调的基因,表达下调的基因数目是表达上调的1.96(166/84)倍。两组之间的差异表达基因用火山图(见图 3),可以大致显示出差异表达基因上调、下调的数量情况以及所占全部基因的比率。
2.5 差异表达基因的GO分析结果
将筛选出来的差异表达基因进行生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)三个层次的统计分析,其中BP 3158个、CC 1863个、MF 695个,见图 4所示。
2.6 差异表达基因Pathway分析结果
Pathway分析结果显示,差异表达mRNA主要富集于细胞因子受体相互作用、吞噬小体、ECM-受体相互作用、TNF信号通路、细胞粘附分子、脂肪细胞因子信号通路、抗原加工提呈、PI3K-Akt信号通路、Jak-STAT信号通路、肿瘤转录调控失调、炎症性肠疾病、MAPK信号通路、细胞黏附、白细胞跨内皮迁移、错配修复、NF-κB信号通路、Toll样受体信号通路、Nod样受体信号通路等炎症相关通路,见表2。
2.7 大鼠结肠组织趋化因子mRNA的表达
RT-qPCR法检测结果显示:与空白组结肠组织比较,模型组中CXCL1、CXCL2、CXCR2、CXCL6、CCL7、CCL12基因表达量明显提高,差异有显著性(P< 0.01);与模型组结肠组织相比较,各治疗组中CXCL1、CXCL2、CXCR2、CXCL6、CCL7、CCL12基因表达量明显下降,差异有显著性(P< 0.01);与测序结果一致。(见表3)
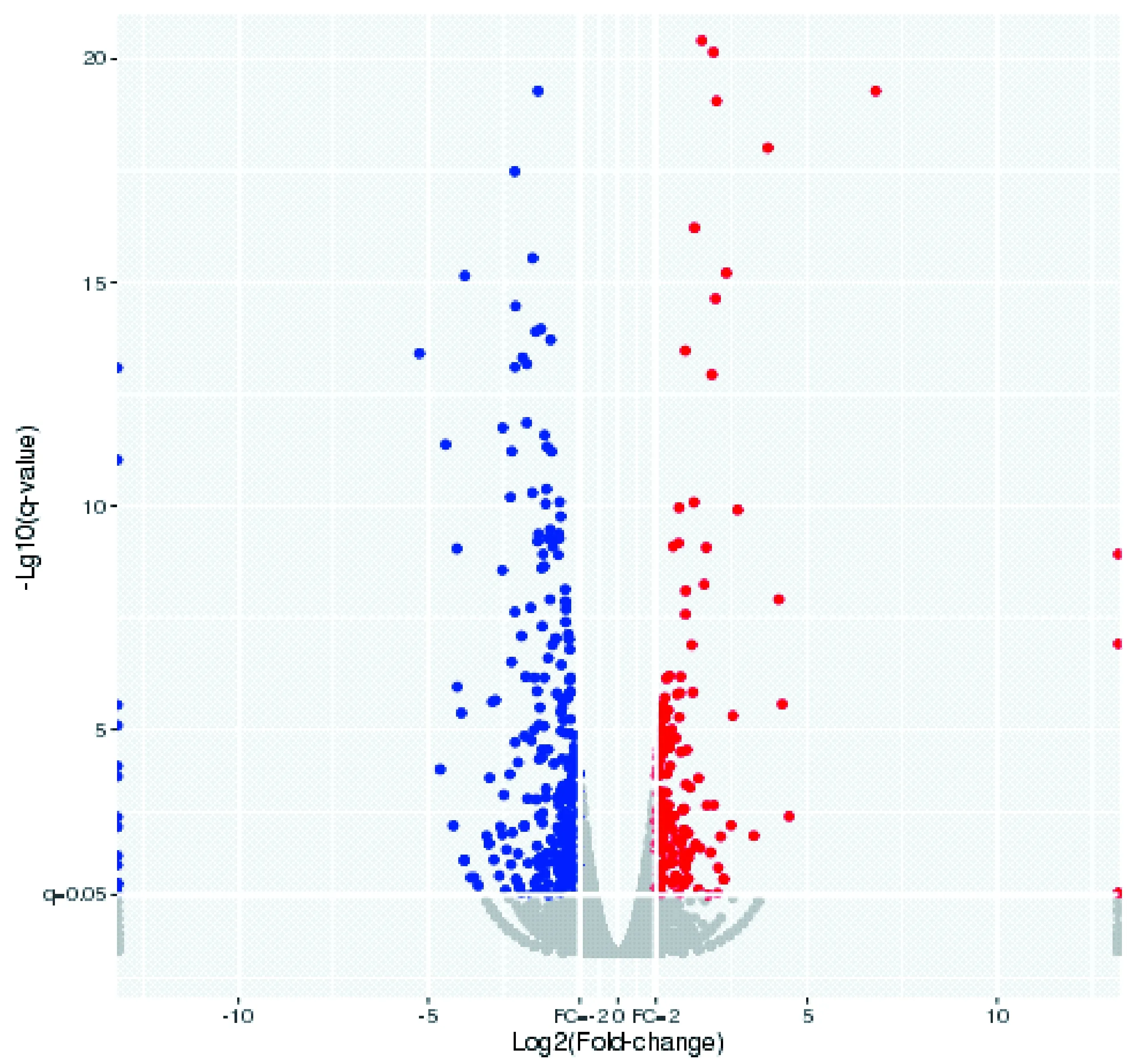
注:红色表示上调差异基因,蓝色表示下调差异基因。图3 空白组与模型组大鼠结肠组织基因的差异性表达分析Note. Red indicates upregulated genes, blue indicates downregulated genes.Figure 3 Differentially expressed genes
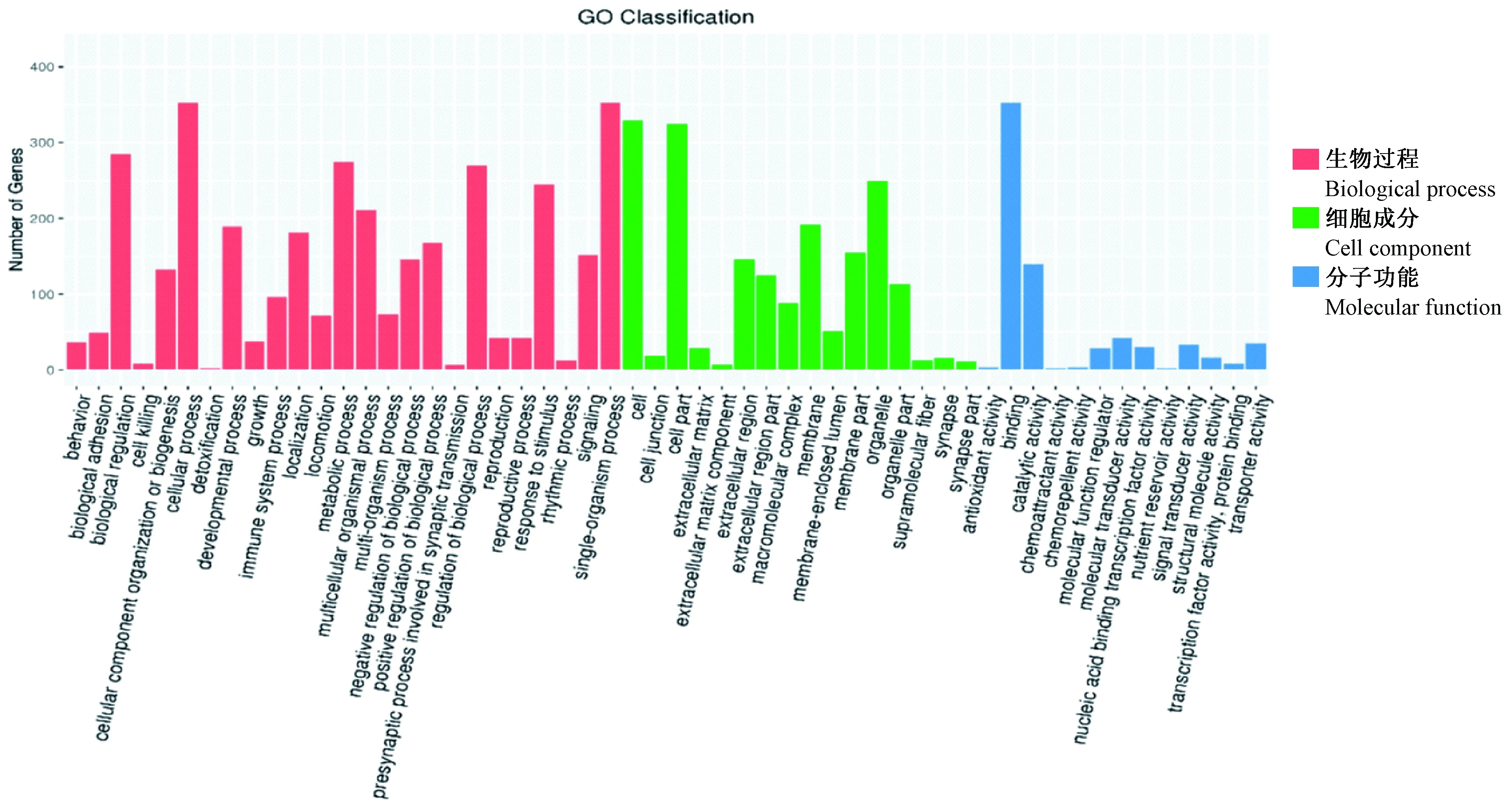
图4 差异表达基因的GO功能分类统计图Figure 4 Gene Ontology classifications of the differentially expressed genes
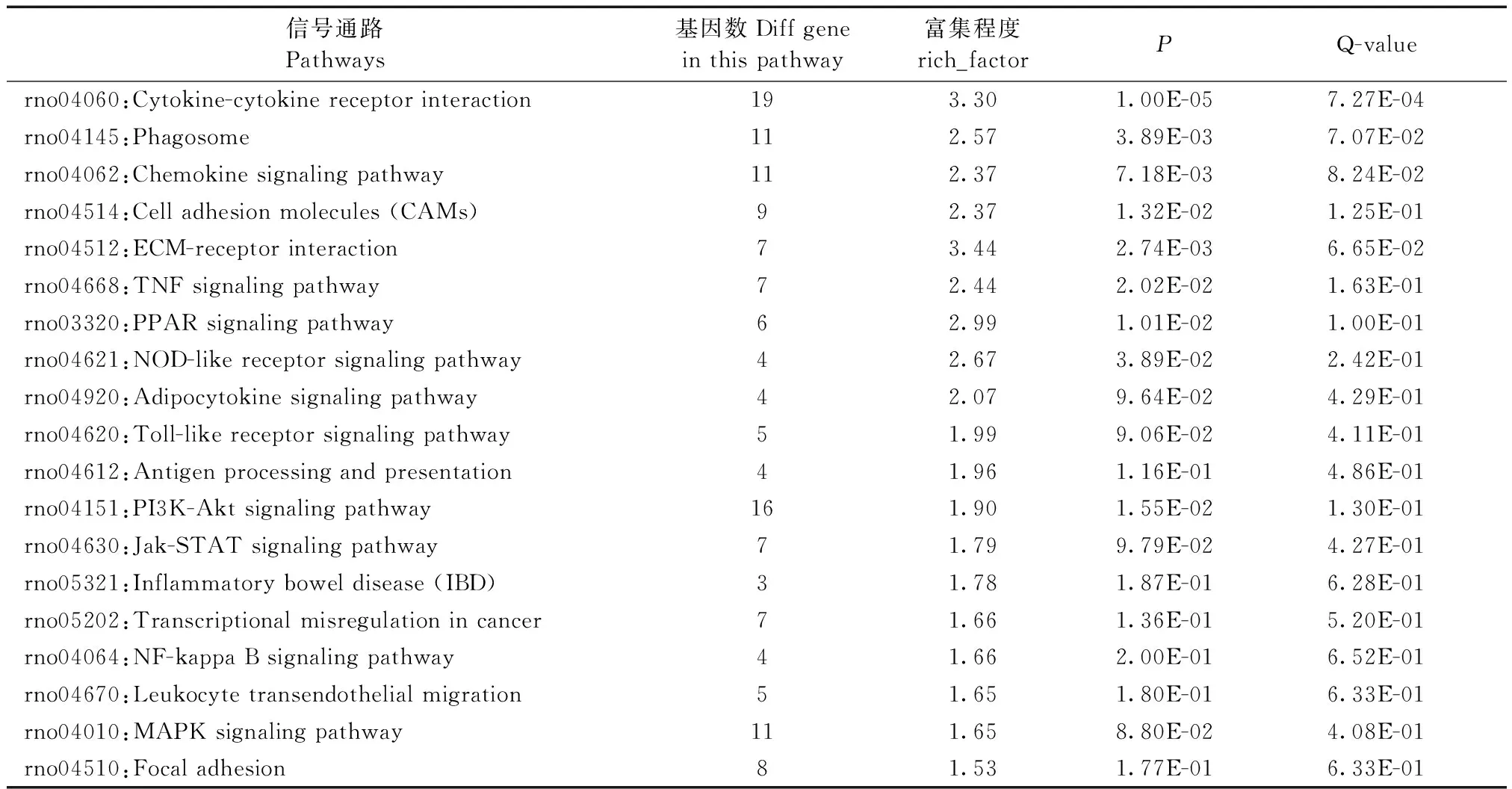
信号通路Pathways基因数Diff gene in this pathway富集程度rich_factorPQ-valuerno04060:Cytokine-cytokine receptor interaction193.30 1.00E-057.27E-04rno04145:Phagosome112.57 3.89E-037.07E-02rno04062:Chemokine signaling pathway112.37 7.18E-038.24E-02rno04514:Cell adhesion molecules (CAMs)92.37 1.32E-021.25E-01rno04512:ECM-receptor interaction73.44 2.74E-036.65E-02rno04668:TNF signaling pathway72.44 2.02E-021.63E-01rno03320:PPAR signaling pathway62.99 1.01E-021.00E-01rno04621:NOD-like receptor signaling pathway42.67 3.89E-022.42E-01rno04920:Adipocytokine signaling pathway42.07 9.64E-024.29E-01rno04620:Toll-like receptor signaling pathway51.99 9.06E-024.11E-01rno04612:Antigen processing and presentation41.96 1.16E-014.86E-01rno04151:PI3K-Akt signaling pathway161.90 1.55E-021.30E-01rno04630:Jak-STAT signaling pathway71.79 9.79E-024.27E-01rno05321:Inflammatory bowel disease (IBD)31.78 1.87E-016.28E-01rno05202:Transcriptional misregulation in cancer71.66 1.36E-015.20E-01rno04064:NF-kappa B signaling pathway41.66 2.00E-016.52E-01rno04670:Leukocyte transendothelial migration51.65 1.80E-016.33E-01rno04010:MAPK signaling pathway111.65 8.80E-024.08E-01rno04510:Focal adhesion81.53 1.77E-016.33E-01
表 3 各组大鼠结肠组织相关趋化因子mRNA相对表达量Table 3 Relative expression of s, n=4)
注:与模型组相比,△P< 0.01。
Note. Compared with the model group,△P< 0.01.
3 讨论
溃疡性结肠炎是发生于结肠黏膜组织的非特异性肠道炎症,其发病原因不明确。本研究应用第二代测序技术,通过比较空白组大鼠正常的结肠组织与模型组大鼠病变的结肠组织的基因表达差异,试图找到与溃疡性结肠炎发病机制相关的特异性基因,为中医药治疗UC的机制研究提供一定的理论依据。通过肉眼及电子显微镜下观察空白组大鼠与模型组大鼠的结肠黏膜组织,根据病理学实验结果分析,可以初步认为模型复制成功。
对差异基因进行GO和Pathway功能富集分析结果显示,涉及的差异表达基因多与组织的损伤密切相关,其中趋化因子信号通路与UC炎症活动增强有直接的关系。趋化因子由内皮细胞产生,靶细胞表达的同源性趋化因子受体与之结合后被激活,进一步对循环白细胞发出信号,使白细胞整合素对内皮细胞粘附分子的亲和力增加,促使白细胞在组织间隙中聚集[8-9]。趋化因子能够粘附在细胞表面的糖胺聚糖上,使局部病灶的趋化剂浓度升高[10]。上皮细胞表达的趋化因子受体与趋化因子结合,具有定向迁移白细胞和淋巴细胞以及搬运造血干细胞的典型生物特征[11-12],成为趋化因子信号通路的重要组成部分。
在本研究中脾肾阳虚型UC的大鼠组结肠织中仅发现了一种具有显著差异表达的趋化因子受体CXCR2,它是否就是脾肾阳虚型UC的特异性靶点,有待进一步验证。Buanne等[13]发现CXCR2基因敲除小鼠UC组织的炎症浸润明显减轻,临床症状亦明显减轻,证明CXCR2在结肠炎动物模型中起着关键的作用。CXCR2抑制剂可以防止多形核白细胞的再循环和相关组织损伤,并进行了二期临床试验[14],说明了CXCR2的高表达与组织的损伤具有明显的相关性。研究发现,在CXCR2基因敲除的小鼠中CXCL1、CXCL2不能被多形核白细胞迁移[15]。CXCL1、CXCL2、CXCL6等作为CXCR2的特异性配体,在正常的人体与小鼠结肠组织中正常表达,在UC患者的黏膜中高表达[13, 16]。大量研究[17]已证实了CXCL1趋化中性粒细胞的性质。而中性粒细胞是抵御感染的关键,CXCL1的表达能提高宿主防御和预防疾病的发生[18]。Shea-Donohue等[19]研究发现,CXCL1敲除小鼠的结肠炎症表现更严重,病理组织缺少中性粒细胞浸润。CXCL1的过度表达可能与UC的严重程度相关。沈守荣等[20-21]研究发现,CXCL1在UC小鼠模型多种细胞趋化因子水平中显著升高,并进一步应用CXCL1中和抗体治疗UC小鼠,有效缓解了UC的进展。
Han等[22]研究发现,CXCL2介导大鼠肠道炎症和损伤,通过阻断CXCL2可减少中性粒细胞浸润。Zahn等[23]研究表明,CXCL2可以作为检测UC黏膜炎症以及监测新药治疗效果的客观指标之一。Wuyts等[24]研究证明,CXCL6通过与CXCR2结合发挥作用,诱导白细胞趋化、促进血管新生成、免疫调节、抗菌等。在UC患者肠组织中发现,CXCL6选择性表达于溃疡性的黏膜缺损区内皮细胞中[25]。炎症部位的单核细胞主要由CCL7调控迁移,炎症发生时,CCL7呈现高表达[26-27]。在IBD患者身上,CCL7等趋化因子主要参与巨噬细胞、嗜酸性粒细胞和中性粒细胞的募集[28]。Uguccioni等[29]研究证明,CCL7在正常对照组与UC组结肠组织标本中均有表达,但在UC中表达明显上调。在慢性炎症中,巨噬细胞分泌的CCL12表达上调,阻止修复性成纤维细胞的激活,延长炎症反应而不利于组织愈合[30],这一特点可能是UC病程反复发作、迁延不愈的原因之一。
综上所述,在脾肾阳虚型UC中,以上趋化因子的表达具有一定特异性,同时也提示着疾病的发生发展过程是多种因子相互作用的结果。本研究得到了脾肾阳虚型UC差异表达的趋化因子基因序列,并应用RT-qPCR检测差异表达的趋化因子,检测结果与测序结果一致,说明本次测序结果可靠,进一步证明了该脾肾阳虚型UC大鼠病证结合模型具有可行性、合理性及科学性。CXCL2、CXCL1、CXCR2、CCL12、CXCL6、CCL7等因子在脾肾阳虚型UC结肠组织中表达明显上调,且经中西药治疗后,各治疗组CXCL1、CXCL2、CXCR2、CXCL6、CCL7、CCL12基因表达量均显著下降。所以,本研究发现的这一系列趋化因子的差异性表达应可作为脾肾阳虚型UC的特异性靶点,并作为治疗效果及预后判断的指标。但是在脾肾阳虚型UC的发病过程中,这一系列趋化因子之间具体的相互作用及影响还不完全清楚,它们的差异表达是否完全体现出脾肾阳虚证的发病规律,仍有待进一步研究与验证。
