Anti-miR34c树状纳米颗粒对裸鼠肝纤维化的治疗作用
2018-11-02张欢欢方杰俞文英杨扬余陈欢应华忠
张欢欢,方杰,俞文英,杨扬,余陈欢,应华忠
(浙江省医学科学院浙江省实验动物中心,浙江省实验动物与安全性研究重点实验室, 杭州 310013)
肝纤维化表现为肝内细胞间基质(ECM)蛋白过度表达和胶原沉积,是肝对各种因子刺激导致的慢性炎症进行异常修复的结果,如不及时治疗则会转变为不可逆的肝硬化,甚至发展为肝癌[1]。肝星状细胞(HSC)向成纤维样细胞转化,并合成细胞外基质蛋白,即肝星状细胞活化,是肝纤维化的“中心事件”。抑制HSC活化、增殖或者促进HSC凋亡能够逆转肝纤维化[2]。
MicroRNAs (miRNAs)是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,其大小约20~25个核苷酸,通过转录后调控靶基因表达参与多种疾病的发生发展[3]。某些miRNAs参与调控肝纤维化及肝癌[4],其中miR34c 在活化的HSC中表达上调[5],并通过靶向肝星状细胞乙酰辅酶A合成酶长链家族成员(ACSL1)和过氧化物酶体增殖因子活化受体γ(PPARγ)基因参与肝纤维化[6-7]。miR34c表达上调与肝纤维化程度成正相关,下调其表达水平可能阻止或逆转肝纤维化发展。
树状大分子材料(dendrimer)为高度分支结构,具有很好的几何对称性和大量的表面官能团,并可通过端基改性来获得更多的功能性基团[8]。5代聚酰胺-胺(PAMAM)树状大分子携带正电荷,能够有效吸附带负电荷的microRNA并维持较好的3D构造,是理想的基因靶向治疗转染载体[9]。本研究应用四氯化碳诱导裸鼠肝纤维化模型,报道PAMAM包裹的anti-miR34c纳米颗粒能否达到逆转肝纤维化的效果。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雄性裸鼠15只,体重(20±2)g,购自上海西普尔-必凯实验动物有限公司【SCXK(沪)2013 - 0016】,饲养于浙江省医学科学院实验动物中心【SYXK(浙)2014 - 0008】。专用标准饲料、水喂养,所有操作均符合实验动物伦理学要求【伦理审批号:(2015)动伦审研第(06)号】。
1.1.2 药品与试剂
Anti-miR34c由广州锐博合成;PAMAM Dendrimer G5-NH2购自威海晨源分子新材料有限公司;四氯化碳和甲醛购自国药集团化学试剂有限公司;TGF-β和α-SAM抗体购自Abcam;血清AST、ALT、HA、ColIV、LN的ELISA试剂盒购自武汉博士德生物公司。
1.1.3 主要设备与仪器
马尔文纳米粒度电位仪,Zetasizer Nano ZS,英国;徕卡冰冻切片机, CM 1900,德国;徕卡荧光显微镜,DM2500,德国;MD多功能酶标仪,SpectraMax M4,美国。
1.2 方法
1.2.1 靶向miR34c树状纳米颗粒制备
anti-miR34c和PAMEM均用TE溶解,按照载体与DNA电荷比(N/P比)加入一定量的PAMAM,室温温育 20 min 后得到两者的自组装复合物。复合物中anti-miR34c终浓度为500 nmol/L,N/P比分别为5/1、15/1、20/1。马尔文纳米粒度电位仪测定纳米粒径、电位等。
1.2.2 动物模型建立、分组与给药
清洁级(20±2)g 雄性裸鼠,随机分为正常组、模型组、anti-miR34c树状纳米颗粒治疗组(治疗组),每组5只。模型组和治疗组每周二、五注射20%四氯化碳100 μL,连续6周,正常组注射100 μL生理盐水。治疗组从第3周开始尾静脉注射200 μL anti-miR34c树状纳米颗粒,每周2次,在腹腔注射四氯化碳之前给药。
1.2.3 血清生化指标检测
体积分数3%戊巴比妥钠溶液麻醉裸鼠后,打开腹腔取主动脉血,离心分离血清,采用ELISA试剂盒检测AST、ALT、HA、ColIV、LN等指标。
1.2.4 肝组织病理观察
打开腹腔迅速取下肝组织并用4℃预冷的生理盐水反复洗净,滤纸吸干表面水迹,称湿重,按照肝组织湿重(g)/体重(g)×100%计算肝指数(g/g)。各组裸鼠取相同部位肝组织,10%中性甲醛固定,常规石蜡包埋,切片厚4~5 μm,进行HE染色和masson染色,观察肝组织病理和胶原沉积情况。
1.2.5 免疫组化检测肝组织TGF-β和α-SAM表达
肝组织常规石蜡包埋与切片,高温去蜡脱水,3% H2O2孵育25 min,灭活内源性酶,滴加正常山羊血清,室温孵育20 min。滴加TGF-β/α-SAM抗体(1∶200), 4℃过夜,滴加生物素标记的二抗,37℃孵育30 min,滴加SABC,37℃孵育20 min,DAB显色,苏木素复染,二甲苯透明,树胶封片,显微镜下观察TGF-β/α-SAM表达情况。
1.3 统计学分析
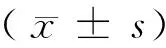
2 结果
2.1 Anti-miR34c树状纳米颗粒的制备
如表1 所示,anti-miR34c终浓度为500 nmol/L时,电位为正电荷,表明anti-miR34c电荷被完全中和,与PAMAM形成稳定复合物。N/P比为5/1粒径较为稳定,集中在650~720 nm之间,而N/P比越大,粒径大小越不稳定。聚合物分散指数(PDI,polymer dispersion index)越小,表面系统分散得越好,团聚的倾向越小。PDI小于0.2的树状纳米颗粒较为稳定,用于裸鼠肝纤维化治疗。

表1 不同氮磷比(N/P)anti-miR34c树状纳米颗粒粒径和zeta电位测定Table 1 Particle size and zeta potential of anti-miR34c and polyamidoamine complexes at different nitrogen/phosphorus(N/P) ratios
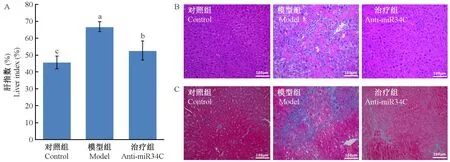
注:A. 肝指数,a/b/c表示各组数据P< 0.05。B. HE染色结果。C. masson染色结果。图1 anti-miR34c树状纳米颗粒对肝纤维化裸鼠肝组织病理的影响Note. (A) Liver index, significant differences between the groups a/b/c (P< 0.05). (B) HE staining. (C) Masson staining.Figure 1 Effects of anti-miR34c polyamidoamine nanoparticles on hepatic pathology in hepatic fibrosis of nude mice
2.2 Anti-miR34c树状纳米颗粒对肝纤维化裸鼠肝组织病理的影响
如图1A所示,正常对照组肝指数为(45±3.72)%,模型组升高到(66±2.90)%,差异有显著性(P< 0.05),而anti-miR34c树状纳米颗粒治疗组为(52±5.66)%,与模型组比较肝指数降低,差异有显著性(P< 0.05)。HE染色结果显示(图1B),正常对照组细胞排列均匀,无细胞间隙,也无炎症浸润,而模型组肝组织有明显的纤维包裹和脂质堆积,大量炎症细胞浸润,anti-miR34c治疗后肝组织与正常组相近,细胞排列整齐,无纤维索,无脂质堆积,masson染色结果(图1C)也显示治疗组胶原沉积明显减少,说明anti-miR34c能够有效改善裸鼠肝纤维化。
2.3 Anti-miR34c树状纳米颗粒对肝纤维化裸鼠血清生化指标的影响
如表2所示,模型组血清ALT和AST含量分别是对照组的3.6倍和10倍,差异有显著性(P< 0.05),表明模型组肝损伤严重。血清HA、ColIV和LN水平也比对照组分别提高了120%、24%和61%,差异有显著性(P< 0.05),说明模型组胶原沉积明显,纤维化水平较高。与模型组相比,anti-miR34c树状纳米颗粒治疗组血清AST、ALT、ColIV水平分别下调了61%、91%、19%,几乎达到正常对照组含量,差异有显著性(P< 0.05),HA和LN也分别下调14%和3%,但差异无显著性。
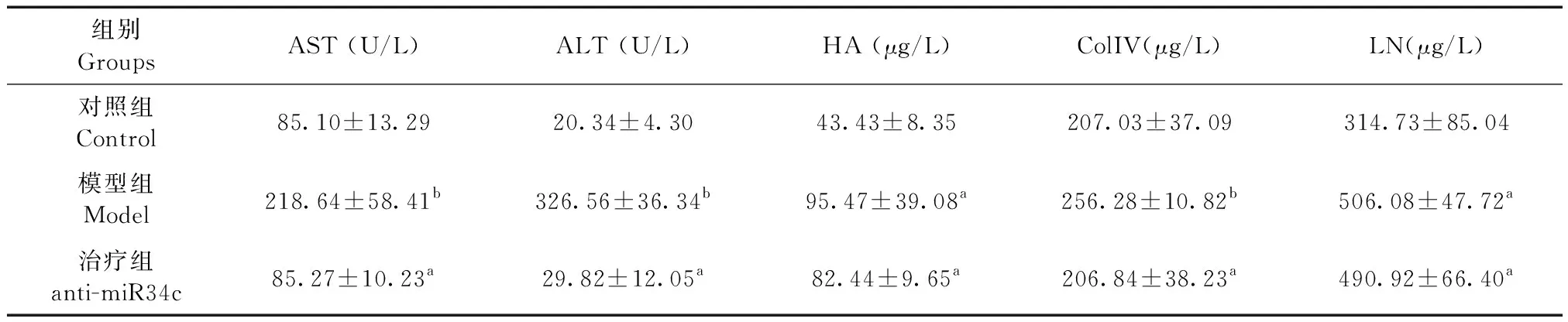
表2 anti-miR34c树状纳米颗粒对血清生化指标的影响Table 2 Effects of anti-miR34c PAMAM nanoparticles on serum biochemical marker levels
注:血清生化指标,a/bP< 0.05。
Note. serum biochemical markers,a/bP< 0.05。
2.4 Anti-miR34c树状纳米颗粒对肝纤维化裸鼠肝组织TGF-β和α-SAM表达的影响
TGF-β是促进肝星状细胞活化并使之转化为成纤维状细胞的重要因子,肝组织免疫组化结果表明,与正常对照组相比,TGF-β在模型组的表达量显著升高,而在靶向miR34c树状纳米颗粒治疗组又比模型组明显降低。α-SAM主要表达于成纤维细胞样细胞中,是HSC活化的特征性蛋白,在正常对照组肝组织中表达很低,但是在纤维化模型组的纤维状病理损伤处大量表达,而在无明显纤维状损伤的治疗组中表达量下降(如图2)。
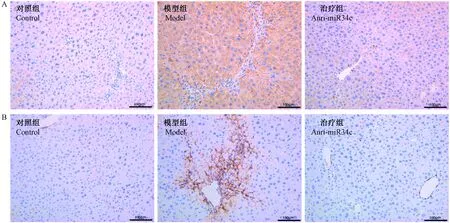
注:A. 各组裸鼠肝组织TGF-β免疫组化结果;B. 各组裸鼠肝组织α-SAM免疫组化结果。图2 anti-miR34c树状纳米颗粒对肝纤维化裸鼠肝组织TGF-β和α-SAM表达的影响Note. Immunohistochemistry for (A) TGF-β and (B) α-SAM in the liver.Figure 2 Effects of anti-miR34c PAMAM nanoparticles on liver transforming growth factor -β(TGF-β)/α-smooth muscle cell actin (α-SMA) levels
3 讨论
MiR34家族成员调节参与细胞周期、凋亡、分化和发育的多种基因表达[10],其在多种肿瘤疾病中表达下调,被认为是抑癌因子[11]。但在多种肝疾病中miR34却表达上调,包括非酒精性脂肪肝、肝纤维化、肝癌等[12]。研究证实miR34可以靶向ACLS1蛋白参与HSC脂质代谢和细胞存活[6],进而促进肝纤维化发展。其中miR34c也可以通过靶向调节PPARγ表达活化HSC[7]。因此,miR34c是治疗肝纤维化的潜在靶点。本研究给予肝纤维化裸鼠模型anti-miR34c树状纳米颗粒,有效减少了肝组织纤维样疤痕、减轻了胶原沉积,血清肝损伤生化指标ALT和AST以及胞外基质蛋白HA、ColIV和LN含量均下降,说明anti-miR34c树状纳米颗粒明显改善了裸鼠肝纤维化病理状态。
TGF-β是目前公认最重要的致纤维化细胞因子[13],不仅能促进HSC的增殖及肝纤维化相关胶原的分泌,还可促进肝内各种细胞合成和分泌 TGF-β、EGF 等促纤维化细胞因子,进一步激活 HSC,促进ECM分泌[14]。α-SAM则是成纤维样细胞的标志蛋白,可以反映HSC活化。本研究肝组织TGF-β和α-SAM免疫组化结果显示,anti-miR34c树状纳米颗粒降低了肝组织TGF-β表达并抑制HSCs活化,逆转了四氯化碳造成的肝纤维化。
MicroRNAs带较强的负电荷并具有亲水性,很难进入细胞内,且在血管内很容易降解[15],因此安全高效的输送载体尤为重要。PAMAM树状大分子是一类高度支化的单分散大分子,具有明显的分子结构特点[16]:(1)核心区;(2)向外延伸的树状分支;(3)表面携带大量的功能基团。5代PAMAM携带的正电荷能够与microRNA的负电荷相吸,使其稳定吸附于材料上。3D球面构型能够很好的保护microRNA在细胞内免受降解[9],缓慢释放microRNA在靶细胞内长期作用。Ren等采用PAMAM将miR-21靶向胶质瘤细胞显著抑制其生长[17],表明PAMAM是microRNA体外治疗的有效运送载体。本研究采用PAMAM 树状大分子将anti-miR34c输送到肝组织,实现肝纤维化的逆转,表明PAMAM也能够携microRNA进行体内治疗。
