RNA-Seq技术筛选APP/PS1阿尔茨海默病模型小鼠差异表达基因及功能分析
2018-11-02史长华付信靖
史长华,张 玲,陈 巍,付信靖,秦 川
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
阿尔茨海默病(Alzheimer’s disease,AD)是一种老年人中常见的以进行性认知功能障碍和行为损害为特征的神经退行性疾病。AD的病理改变与大脑内老年斑和神经原纤维缠结形成有关。可能的机制包括β淀粉样肽(amyloid beta,Aβ)沉积、炎症损伤、氧化应激等。主要累及部位为皮层和海马。在对118例AD患者神经影像学的观察中发现,AD患者常出现的妄想,淡漠,抑郁等精神症状与前额叶皮层紧密相关[1]。然而目前在AD的研究中,差异基因表达及其功能研究主要集中于全脑或海马区,尚无前额叶皮层差异分析的系统阐述。RNA深度测序(RNA-Seq)是近年来快速发展的高通量测序技术,具有信噪比高、分辨率高、应用范围广等优势。本研究拟利用APP/PS1双转基因动物模型,采用RNA-Seq技术研究AD模型小鼠和野生型小鼠前额叶皮层的基因表达变化,筛选出AD相关特异性的基因,为利用模型小鼠进行AD相关机制和治疗研究提供一些思路。
1 材料和方法
1.1 实验动物
清洁级雌性APP swe /PS1ΔE9 (PAP)双转基因模型小鼠和野生型C57BL/6 J小鼠各5只,9月龄,体重约26~30 g,购自北京华阜康生物科技股份有限公司 [SCXK-(京)2014-0004],实验在中国医学科学院医学实验动物研究所开展 [SYXK-(京)2015-0035]。动物实验方案获实验动物使用与管理委员会(IACUC)的批准 [ILAS-QC-2016-001]。
1.2 主要试剂与仪器
Trizol购自美国 Invitrogen 公司;DEPC水购自美国QIAGEN公司;PrimeScript TM RT Master Mix试剂盒购自日本Takara公司;Ethovision XT动物轨迹跟踪与行为观察记录分析系统购自荷兰Noldus公司;UltraSYBR mixture(with ROX)购自日本Takara公司。HiSeq 3000测序仪购自美国Illumina公司;引物购自中国Invitrogen公司;Qubit 2.0定量仪购自美国Invitrogen公司;Agilent 2100购自美国Agilent公司;PCR仪购自美国Bio-Rad 公司;ABI stepone荧光定量 PCR仪购自美国Thermo公司。
1.3 试验方法
1.3.1 转基因动物的鉴定
PCR 鉴定小鼠的基因型,针对人APP、PS1 基因合成的hAPP正向引物为: 5’-GACTG ACCACTC GACCAGGTTCTG-3’,反向引物:5’-CTTGTAAG TTGGATTCTCATATCCG-3’,产物长度 344 bp;hPS1 正向引物为:5’-AATAGAGAACGGCAGGAGCA-3’,反向引物:5’-GCCATGAGGGCACTAATCAT-3’,产物长度608 bp。
1.3.2 Morris水迷宫实验
参照文献[2]用Morris水迷宫实验检测AD模型和野生型小鼠的空间学习记忆能力。Morris水迷宫隐藏平台实验中潜伏期数据使用重复测量数据的多因素方差分析进行统计,其余结果采用t检验,以P< 0.05 为差异有显著性。
1.3.3 脑组织总 RNA提取
Trizol法提取前额叶皮层总RNA,分别采用Nanodrop、Qubit 2.0、Agilent 2200检测RNA样品的纯度、浓度和完整系数(RNA integrity number,RIN)等,以保证使用合格的样品进行测序。
1.3.4 文库构建、质检与测序
提取样本RNA后,将rRNA去除,并将RNA片段化(平均长度为200 nt左右),逆转录合成cDNA并进行粘性末端修复,cDNA的3’末端加上poly(A)尾并连接测序接头,利用琼脂糖凝胶电泳选出大于200 nt的片段进行PCR扩增,从而得到测序用的cDNA文库。构建好的文库用Agilent 2100分析仪和ABI StepOne Plus实时PCR系统质检,质检选出片段大小为260 bp左右的文库加入流动槽的各通道中,以Paired-End方式进行测序。
1.3.5 基因组比对及差异表达基因分析
经软件Tophat2将测序数据比对到小鼠参考基因组GRCm38,此时可得到一个bam文件,记录了每条reads对应的染色体位置。使用DESeq软件对基因进行定量分析。采用edgeR软件(3.12.1)进行表达差异显著性分析(P< 0.05, |logFC| > 1.0),并对AD样本的表达值(RPKM)进行聚类分析。
1.3.6 GO和KEGG分析
利用 DAVID 软件对差异表达的基因进行GO(Gene Ontology)功能(生物学过程,BP)及KEGG (Kyoto Encyclopedia of Genes and Genomes)分析通路富集分析,帮助了解差异表基因的功能。统计方法为 Fisher’s exact test,Benjamini 算法校正,以校正后P< 0.05 为差异有显著性。
1.3.7 qRT-PCR实验验证
选取6个关键基因进行qRT-PCR验证,其中包括3个上调基因:Trem2、Lyz2、Ctse,3个下调基因:S100a8、S100a9、Ttr。AD模型小鼠和野生型小鼠前额叶皮层总RNA进行反转录,使用UltraSYBR mixture试剂盒进行检测。以β-actin为参考基因,每个mRNA 的相对表达值通过2-△△Ct计算。差异基因引物序列见表1。
2 结果
2.1 APP swe /PS1 ΔE9(PAP)双转基因 AD模型小鼠基因型鉴定
目的基因经PCR扩增后可分别在344 bp和608 bp附近位置出现明显的两条条带,即可确定为携带APP/PS1基因的阳性小鼠。如图1所示,两条带即为目的基因片段。

表1 qRT-PCR 引物序列

注:M:Marker,N:阴性对照,P:阳性对照,1~5为阳性小鼠。
2.2 Morris 水迷宫实验
结果如图2 A所示,在小鼠水迷宫空间探索阶段,AD组相对于野生型小鼠自第三天起寻找平台所用的潜伏期即开始增加(P< 0.05,第3 ~ 6天);如图2B,2C所示,AD模型小鼠在水迷宫空间探索的穿越平台象限和穿越平台次数有明显下降(P< 0.05)。
2.3 总RNA质量检测
AD模型小鼠组与对照组前额叶皮层组织信息见表2。脑组织RNA浓度符合测序要求(≥350 ng/μL)(表2)。结果显示,所有RNA样品的RIN值均在7.1~8.6之间,证明这些RNA样品纯度和完整性可用于后续的文库构建及测序。
2.4 差异表达基因
在AD模型小鼠与野生型小鼠之间发现224个差异基因(P< 0.05, |logFC| > 1.0),其中205个基因上调,19个基因下调。前20个差异表达基因见表3。绘制火山图(图3 A)以展示差异显著性基因的整体分布情况。使用层次聚类对样本的表达值RPKM进行聚类分析(图3B)。
2.5 GO 功能富集分析、KEGG 通路富集分析
为了揭示差异表达基因在AD模型小鼠中参与的生物学过程,对差异基因集进行GO功能富集分析、KEGG 通路富集分析。差异表达基因GO富集的生物过程(图4A)主要有免疫反应、炎症反应等,富集的分子功能(图4B)主要包括细胞膜、粗面内质网等,富集的细胞成分(图4C)主要包括趋化因子活动以及IgG结合等。KEGG 富集分析结果(图4D)显示差异基因参与了吞噬、溶酶体、Toll样受体信号通路、细胞因子受体相互作用、NOD样受体信号通路、朊蛋白病、NF-κB信号通路等。
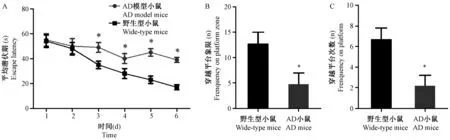
注:A:隐藏平台实验中小鼠寻找平台所用的潜伏期;B和C分别是空间探索实验中小鼠穿越平台象限及平台的次数; *P< 0.05。
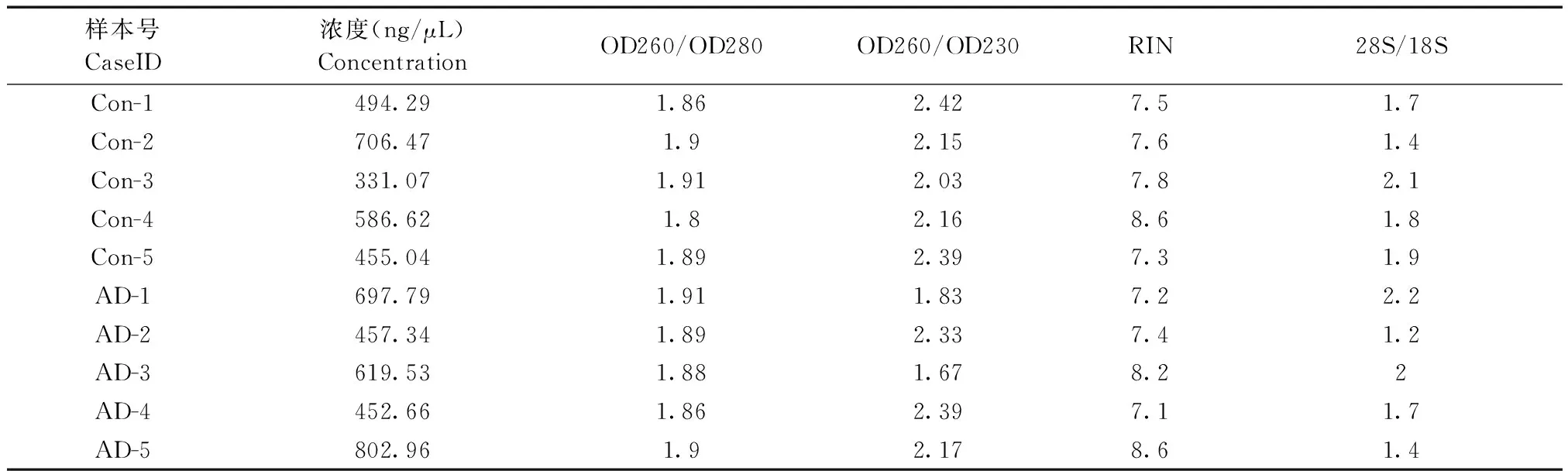
样本号CaseID浓度(ng/μL)Concentration OD260/OD280OD260/OD230RIN28S/18SCon-1494.291.862.427.51.7Con-2706.471.92.157.61.4Con-3331.071.912.037.82.1Con-4586.621.82.168.61.8Con-5455.041.892.397.31.9AD-1697.791.911.837.22.2AD-2457.341.892.337.41.2AD-3619.531.881.678.22AD-4452.661.862.397.11.7AD-5802.961.92.178.61.4
注:Con-1~Con-5是野生型小鼠的前额叶皮层组织,AD-1~AD-5是AD模型小鼠前额叶皮层组织,每组各5例,RNA指控标准是:RIN ≥ 6.5,28S/18S > 0.8和260/280 > 1.8。Note: Con-1-Con-5 present five prefrontal cortex tissues of wide mice, AD-1-AD-5 present five prefrontal cortex tissues of AD mice, The standard for RNA allegations is: RIN ≥ 6.5, 28S/18S > 0.8 and 260/280 > 1.8.
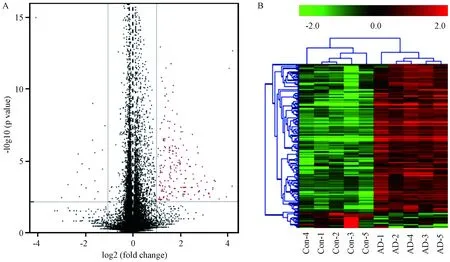
注:A:横坐标表示基因在不同样本中的表达倍数变化 (log 2 fold change),纵坐标表示表达差异的显著性水平 (-log 10 P-value),红色表示差异基因;B:热图中红色表示高表达,绿色表示低表达。
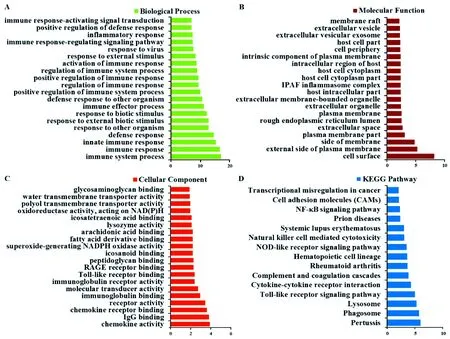
注:A:生物过程;B:分子功能;C:细胞组成;D:KEGG富集分析。

表3 AD模型小鼠与对照组比较的差异基因
2.6 实时荧光定量 PCR 对结果进行验证
根据嗜神经相关差异基因筛选结果和文献复习,选取6 个关键基因进行qRT-PCR 验证,其中包括3个上调基因:Trem2、Lyz2、Ctse,3个下调基因:S100a8、S100a9、Ttr。qRT-PCR结果显示6个关键基因上、下调趋势与RNA-Seq结果(图5)相一致。
3 讨论

图5 差异基因的RNA-Seq结果以及qRT-PCR 的验证结果
在目前AD的研究过程中,APP /PS1双转基因小鼠是最常用的动物模型,本实验所采用的APP /PS1双转转基因小鼠由本所遗传中心构建培育。该模型以C57BL/6 J小鼠为背景,含有人APP swedish 突变位点(K595 N/M596 L)和人PS1ΔE9突变位点,其在3月龄出现学习和记忆缺陷,4.5月龄开始出现老年斑[3],9~12月龄出现大量老年斑[4-5],具有和AD患者相似的病理表型,本研究中AD模型小鼠较对照组小鼠空间学习记忆能力下降。该过程涉及多种基因及其产物之间的相互作用、多种信号通路相互调节和拮抗[6-7],故在整体水平上研究AD模型小鼠基因转录的情况及转录调控规律十分必要。随着高通量技术的快速发展,RNA-Seq 技术日趋成熟。该技术对特定组织或细胞在某个时期转录出来的所有mRNA进行测序,可研究已知基因并能发现新基因,并可在不同的疾病状态、不同的环境条件下对以前未检测到的变化提供可见性。本研究针对AD模型小鼠和野生型小鼠前额叶皮层组织中基因表达水平变化,对差异表达基因进行功能分析;在这些差异的基因中选取3个上调的基因(Trem 2[8],Lyz 2[9]和Ctse[10])和3个下调的差异基因(Tlr[11],s100a8和s 100a9[12]),这6个基因在AD相关研究中均有异常表达,采用 qRT-PCR做验证,结果显示,这些差异基因与测序结果表达一致,说明该技术重复性较好、可信度高。
本研究共发现224条差异表达基因,对差异表达基因进行GO功能和KEGG富集分析结果表明:差异表达基因主要参与了免疫反应和炎症反应、toll样受体信号通路和细胞因子受体相互作用等重要生物学通路。免疫反应相关的差异基因有Toll样受体2(toll-like receptor 2, TLR2)、Tlr、App、髓细胞激活受体2 (triggering receptor expressed on myeloid cells 2, TREM2)等。Trem2基因在人类位于6p21.1,在小鼠存在于17号染色体,在多种髓系来源的细胞如树突状细胞,破骨细胞,组织巨噬细胞广泛表达[8]。有证据表明,过表达AD小鼠TREM2水平可改善小鼠认知功能[13],敲除TREM2基因出现明显的Aβ沉积和小胶质细胞功能障碍[14],从而加重小鼠的认知损害。总之,TREM2对小胶质细胞发挥抗炎、吞噬和清除凋亡神经元以及Aβ具有重要作用。本研究中,AD小鼠模型前额叶皮层组织TREM2基因表达上调,可能提示其表达水平的增加是一种抵御过度沉积Aβ的良性代偿反应。本研究中AD脑中Tlr表达显著增多,Tlr活化后可激活NF-kB,促进各种炎性细胞因子的产生。伴随炎性因子及氧自由基的产生[11],致使炎性因子及氧自由基堆积,可损伤蛋白质、DNA和脂质过氧化物等生物大分子,引起神经细胞发生凋亡,加重AD的损伤作用。当然,上述基因的差异表达是否参与AD相关的免疫炎症反应,toll样信号通路还需要作进一步深入研究。
综上所述,本研究通过RNA-Seq得到了AD模型小鼠前额叶皮层组织中高度相关差异基因,为阐明AD的发病机制提供了重要实验依据。
