实验大鼠和小鼠多种细菌PCR检测与分析
2018-11-02谢建云魏晓锋冯丽萍
冯 洁,谢建云,魏晓锋,冯丽萍,张 泉,高 诚*
(1.扬州大学兽医学院,扬州 225009; 2.上海实验动物研究中心,上海市实验动物质量监督检验站,上海 201203)
实验动物微生物学质量是评价实验动物质量的重要指标之一,定期对实验动物进行微生物质量监测是确保动物质量的重要手段。欧洲实验动物联合会(FELASA)定期发布和更新详细全面的实验动物健康监控指南和人员培训计划,详细阐述了监测病原体的种类、采样要求和检测方法等[1]。国际知名的实验动物企业(如CRL、Taconic)均制定一系列企业标准和检测制度,对于病原体项目、动物年龄、检测方法和频率均有明确指示。我国于1994年颁布了国家标准《实验动物微生物学等级及监测标准》并陆续进行了修改和完善,按照微生物学和寄生虫学规定了不同等级实验动物应排除的病原体及对应的检测方法。2017年以来中国实验动物学会制定并发布两批团体标准,新增了部分病原体项目及检测方法,对于我国实验动物质量保证和提升起到了促进作用。本研究在详细比较国内外实验动物细菌监测方案并结合实际的基础上,选取国外普遍要求检测而我国国标暂未纳入(螺杆菌、啮齿柠檬酸杆菌、牛棒状杆菌)以及国标规定检测(金黄色葡萄球菌、绿脓杆菌和肺炎克雷伯杆菌)的细菌指标作为调查项目,采用PCR方法对2014年和2016年上海市实验动物生产许可证单位实验大鼠、小鼠的部分细菌携带状况进行调查。调查结果可为上海乃至全国实验动物微生物质量控制提供参考,也可为国家标准的修订和完善提供依据。
1 材料和方法
1.1 实验动物
本次调查的实验动物包括小鼠和大鼠,来源于2014年和2016年上海市具有实验大鼠、小鼠生产许可证的单位。清洁级和SPF级动物均饲养于屏障环境。各年度检测设施数量、动物数量及品系分布详见表1和表2。
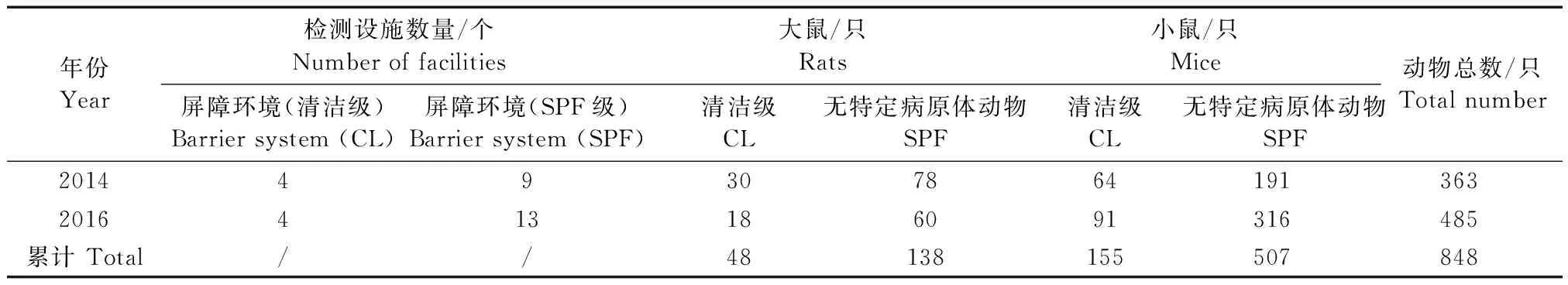
表1 不同年份实验动物生产设施、动物数量统计表

表2 动物品系分布表
1.2 主要试剂
细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,Taq DNA聚合酶、2×Taq Plus Master Mix(Dye Plus)、DL2000 plus DNA Marker购自南京诺唯赞生物科技有限公司。
1.3 实验方法
1.3.1 样品处理
无菌采集动物回盲部内容物,取0.2 g悬浮于1 mL的PBS(pH7.4),850 r/min离心5 min后取上清液,按照细菌基因组DNA抽提试剂盒说明书进行DNA模板抽提。获得的DNA样品于-20℃保存备用。
1.3.2 PCR引物序列
参照文献[2-5],根据GenBank登录的牛棒状杆菌16S rRNA序列(NR_118465.1),利用Primer 5.0设计1对特异性引物。引物由生工生物工程(上海)股份有限公司合成。引物信息见表3。

表3 PCR引物列表
1.3.3 PCR反应程序
PCR反应体系50 μL,包括2× Taq Plus Master Mix(Dye Plus)25 μL,上下游引物(10 μM)各1 μL,DNA模板2 μL。
PCR反应程序:95°C预变性5 min后,按95°C 变性30 s,退火30 s,72°C 延伸30 s的程序循环34次,最后72°C 延伸10 min。
PCR扩增产物经1%琼脂糖凝胶电泳检测分析。将不同来源的阳性PCR产物进行归类,随机挑选阳性产物经凝胶电泳纯化回收后送至至生工生物工程(上海)股份有限公司进行测序。将测序结果与GenBank中已知核酸序列进行BLAST比对、验证。
2 结果
2.1 设施分析
如图1所示, 在SPF级设施未检出金黄色葡萄球菌污染,清洁级设施2014年未检出肺炎克雷伯杆菌污染,其它病原体在不同级别设施内均有不同程度的污染。所有清洁级设施均存在螺杆菌和牛棒状杆菌污染,SPF级设施的螺杆菌和牛棒状杆菌污染率分别为77.78%(2014年)、61.54%(2016年)和66.67%(2014年)、92.31%(2016年)。
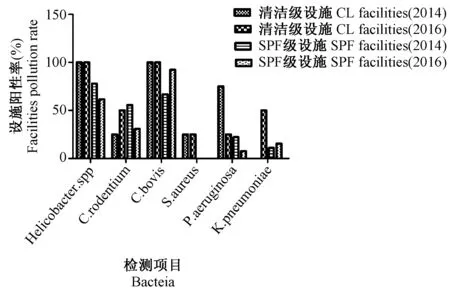
图1 不同细菌检测项目的设施污染率比较
2.2 病原检测结果分析
如图2所示,大鼠螺杆菌阳性率为34.26%(2014年)和25.64%(2016年),啮齿柠檬酸杆菌阳性率为4.63%(2014年)和17.95%(2016年),牛棒状杆菌阳性率为23.15%(2014年)和33.33%(2016年),金黄色葡萄球菌阳性率为5.56%(2014年)和7.69%(2016年),绿脓杆菌和肺炎克雷伯杆菌均未检出阳性。小鼠螺杆菌阳性率为40.39%(2014年)和29.73%(2016年),啮齿柠檬酸杆菌阳性率为5.88%(2014年)和15.48%(2016年),牛棒状杆菌阳性率为19.22%(2014年)和38.33%(2016年),金黄色葡萄球菌阳性率为1.57%(2014年)和0%(2016年),绿脓杆菌阳性率为9.80%(2014年)和0.74%(2016年),肺炎克雷伯杆菌阳性率(2014年0.78%,2016年3.69%)。
分别对不同级别动物不同年份的阳性率进行分析。如表4所示,螺杆菌仅清洁级大鼠阳性率呈上升趋势,其他级别均下降。啮齿柠檬酸杆菌和牛棒状杆菌在不同级别动物上的阳性率均呈上升趋势。国标要求排除的3种细菌,金黄色葡萄球菌仅清洁级有阳性检出,SPF级均为阴性,符合国标要求。大鼠绿脓杆菌无阳性检出,不同年份、不同级别的小鼠均有阳性检出,但均呈下降趋势。大鼠肺炎克雷伯杆菌无阳性检出,小鼠仅2014年清洁级为阴性,其他均有阳性检出。
对阳性动物品系进行分析,螺杆菌阳性率相对较高的品系有BALB/c、ICR、KM等,仅KM阳性率升高,其它品系阳性率均下降。来自同一设施的22只清洁级F1小鼠螺杆菌全部为阳性。所有品系动物均检出牛棒状杆菌阳性。大多数品系的啮齿柠檬酸杆菌和牛棒状杆菌阳性率均呈升高趋势。金黄色葡萄球菌仅SD大鼠和BALB/c小鼠检出阳性。绿脓杆菌和肺炎克雷伯杆菌阳性样品均集中在小鼠。在动物饲养管理和使用过程中应加以关注(表5,表6)。

图2 PCR检测不同动物阳性率统计

表4 PCR检测不同级别动物阳性率统计(%)

表5 PCR检测不同品系动物阳性率统计(%,2014年)

表6 PCR检测不同品系动物阳性率统计(%,2016年)
3 讨论
细菌病原学检测方法可分为传统的分离培养以及PCR等分子生物学方法。当前国际先进标准已广泛使用PCR方法对实验动物病原体进行监测,中国实验动物学会制定的团体标准中亦发布了部分病原体(如螺杆菌、牛棒状杆菌)的PCR检测规程。但我国国标目前主要采用分离培养法进行检测,尚未采用分子生物学方法。培养法需要培养基配制、采样、分离培养、染色镜检和生化鉴定等多个环节,存在检测周期长、操作流程繁琐、检测试剂的供应及标准化不足、对检测人员的专业技术要求较高等诸多不足,严重制约了我国实验动物质量标准以及检测体系的完善与发展。PCR方法相较于传统分离培养法特异性强,敏感性高。在规范试验试剂、设备以及人员操作流程的前提下,可用于病原体的快速检测,尤其适用于大规模筛查。
国外先进标准中普遍要求实验大鼠、小鼠须排除的病原体,如螺杆菌、牛棒状杆菌、柠檬酸杆菌等均未出现在我国标准中。螺杆菌主要以隐性感染形式存在于动物消化道,可致小鼠肝炎、肝细胞瘤、盲肠结肠炎、胆肝炎等多种疾病,严重影响实验动物质量,已被公认为是啮齿类实验动物的重要致病菌。啮齿柠檬酸杆菌为肠杆菌科柠檬酸杆菌属成员之一,为条件性致病菌,可引起小鼠传染性结肠增生、腹泻、结肠炎甚至直肠脱垂等症状。对于免疫功能健全的成年小鼠,一般无明显症状。牛棒状杆菌可导致裸鼠表皮角化过度,俗称“鳞皮病”。无毛鼠和免疫缺陷鼠一旦感染,几乎终身携带。动物感染通常伴随体重减轻、摄水量增加、结膜充血、异种移植物生长缓慢等现象,设施一旦污染很难清除[6]。金黄色葡萄球菌、绿脓杆菌、肺炎克雷伯杆菌是我国实验动物微生物学等级及监测标准(14922.2-2011)中明确规定SPF级实验大鼠、小鼠必须检测和排除的病原菌[7],均属于条件性致病菌,正常存在于动物体内和环境中,当动物免疫功能低下时可感染动物。国外多数将其作为环境监测的参考指标,当评估认为该病原体可能会对正在进行的实验存在干扰时则要求监测。
本研究参照文献所述PCR检测程序,对上海地区实验鼠群进行大规模质量监测,并从设施、动物级别、动物品系等多角度全面系统地分析了当前实验大鼠、小鼠细菌的携带状况。数据显示,螺杆菌、啮齿柠檬酸杆菌和牛棒状杆菌在不同级别动物上均有阳性检出。尤其是清洁级小鼠螺杆菌、所有级别动物的牛棒状杆菌和柠檬酸杆菌污染率高、污染范围广,应引起重视。啮齿柠檬酸杆菌、牛棒状杆菌、肺炎克雷伯杆菌阳性率呈明显上升趋势,但螺杆菌、绿脓杆菌阳性率均呈下降趋势。文献数据显示,螺杆菌呈全球性分布,Charles River对北美和欧洲实验鼠群螺杆菌进行调查发现,螺杆菌是实验鼠群主要流行的病原体。金黄色葡萄球菌是日本实验大鼠和小鼠流行最普遍的病原体,小鼠设施阳性率达18.8%,大鼠设施阳性率达58.62%,欧美小鼠金黄色葡萄球菌的携带率为6%~11%,啮齿柠檬酸杆菌感染率极低[8-10]。我国北京、广东等地区也有螺杆菌、牛棒状杆菌、金黄色葡萄球菌和绿脓杆菌阳性报道[11-14]。由此可见,国内外实验鼠群病原体污染的流行趋势基本一致。
虽然PCR方法具备精准、高效、便捷的优势,仍需结合经典方法进行验证。笔者认为后续应进一步溯源至阳性的设施和品系,开展细菌的分离培养及鉴定等病原学方面的工作,以全面细致了解本市实验动物生产设施内上述细菌的分布情况。本研究的调查结果对于提高实验动物质量和饲养管理水平起促进作用,为我国实验动物国家标准的修订和完善提供依据和参考。鉴于上述病原体对于动物本身及从业人员和环境的影响,生产单位作为国内实验动物的源头,应结合行业发展趋势,加强饲养管理,制定并优化监测方案,从而提高动物品质和企业竞争力。
