结核潜伏感染诊断新型候选标志物的筛选及临床验证
2018-11-02建勇
, , ,, , ,建勇
结核病是由结核分枝杆菌(Mycobacterium tuberculosis, MTB)感染引起的慢性传染病。MTB感染人体后少数引起活动性结核病(约10~40%),而大多数处于潜伏状态(约60~90%)。结核潜伏感染(1atent tuberculosis infection,LTBI)是指MTB刺激人体后出现的持续免疫反应,但无活动性结核临床依据的一种状态。据世界卫生组织估计,全球约20%人口感染结核杆菌,LTBI者中约5%~10%会发展为活动性结核病,是活动性结核病的重要来源,是结核病防控的重点之一。要实现世界卫生组织的2035年终止结核病目标,早发现、早诊断LTBI不容忽视。
目前现有的结核病筛查试验及诊断LTBI的方法有两种:1.结核菌素皮肤试验(tuberculin skin test,TST)。TST广泛用于结核病的筛查及诊断LTBI,由于受接种卡介苗、非结核分枝杆菌感染及机体免疫状态等因素影响,敏感性及特异性低。2.γ-干扰素释放试验(interferon gamma release assays,IGRAs)。该方法可排除受接种卡介苗及大多数非结核分枝杆菌感染等因素影响,较TST提高了敏感性及特异性[1-5],然而除由于成本-效益的原因难以广泛应用外,更主要的缺陷是仍不能区分LTBI及活动性结核病。结核病的防控及临床迫切需要寻找诊断LTBI,并能鉴别LTBI及活动性结核病的新型候选标志物。本研究经遵义医学院附属医院伦理学委员会批准,利用商品化的结核蛋白芯片,将初筛出的LTBI候选标志物自制成蛋白芯片,并进行临床验证,以期获得特异性及敏感性较高的新型组合标志物,并寻找可鉴别LTBI和活动性结核病的候选标志物。
1 材料与方法
1.1对象及标本来源 选择2013年1月至2015年12月就诊于遵义医学院附属医院的活动性肺结核患者(ATB组)116例、LTBI者(LTBI组)69例及健康人群(H组)51例,共236例,并收集相应血清各1份。各组年龄15~65岁,性别不受限,入组前均签署知情同意书。
1.1.1对象纳入标准
1.1.1.1活动性肺结核组纳入标准 1痰涂阳和(或)培阳病人;2 X线检查:肺部有渗出性病变、干酪性病变、空洞、增殖性病变、血行播散性肺结核病灶;3从未抗结核治疗或正在规律抗结核治疗中而病灶仍具有活动性的病人;4伴或不伴有咳嗽、咳痰、咯血、胸痛及发热等临床表现;5血结核感染T细胞斑点试验(T-SPOT.TB)阳性。6排除标准:肺门淋巴结结核、结核性胸膜炎及其他肺外结核与肺部病变。
1.1.1.2LTBI组纳入标准 1无结核病史;2无咳嗽、咳痰、咯血及发热等呼吸系统及全身临床表现;3体格检查无阳性发现;4 PPD阳性(硬结平均直径≥10mm 及伴水疱、坏死及淋巴管炎);5胸部CT、腹部彩超、子宫双附件(女)、前列腺(男)等检查无异常;6血T-SPOT.TB阳性。
1.1.1.3健康人群组纳入标准 1体检健康人群;2无结核病史;3血T-SPOT.TB阴性。
1.2 方法
1.2.1收集血清标本 用EDTA抗凝管采集各组研究对象肘静脉血5 mL,3 000 g/min离心10 min,用吸管吸取上清液,加入高压灭菌冻存管中,-80 ℃冰箱保存备用。
1.2.2利用商品化的MtbprotTM结核分枝杆菌蛋白芯片初步筛选MTB差异响应蛋白 选取小样本血清标本共32份(H组7份、LTBI组9份及ATB组16份),每组分为a、b、c三个亚组,每亚组分别与1张MtbprotTM结核分枝杆菌蛋白芯片杂交(广州博翀生物科技有限公司)(表1),同时检测IgG(532nm荧光,绿色)和IgM(635nm荧光,红色)两类血清抗体,用F Median通道下的信号前景值的中位数值/B Median通道下的背景值的中位数值以表示信号强度,F532nm/B532nm及F635nm/B635nm分别表示IgG及IgM抗体信号强度,获得IgG/IgM 抗体差异响应蛋白。
表1 32份血清标本与9张芯片杂交分组
Tab.1 Hybridization groups of 32 serum samples reacted with 9 chips

实验组亚组abc健康人群组(H)133结核潜伏感染组(LTBI)135活动性肺结核组(ATB)1510
1.2.3定制MtbprotTM结核分枝杆菌蛋白芯片 用初筛获得的IgG/IgM差异响应蛋白,根据信号均值选取响应较强的前100个MTB蛋白,并定制含此100个MTB特异性蛋白MtbprotTMA芯片。
1.2.4利用定制的MtbprotTM结核分枝杆菌蛋白芯片获得分辨能力蛋白 将204份血清标本(H组44份,LTBI组60份,ATB组100份)与定制蛋白芯片进行反应,根据单个蛋白的P值进行评价,发现对分辨ATB组与LTBI组及H组具有一定分辨能力的蛋白。
1.2.5数据进行归一化处理 为消除不同样本、不同芯片之间的系统性差异带来的误差,对芯片数据进行归一化处理。首先,绘制背景分布图,去除背景较高的样本,实际有效的样本为199例。基于R语言limma数据包下的背景校正算法background Correct,实现逻辑如下:RG.bgcorrect = backgroundCorrect(RG,method="normexp"),参数normexp是一种基于局部背景的归一化方法(PMID: 19068485)。然后,运行间归一化算法normalizeBetweenArrays:RG.bgcorrect = normalizeBetweenArrays(RG.bgcorrect)。归一化过程中,每个蛋白对应的两个点取平均值作为该蛋白响应的信号值。
1.3数据处理 对独立筛选的候选标志物,根据每个蛋白对每个样本的响应信号值,假设该蛋白在所对比的两组样本中具有显著性差异且在两组样本中呈更强的响应(免疫响应较强),并计算其可信程度,以T test的P值来表征,当P值<0.05时,表示具有显著差异,认为该蛋白具有一定的分辨能力;同时计算两组样本的信号均值差异比,以fold change(fc,fc=log2)来表示,fc越大,表示响应程度越高。对于候选标志物的组合,根据已知分组样本的响应值,基于SPSS19.0统计分析软件,构建判别函数(Discrimination Function),并最终绘制ROC曲线,通过曲线下面积(area under curve,AUC)判定准确性。AUC越接近于1,说明诊断准确性越高。
2 结 果
2.1利用商品化的MtbprotTM结核分枝杆菌蛋白
芯片初步筛选MTB差异响应蛋白,获得135个IgG/IgM 抗体差异响应蛋白(表2,图1),并定制含有前100个蛋白的MtbprotTM结核分枝杆菌蛋白芯片(表3)。
表2 135个IgG/IgM 抗体差异响应蛋白
Tab.2 Responsive MTB proteins with significant differences based on the screening results

ATB组>H组ATB组>LTBI组Co-existIgG112210IgM5259Co-exist11Alone116LTB1组>ATB组19

注:IgG-绿色;IgM-红色Notes: green was for IgG; red was for IgM图1 IgG/IgM 抗体响应蛋白Fig.1 Proteins responding to IgG/IgM antibody
表3 MtbprotTM定制芯片所包含的100个MTB蛋白相关信息
Tab.3 Related information of 100 MTB proteins customized into MtbprotTMchip

序 号编 号蛋白名类型与来源序 号编 号蛋白名类型与来源13Rv1821 IgG、IgM5181Rv0538IgG、IgM24Rv3841IgG、IgM5283Rv1293IgM35Rv3154IgG5386Rv3712IgM46Rv0957 IgG5487Rv0652IgM57Rv3009cIgM5588Rv2031cIgG68Rv2291IgM5690Rv0280IgG710Rv0214IgG5791Rv0499IgM811Rv1292IgM5892Rv0894IgG913Rv0583cIgG5993Rv3874IgG1014Rv3480cIgG6094Rv3881cIgG1115Rv0351IgG6195MT3503IgM表3(续)序 号编 号蛋白名类型与来源序 号编 号蛋白名类型与来源1218Rv0440IgG6296Rv1320cIgG1322Rv0576IgG6398Rv2179cIgM1423MT1560.1IgM64101Rv2396IgG1524Rv1876IgG65102Rv2467IgM1625Rv1860IgG66105Rv3418cIgG1726Rv2557IgG、IgM67106Rv3704cIgG1827Rv0423cIgG、IgM68107Rv3810IgG1928Rv2299cIgM69109Rv0944IgM2031Rv1337IgG70110Rv3208IgM2133Rv1498AIgG71111Rv3256cIgM2234Rv1538cIgM72113Rv3301cIgM2335Rv1597IgG73114Rv0270IgM2438Rv2157cIgG74115Rv2114IgM2539Rv2418cIgG75116Rv3472IgM2641Rv2511IgG76117Rv3732IgM2742Rv3190cIgG77118Rv2450cIgM2843Rv3506IgG78119Rv2342IgM2944Rv3653IgG、IgM79121Rv3814cIgM3046Rv3699IgM80122Rv1411cIgG3149Rv3899cIgG、IgM81123Rv1441cIgM3250MT1547IgG、IgM82125Rv2513IgM3352Rv0174IgG、IgM83126Rv0049IgG3453Rv0251cIgG、IgM84127Rv0435cIgM3554Rv0457cIgG、IgM85130Rv0350IgG3655Rv0494IgG、IgM86132Rv0370cIgM3756Rv0684IgG、IgM87133Rv1015cIgM3857Rv0865IgG、IgM88136Rv2368c IgM3958Rv0887cIgG、IgM89139Rv3542cIgM4060Rv3503cIgG、IgM90143Rv2676cIgM
2.2利用定制MtbprotTM结核分枝杆菌蛋白芯片与较大样本的临床标本杂交,获得28个对分辨ATB组与LTBI组及H组具有一定分辨能力的蛋白(表4)。
表4 对ATB组与LTBI组及H组具有分辨能力的28个结核分枝杆菌蛋白信息
Tab.4 Information of 28 MTB proteins for differentiating between ATB and LTBI/H groups
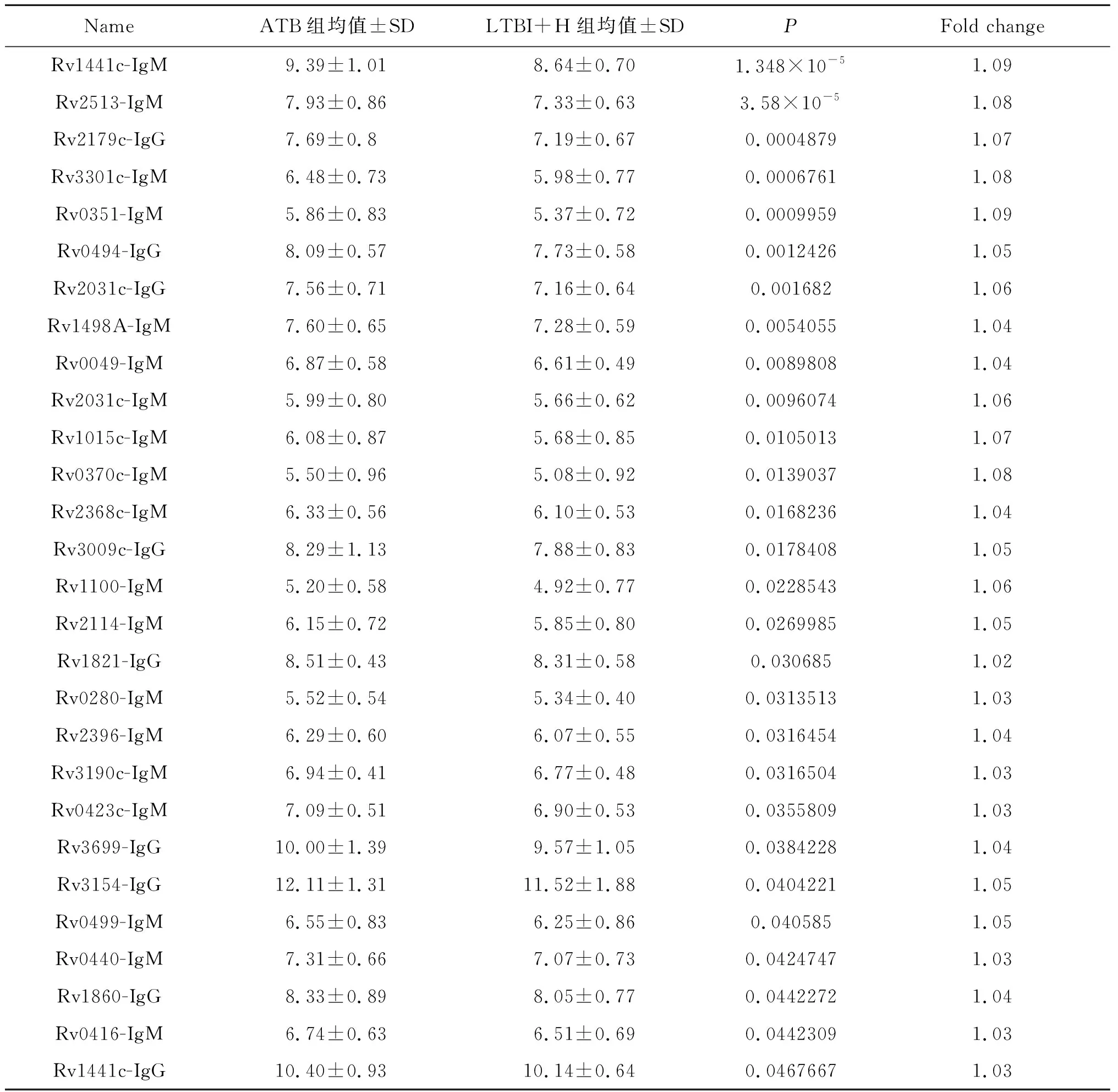
NameATB组均值±SDLTBI+H组均值±SDPFold changeRv1441c-IgM9.39±1.018.64±0.701.348×10-51.09Rv2513-IgM7.93±0.867.33±0.633.58×10-51.08Rv2179c-IgG7.69±0.87.19±0.670.00048791.07Rv3301c-IgM6.48±0.735.98±0.770.00067611.08Rv0351-IgM5.86±0.835.37±0.720.00099591.09Rv0494-IgG8.09±0.577.73±0.580.00124261.05Rv2031c-IgG7.56±0.717.16±0.640.0016821.06Rv1498A-IgM7.60±0.657.28±0.590.00540551.04Rv0049-IgM6.87±0.586.61±0.490.00898081.04Rv2031c-IgM5.99±0.805.66±0.620.00960741.06Rv1015c-IgM6.08±0.875.68±0.850.01050131.07Rv0370c-IgM5.50±0.965.08±0.920.01390371.08Rv2368c-IgM6.33±0.566.10±0.530.01682361.04Rv3009c-IgG8.29±1.137.88±0.830.01784081.05Rv1100-IgM5.20±0.584.92±0.770.02285431.06Rv2114-IgM6.15±0.725.85±0.800.02699851.05Rv1821-IgG8.51±0.438.31±0.580.0306851.02Rv0280-IgM5.52±0.545.34±0.400.03135131.03Rv2396-IgM6.29±0.606.07±0.550.03164541.04Rv3190c-IgM6.94±0.416.77±0.480.03165041.03Rv0423c-IgM7.09±0.516.90±0.530.03558091.03Rv3699-IgG10.00±1.399.57±1.050.03842281.04Rv3154-IgG12.11±1.3111.52±1.880.04042211.05Rv0499-IgM6.55±0.836.25±0.860.0405851.05Rv0440-IgM7.31±0.667.07±0.730.04247471.03Rv1860-IgG8.33±0.898.05±0.770.04422721.04Rv0416-IgM6.74±0.636.51±0.690.04423091.03Rv1441c-IgG10.40±0.9310.14±0.640.04676671.03
2.3通过初筛与临床验证优选出可用于诊断LTBI 的8个新型候选标志物,即Rv1860、Rv2031c、Rv1441c、Rv0494、Rv3301c、Rv0351、Rv1821和Rv0280(表5)。当其单独应用时,Rv0494 (针对IgG)及Rv1441c(针对IgM)区别LTB组与ATB组的效能最好,特异性、敏感性及AUC分别为70.5%和84.1%、64.4%和57.6%、69.1%和74.2%。当其联合应用时,其可区分H组和LTBI组,诊断LTBI的特异性为90.9%,敏感性为83.1%, AUC为94.1%(图2)。
表5 诊断LTBI的8个新型候选物
Tab.5 New candidate biomarkers for diagnosis of LTBI

IDName系数IDName系数1Rv0494-IgG0.315Rv0280-IgM0.432Rv3301c-IgM0.356Rv0351-IgM0.483Rv1860-IgG0.417Rv2031c-IgG0.604Rv1821-IgG0.438Rv1441c-IgM0.68

图2 8个新型候选物联合应用诊断LTBI的ROC曲线Fig.2 ROC of eight candidate biomarkers combination diagnosis for LTBI
3 讨 论
由于MTB抗原多样化及复杂化,蛋白芯片上增加MTB抗原,可提高检测血清抗体的敏感性及特异性[6-7]。本研究利用商品化的含4262个MTB蛋白的MtbprotTM结核分枝杆菌蛋白芯片与小样本临床血清标本进行杂交,初筛获IgG/IgM 抗体差异响应蛋白135个,定制成含响应较强的前100个MTB蛋白的MtbprotTM结核分枝杆菌蛋白芯片,再次与较大样本临床血清标本进行杂交,成功筛选出可作为诊断LTBI的新型候选标志物,并获得国家发明专利[8]。
研究表明结核蛋白芯片检测血清抗结核抗体广泛用于辅助诊断肺结核、结核性胸膜炎、肺外结核以及HIV合并肺结核等结核病,其阳性率为45.00%~76.15%,敏感性为61.11%~71.42%,特异性为50.80%~97.50%,联合PPD、IGRAs等检查,其阳性率高达80.00%~97.20%,敏感性高达77.55%~89.29%,特异性高达77.17%~93.75%[9-15]。本研究基于商品化的MtbprotTM结核分枝杆菌蛋白芯片初筛LTBI新型候选标志物,进而利用自定制的 MtbprotTM结核分枝杆菌蛋白芯片,筛选出LTBI新型候选标志物8个,包括Rv1860、Rv2031c、Rv1441c、Rv0494、Rv3301c、Rv0351、Rv1821和Rv0280,经204份临床血清标本进行临床验证,其组合诊断LTBI的敏感性及特异性分别为83.10%和90.90%,AUC为94.1%,敏感性较单独用结核蛋白芯片检测高,与结核蛋白芯片检测联合PPD、IGRAs等检查基本一致,特异性与上述报道基本一致,提示8个新型候选标志物的组合用于诊断LTBI具有较高的特异性及敏感性。
结核病的诊断在缺乏病原学或病理学“金指标”条件下,免疫学检查显示其重要地位。目前结核病的筛查及诊断LTBI的方法主要有TST及IGRAs。IGRAs因以早期分泌抗原靶 6(ESAT6)和培养滤液蛋白10(CFP10)为特异性抗原,其特异性优于TST,广泛用于判断结核感染及辅助诊断结核病,但仍未能区分结核是否活动[16-21]。IGRAs的两种检测方法对诊断MTB感染具有高度的一致性,总符合率92.7%,然而不能单独用于诊断活动性结核病[22-23],在结核病高负担环境下,IGRAs不适合诊断活动性结核病[24]。Rv1441c是由PE-PGRS26基因编码的MTB PE/PPE家族蛋白。国外有学者通过对200株临床MTB分离株进行 PE-PGRS26基因测序,发现有50%的菌株存在突变,提示其突变与MTB能够持续存活于宿主有关[25]。Talarico S等报道Rv0494在MTB的脂肪酸生物合成中充当脂肪酸效应转录调控子的作用[26]。国内有研究表明Rv0494蛋白可能下调了MTB的生理活性相关基因的表达,从而减缓了MTB在压力环境下的生长速率[27]。上述研究提示Rv1441c、Rv0494与LTBI有关。本研究发现Rv1441c及Rv0494在LTBI组中分别针对血清抗体IgM及IgG响应,而在ATB组及H组中针对血清抗体IgM或IgG无响应,Rv0494 (针对IgG)及Rv1441c(针对IgM)区别LTB组与ATB组的特异性、敏感性及AUC分别为70.5%和84.1%、64.4%及57.6%、69.1%及74.2%,其AUC较接近于8个候选标志物组合的AUC,提示Rv1441c、Rv0494可作为鉴别LTBI和活动性结核病的候选标志物。与IGRAs比较,Rv1441c、Rv0494不仅可诊断LTBI,而且具有一定的区分LTBI和活动性结核病的效能。
总之,利用商品化的MtbprotTM结核分枝杆菌蛋白芯片初筛LTBI诊断候选标志物,并定制结核分枝杆菌蛋白芯片,筛选出诊断LTBI新型候选标志物组合,对诊断LTBI有较高的敏感性及特异性,其中Rv1441c、Rv0494可作为鉴别LTBI和活动性结核病的候选标志物。本研究为筛选LTBI诊断新型候选标志物提供了新方法及思路,但临床验证标本量较少,需要临床大样本进一步进行验证。
