多肿瘤标志物蛋白芯片在肿瘤筛查的应用
2016-11-03王亚南廖莉娅郑晓琴
王亚南+廖莉娅+郑晓琴

【摘要】 目的 讨论12种肿瘤标志物蛋白芯片检测系统(C-12)在肿瘤筛查的应用。方法 采用C-12型多肿瘤标志物蛋白芯片检测试剂盒检测1950例健康体检者及336例住院患者血清中12种肿瘤标志物的水平, 结合临床情况, 分析比较检出阳性率和临床肿瘤诊断符合率。结果 健康体检者C-12检测指标阳性率5.13%低于住院患者26.49%(P<0.05);阳性健康体检者肿瘤检出率56.52%与阳性住院患者79.78%比较差异具有统计学意义(P<0.05);蛋白芯片检测结果阳性者与临床诊断肿瘤者其符合率达71.85%。结论 多肿瘤标志物蛋白芯片检测系统是肿瘤高危人群筛查的重要手段, 可用于临床肿瘤的辅助诊断、预后及疗效观察。
【关键词】 多肿瘤标志物;蛋白芯片;肿瘤;筛查
DOI:10.14163/j.cnki.11-5547/r.2016.25.001
【Abstract】 Objective To discuss application of multi-tumor marker protein chip detection system (C-12) in tumor screening. Methods C-12 multi-tumor marker protein chip detection kit was applied to detect 12 serum tumor markers levels in 1950 healthy people and 336 hospitalized patients. Analysis was made in accordance with their clinical situation on positive rate and clinical tumor diagnostic accordance rate. Results Healthy people had lower C-12 indexes positive rate as 5.13% than 26.49% in hospitalized patients (P<0.05). The difference of tumor detection rate between 56.52% in positive healthy people and 79.78% in positive hospitalized patients had statistical significance (P<0.05). Coincidence rate was 71.85% between positive cases in protein chip detection and cases with tumor by clinical diagnosis. Conclusion As an important screening method for tumor high risk group, multi-tumor marker protein chip detection system can be applied in assistant clinical tumor diagnosis, prognosis and curative effective observation.
【Key words】 Multi-tumor marker; Protein chip; Tumor; Screening
肿瘤的发病率逐年提高, 且发病年龄有年轻化趋势, 早期诊断相对困难, 严重危害人类健康, 肿瘤的早期发现和诊断至关重要[1]。由于未能及早发现、早诊断和早治疗, 大多数患者在确诊为肿瘤时, 往往到了中晚期, 此时不仅病情严重、症状复杂、痛苦较大、体质下降、生存质量低下, 而且临床治愈率较低, 因而早发现、早诊断、早治疗是提高患者生存率的关键[2]。C-12型多肿瘤标志物蛋白芯片系统是一种以双抗体夹心法为基础的化学发光检测方法, 12种肿瘤标志物的抗体被包被在固相基质上, 捕捉被检测血清样本中对应的肿瘤标志物, 结合第二抗体, 然后催化化学反应进而产生光信号, 最后用专门的芯片阅读仪读取光信号, 对肿瘤标志物进行定量检测。多肿瘤标志物蛋白芯片检测系统具备高通量、高准确性、快速且微型化的特点, 目前被广泛应用[3]。本文讨论C-12型多肿瘤标志物蛋白芯片检测系统在肿瘤筛查的应用, 现报告如下。
1 资料与方法
1. 1 一般资料 检测对象为中山大学附属第五医院2015年1~10月的2286例受试者, 其中健康体检者1950例, 住院患者336例, 男1209例, 女1077例。
1. 2 仪器与试剂 试剂采用上海铭源数康生物芯片有限公司生产的C-12型多肿瘤标志物蛋白芯片试剂盒, 包括C-12蛋白芯片集成板1块, 浓缩洗涤液1瓶, 反应液1瓶, 标准品系列(标准品0、标准品4各1瓶, 冻干品), 定量质控品1瓶, 复溶剂1瓶, 检测液A和检测液B各1瓶。检测仪器HD-2001A生物芯片阅读仪、生物芯片图像分析系统软件均由上海铭源数康生物芯片有限公司提供。
1. 3 检测方法
1. 3. 1 标本采集 所有受试者均于清晨空腹采集静脉血2 ml, 不抗凝。离心后取血清保存于4℃冰箱待测, 7 d内完成检测, 除外溶血、脂血和黄疸标本。
1. 3. 2 实验步骤 采用C-12蛋白芯片试剂盒, 严格按照操作说明书将试剂配套标准品、质控品复溶, 取标准品按比例稀释并进行标记。用200 μl的加样枪依次吸取校准品0、校准品1、校准品2、校准品3、校准品4、定量质控品、待测样品各100 μl加入芯片各反应孔内, 避免产生气泡, 每吸取一个样本应更换一个枪头;将已加样完成的芯片, 平放固定于恒温摇床内, 设定恒温摇床运行参数为37℃、25 r/min, 温育振荡30 min;弃去芯片反应孔内的液体, 并用洗涤液冲洗1次, 将芯片放入洗盒中加入洗涤液, 并将洗盒直立固定于恒温摇床内, 设定恒温摇床运行参数为37℃、25 r/min, 温育振荡8 min, 弃去洗盒内洗涤液, 共洗涤4次;在芯片各反应孔内加入100 μl反应液, 避免产生气泡;第2次温育与温育第1次方法相同;弃去芯片反应孔内液体, 并用洗涤液进行冲洗1次, 剥离蛋白芯片集成块的上部将蛋白芯片集成块下部放入洗盒中加入洗涤液, 并将洗盒直立固定于恒温摇床内, 设定恒温摇床运行参数为37℃、25 r/min, 温育震荡8 min, 弃去洗盒内洗涤液, 共洗涤4次;将检测液A和检测液B混合15 min后制成混合液, 将洗涤完成的蛋白芯片集成块拍干, 并在每个芯片的膜表面加入20 μl检测液A和检测液B的混合液静置1.5 min;将加有检测液A和B混合液蛋白芯片集成块下部放入生物芯片阅读仪, 软件将自动读取图像(时间60 s)、作标准曲线、分析各被测样本的测试结果并打印数据报表。全部样本均应用同一方法在同一实验室进行检测。
1. 4 结果判断 凡有1项及1项以上指标超出试剂盒提供正常参考范围即定性为“结果阳性”, 以人次计算, 同时记录其检测数值。
1. 5 统计学方法 采用SPSS18.0统计学软件处理数据。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
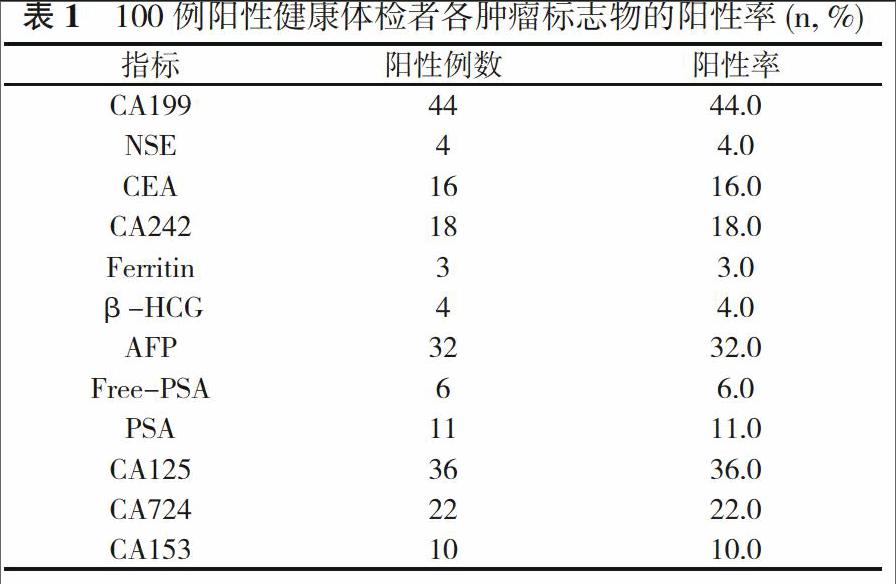
2. 1 1950例健康体检者中, 不同程度超出参考值范围的有100例, 各肿瘤标志物的阳性率以糖类抗原(CA)199、甲胎蛋白(AFP)、CA125、CA724较高, 神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、CA242、铁蛋白(Ferritin)、人绒毛膜促性腺激素(β-HCG)、游离型前列腺特异性抗原(Free-PSA)、前列腺特异性抗原(PSA)、CA153阳性检出率都较低。见表1。
2. 2 1950例健康体检者中100例检测结果阳性, 336例住院患者中89例检测结果为阳性, 住院患者检测阳性率显著高于健康体检者(P<0.05)。见表2。
2. 3 100例阳性健康体检者后期随访调查难度较大, 不能完全统计, 故需要排除部分不在本院进行后续检查治疗以及可能去其他医院求医的例数, 来本院进行后续检查治疗的共有46例, 46例阳性体检者中经病理学、影像学等被确诊为肿瘤的为26例, 89例阳性住院患者经病理学、影像学等被确诊为肿瘤的为71例, 住院患者阳性与健康体检者肿瘤检出率比较差异具有统计学意义(P<0.05)。见表3。蛋白芯片检测结果阳性者与临床诊断肿瘤者其符合率达71.85%(97/135)。
2. 4 住院患者和健康体检者被确诊为恶性肿瘤的多以2项指标及2项指标以上同时升高为主, 未确诊为肿瘤的例数多以单项指标升高为主, 住院患者和健康体检者C-12检测指标阳性情况分析见表4。
3 讨论
恶性肿瘤是危害人类健康的重大原因之一, 但肿瘤中、早期无特异性症状, 故常常漏诊, 大多数患者在确诊为肿瘤时, 往往处于肿瘤晚期, 已丧失手术治疗的最佳机会, 同时缺乏有效的治疗手段[4]。因此, 肿瘤的早发现对肿瘤的预防和治疗至为关键。理想中的肿瘤标志物应具有以下特点:①较高敏感性, 可以在早期就发现肿瘤微小病变;②高特异性, 可根据肿瘤标志物的类型不同进行肿瘤定位和鉴别诊断;③浓度与肿瘤大小相关, 与病情程度相关性高;④浓度变化可直观反映肿瘤的治疗效果, 预后判断;⑤易于检测。然而, 目前尚未有任何一种肿瘤标志物可以完全满足以上的条件, 且单项指标检测特异性低, 灵敏度低, 因此在临床实践中, 常将多项相关的标志物组成联合标志物, 来进一步提高辅助诊断临床肿瘤的准确率[5]。
本材料采用的C-12蛋白芯片检测系统通过同时定量检测被检者血清中的12种肿瘤标志物的含量, 联合受试者的临床状况, 分析对比检出阳性率和临床肿瘤诊断符合率, 结果表明12种肿瘤标志物联合检测有助于早期肿瘤筛查。C-12具有高信息量、高通量、低成本等特点, 且检测方法简便快速, 创伤性小, 成本较化学发光低得多, 体现了明显的优越性, 可广泛应用于健康体检人群和肿瘤高危人群的早期筛查[6]。需注意的是肿瘤标志物检测结果增高并不等于肯定得了癌症, 而结果正常也不能完全排除癌症, 必要时需要定期复查和随访。一旦出现阳性结果, 应及时进行影像学等相关辅助诊断检测, 必要时进行病理学活检来确诊, 并定期复查和随访, 以达到早发现, 早诊断, 早治疗, 提高肿瘤生存率的目的[7]。
因为C-12蛋白芯片检测系统同时检测12项肿瘤标志物的含量, 会受到实验室条件、个人体质和疾病状态等多方面因素的影响, 而要获得对肿瘤诊断可信度高的检测结果, 就需要尽量去除自身疾病状态以外的影响因素。随年龄的增长, 部分肿瘤标志物也会相应发生改变, 主要是CA242、CEA、PSA、Free-PSA;饮酒则会对AFP结果有影响;吸烟与CA199指标升高有关, 是其独立危险因素。另外, 类风湿因子、异噬性抗体、医源性诱导的抗鼠IgG的抗体、标本溶血等因素也会影响肿瘤标志物的检测结果。
肿瘤标志物是反映肿瘤存在的化学类物质。许多肿瘤标志物并非肿瘤组织特异表达, 正常组织及良性疾病中亦有表达;此外一种肿瘤可分泌多种肿瘤标志物, 而不同的肿瘤或同种肿瘤的不同组织类型也可分泌相同的肿瘤标志物, 且在不同的肿瘤患者体内, 肿瘤标志物的质和量变化也较大, 所以目前为止肿瘤标志物的检测尚不能替代组织病理学和影像学等临床检查作为肿瘤疾病判断的金指标[8]。对于阳性检测结果, 应定期复查, 动态观察, 特别是检测值略高于参考值者, 不要做出过度反应, 以免造成不必要的经济和思想负担[9]。对于肿瘤标志物阴性者, 也不完全代表不会发生肿瘤, 出现临床症状后, 应及时通过其他医学手段进行检查[10]。12种肿瘤标志物蛋白芯片检测结果阳性者与临床肿瘤诊断符合率较高, 该方法可用于临床肿瘤的早期筛查与复发检查, 尤其是肿瘤高危人群的防癌普查具有重要意义。
参考文献
[1] 刘小玲, 马珏欣. C-12蛋白芯片检测系统的临床检测系统的临床应用价值.国际检验医学杂志, 2015, 36(6):798-800.
[2] 杨琴, 于本章, 许静, 等.多肿瘤标志物蛋白芯片技术临床应用价值探讨.上海预防医学杂志, 2005, 17(6):282.
[3] 钟春生, 张倩茹.多肿瘤标志物蛋白芯片检测系统在肿瘤诊断中的应用.安徽医学, 2004, 8(2):109-110.
[4] 李心河, 单宁宁, 高扬, 等.多肿瘤标志物蛋白芯片检测系统在临床应用中的评价.中华检验医学杂志, 2009, 24(7):523-526.
[5] 郭晓英, 王晓静, 李剑华.体检者及患者多肿瘤标志物蛋白芯片检测结果分析.国际检验医学杂志, 2016, 37(1):125-126.
[6] 王晓飞, 王玉洁.多肿瘤标志物蛋白芯片检测系统在消化道恶性肿瘤的临床应用价值.中国实验诊断学, 2011, 15(7):1111-1113.
[7] 陆汉魁, 季红, 朱瑞森, 等.多肿瘤标志物芯片检测法与化学发光分析法的对比实验研究.标记免疫分析与临床, 2005, 12(2):93-96.
[8] 李湘英.肿瘤标志物联合检测在消化道恶性肿瘤中的应用.国际检验医学杂志, 2012, 33(19):2415-2417.
[9] 徐涛, 侯天文. 75例男性老年人连续3年健康体检肿瘤标志物结果分析.中华保健医学杂志, 2014, 16(1):41-42.
[10] 陆峰, 郑延松.肿瘤标志物的临床意义.中国误诊学杂志, 2010, 10(19):4552-4554.
[收稿日期:2016-06-21]
