晶状体悬韧带异常致急性继发性闭角型青光眼的临床特点及其治疗方法的探讨
2018-10-31倪锦萍马继伟
徐 科 ,刘 驰 ,曾 焱,倪锦萍,马继伟
(1.沈阳市第四人民医院 眼科,辽宁 沈阳110031;2.塔城市人民医院 眼科,新疆 塔城 834700)
青光眼是全世界失明的主要原因之一[1]。当误诊或者未进行及时有效治疗时,它会导致不可逆的视力丧失。在临床工作中常会遇到双眼前房深度不对称的急性闭角型青光眼,临床表现特征是严重的眼痛,头痛,眼压升高和前房极浅,易与急性原发性闭角性青光眼(acute primary angle-closure glaucoma, APACG)急性发作期的临床表现相混淆,但是通过完善临床检查,往往发现是由于晶状体悬韧带异常引起的急性继发性闭角型青光眼(acute secondary angle-closure glaucoma, ASACG),若一旦误诊按照APACG进行治疗,传统的抗青光眼手术如YAG激光虹膜切开术、小梁切除术等由于没有针对晶状体悬韧带异常这一致病因素进行治疗,往往不能有效控制眼压,亦或由于玻璃体疝和顽固性浅前房等出现较多的术中和术后并发症,导致治疗效果不理想,增加患者痛苦,降低生活质量[2-3]。本文收集沈阳市第四人民医院眼科于2016年4月至2018年5月收治的晶状体悬韧带异常导致临床表现为双眼前房深度不对称的ASACG患者25例(25只眼),对此类病例的临床特点及手术治疗方式进行探讨,分析报告如下。
1 资料与方法
1.1 一般资料
收集沈阳市第四人民医院眼科2016年4月至2018年5月收治的临床表现为双眼前房深度不对称的急性继发性闭角型青光眼25例(25眼),均为晶状体悬韧带异常,包括隐匿性晶状体不全脱位(occult subluxation of lens) 15例,晶体悬韧带松弛(relaxation of ciliary zonule) 10例;男9例(9眼),女16例(16眼);年龄47~60岁,平均(57.24±6.42)岁。既往眼外伤史5例(5眼),视网膜色素变性1例(1眼),高度近视2例(2眼)。
1.2 术前检查及治疗
所有收治患者均表现为患眼视力急剧下降,剧烈眼痛、头痛伴恶心呕吐等典型急性原发性闭角型青光眼症状。国际标准对数视力表测定最佳矫正视力(best corrected visual acuity, BCVA)视力为手动~0.1。Goldmann压平眼压计测量眼压为 40~65 mmHg(1 mmHg=0.133 kPa),平均值(50.12±6.51)mmHg。裂隙灯显微镜检查可见患眼表现为不同程度的角膜雾状水肿,前房深度较对侧眼明显变浅,瞳孔散大强直,晶状体呈不同程度混浊。IOLMaster测量角膜曲率及眼轴长度,并计算人工晶状体(intraocular Lens, IOL)度数。眼部B超检查除外葡萄膜炎及眼部占位病变。超声生物显微镜(ultrasound biological microscope,UBM)测量中央前房深度(central anterior chamber depth,CACD)、房角开放程度以及晶状体赤道部到睫状体的距离。其中患眼CACD为1.01~1.45(1.18±0.12)mm,对侧眼CACD为2.19~2.51(2.38±0.91)mm。UBM证实全部患者双眼前房深度不对称,患眼前房均较对侧眼明显浅。所有收治患者25例(25眼)均按照急性闭角型青光眼急性发作期治疗原则,排除用药禁忌,给予全身及局部用药控制眼压,15例(15眼)眼压恢复至正常;10例(10眼)应用药物后眼压控制不良,充分清洁结膜囊后给予患眼前房穿刺术,其中8眼眼压降至正常,2眼穿刺后眼压再次升高。眼压控制角膜恢复透明后行裂隙灯下前房角镜及前置镜检查,全部患眼可见不同程度的虹膜及晶状体震颤,前房角均为窄角,其中23眼前房角关闭<180°,2眼前房角关闭>180°,患眼眼底视盘颜色淡红,边界清晰,杯盘比约0.2~0.4,未见明确青光眼特征性视神经萎缩征象。隐匿性晶状体不全脱位诊断依据:CACD浅,虹膜及晶状体震颤,UBM显示各方向晶状体赤道部到睫状体的距离不等。充分快速散瞳后裂隙灯显微镜前坐位及手术显微镜下仰卧位可见晶状体悬韧带离断的范围。晶状体悬韧带松弛诊断依据:CACD浅,眼球转动时出现虹膜及晶状体震颤,UBM显示各方向晶状体赤道部到睫状体的距离基本一致。充分快速散瞳后裂隙灯显微镜前坐位及手术显微镜下仰卧位可见中央前房加深,未见明确晶状体悬韧带离断。
1.3 手术方式
1.3.1 术式选择:根据晶状体悬韧带松弛程度及断裂范围分为3组,选择不同手术方式。A组(轻度异常):10眼 (40.0%)晶状体悬韧带松弛以及7眼 (28.0%)晶状体悬韧带离断范围<90°,进行晶状体超声乳化吸除+前房角分离+IOL囊袋内植入术。B组(中度异常):4眼(16.0%)晶状体悬韧带离断范围位于90°~180°之间,进行囊袋拉钩辅助晶状体超声乳化吸除+前房角分离+囊袋内张力环(capsular tension ring, CTR)植入+IOL囊袋内植入术。C组(重度异常):4眼(16.0%)晶状体悬韧带离断范围>180°,进行囊袋拉钩辅助晶状体超声乳化吸除+前部玻璃体切除+IOL睫状沟悬吊缝合固定术。
1.3.2 手术方法:(A组)晶状体超声乳化吸除+前房角分离+IOL囊袋内植入术: 0.5%盐酸丙美卡因表面麻醉,制作透明角膜隧道切口,粘弹剂支撑下连续环形撕囊,直径约5.5~6.0 mm,撕囊尽量居中,充分水分离。低流量低灌注下超声乳化吸除晶状体核及皮质。粘弹剂填充囊袋后植入可折叠式IOL,粘弹剂钝性分离前房角后吸除前房和囊袋内残余的粘弹剂,前房内注入少量卡巴胆碱缩瞳,水密角膜隧道切口。(B组) 囊袋拉钩辅助晶状体超声乳化吸除+前房角分离+CTR植入+IOL囊袋内植入术:2%利多卡因球后麻醉,制作角膜切口及连续环形撕囊,根据悬韧带离断范围选择使用数个囊袋拉钩,经角膜缘隧道切口进入前房并辅助牵拉晶状体前囊口边缘,维持固定囊袋至居中稳定,充分水分离后超声乳化吸除晶状体核及皮质。前房内存在玻璃体者,先行前房内玻璃体切除。注入粘弹剂填充囊袋后,将CTR一端经切口自囊袋口送达囊膜赤道部,顺时针轻推并旋转,当CTR外端达角膜缘切口时,用镊子夹住末端推压送入囊袋,最后囊袋内植入可折叠式IOL,剩余操作步骤同A组。(C组) 囊袋拉钩辅助晶状体超声乳化吸除+前部玻璃体切除+IOL睫状沟悬吊缝合固定术:球后麻醉至超声乳化吸除晶状体核及皮质同B组。玻璃体切割头完整去除囊袋同时切除前部玻璃体。10-0聚丙烯线双袢缝合固定可折叠式IOL于对称的角膜缘后1.5 mm板层巩膜瓣下,前房内注入少量卡巴胆碱缩瞳,密闭角膜隧道切口。
1.4 观察指标
1.4.1 视力:术前及术后3个月随访的最佳较正视力(BCVA)(LogMAR)。
1.4.2 眼压:术前及术后3个月随访的Goldmann压平眼压。
1.4.3 前房深度:术前及术后3个月随访的利用UBM测定的CACD平均值。
1.4.4 前房角开放程度:术前及术后3个月随访的利用UBM测定的前房角开放程度指标,前房角开放距离500(angle opening distance at 500 μm, AOD500): 距巩膜突500 μm的巩膜内缘处为A点,做A点与巩膜突的连线,于A点做该连线的垂直线交虹膜于B点。点A、B间的距离即为AOD 500。
1.4.5 并发症:观察术中有出现灌注液逆流综合征,术后人工晶状体居中性,有无发生恶性青光眼,囊袋收缩及后发性白内障等并发症。
1.5 统计学方法
采用SPSS22.0统计分析软件对获得数据进行统计学分析。BCVA均由小数视力转化为最小分辨角的对数(logarithm of mininal angle resolution, LogMAR)视力进行统计分析。术前双眼CACD以及术前、术后患眼BCVA(LogMAR)、Goldmann压平眼压、CACD、AOD500比较均采用配对t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 视 力
术后3个月随访时,A组术眼BCVA (LogMAR)为0~0.52,平均0.23±0.13;B组为0.22~0.52, 平均0.36±0.13;C组为0.30~1.00, 平均0.59±0.29, 与各组术前相比明显降低,差异均有统计学意义(P均< 0.05)。见表1。
2.2 眼 压
术后3个月随访时,未应用降眼压药物情况下所有术眼眼压均控制正常,A组患眼眼压为10~16 mmHg, 平均(12.82±1.85)mmHg; B组为15~18 mmHg, 平均(16.50±1.29)mmHg; C组为11~15 mmHg, 平均(13.25±1.70)mmHg, 与各组术前相比明显降低,差异均有显著统计学意义(P均<0.01)。见表1。

表1 手术前后视力及眼压比较
2.3 前房深度和房角开放程度
UBM显示所有患眼术前CACD为1.01~1.45 mm, 平均(1.19±0.12)mm。对侧眼CACD为2.19~2.51 mm, 平均(2.38±0.09)mm, 双侧眼CACD进行配对t检验,结果表明差异有显著统计学意义(P<0.01)。见图1A和B。
术后3个月随访时,A组术眼CACD为2.94~3.74 mm, 平均(3.29±0.24)mm; B组为3.07~3.61 mm, 平均(3.43±0.24)mm;C组为3.58~3.72 mm, 平均(3.64±0.06)mm, 与各组术前相比明显加深,差异有显著统计学意义(P均<0.01)。见表2,图1C。
术后3个月随访时,A组术眼AOD500为0.429~0.610 mm, 平均(0.531±0.055)mm; B组为0.539~0.613 mm, 平均(0.569±0.032)mm; C组为0.586~0.607 mm, 平均(0.595±0.009)mm,与各组术前相比前房角开放程度明显增大,差异有显著统计学意义(P均<0.01)。见表2,图1C。
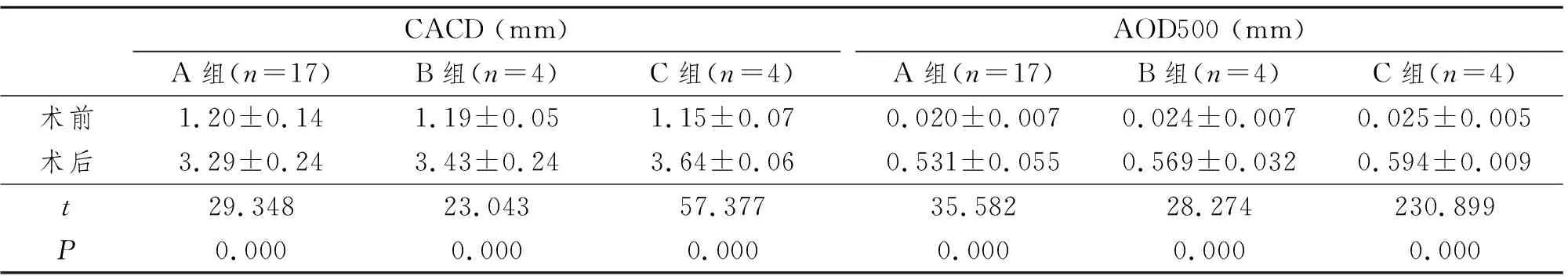
表2 手术前后CACD及AOD500比较
2.4 并发症
术中所有患眼均未出现灌注液逆流综合征,术后所有患眼均未发生恶性青光眼。术后A组中3眼3个月随访时出现后发性白内障,行YAG激光后囊膜切开术,B、C组各l眼随访3个月时发现IOL轻度偏位。
3 讨 论
3.1 晶状体悬韧带异常导致ASACG的早期诊断及鉴别诊断
晶状体悬韧带异常的常见原因包括外伤性或医源性悬韧带损伤、假性剥脱综合征、马凡综合征、同型胱氨酸尿症、马切山尼综合征、无虹膜、视网膜色素变性或眼内肿瘤等[4-6]。有学者报道悬韧带离断引起晶状体不全脱位甚至全脱位的患者83%继发闭角型青光眼[7]。分析其原因:隐匿性不全脱位的晶状体向前不规则压迫虹膜造成周边前粘连,引起同位急性房角关闭继发青光眼;损伤刺激小梁网产生炎症,水肿,变性,色素大量脱失使房水排出通道机械性阻塞;睫状体的机械刺激引起神经血管反射,房水分泌增加。也有学者报道双侧单独的微球型晶状体悬韧带松弛继发急性闭角性青光眼[8]。悬韧带松弛由于炎症或退行性改变,机械性伸长变薄,弹性降低而变得松弛,晶状体在自身囊袋收缩力的作用下前凸,在低头、俯卧或遇到轻微外力时,都可使晶状体虹膜隔突然前移,前房普遍变浅,前房角关闭,眼压升高[9]。晶状体悬韧带异常引起的ASACG临床表现类似APACG的症状和体征,突发的眼部剧痛,视力骤降,剧烈头疼,眼压极高,角膜严重水肿,中央前房显著变浅,周边前房消失,但两者发病机制以及治疗原则却相差千里。并且晶状体悬韧带异常引起的ASACG常常发生在前房偏浅的群体,在前房较深的人群中晶状体悬韧带造成的位置异常不易引起瞳孔阻滞,所以晶状体悬韧带异常引起的ASACG常误诊APACG,若按APACG进行治疗,由于晶状体悬韧带异常的因素常常被忽视而导致治疗效果不理想。尤其是夜间急诊的收治患者,不能及时完善UBM检查,且多数患者眼压高、角膜上皮雾状水肿合并后房压力增高很难在裂隙灯显微镜上观察到虹膜及晶状体震颤等典型体征,因此晶状体悬韧带异常因素易被漏诊[10]。因此若在平日的临床工作中发现发作眼前房极浅,且两眼前房深度不对称,类似APACG急性发作期特点的病例,应高度怀疑发作眼晶状体悬韧带异常。
3.2 晶状体悬韧带异常导致ASACG的检查方法及特征指标
CACD已被确定为鉴别APACG和晶状体悬韧带异常引起ASACG的重要临床特征。在中山大学眼科中心的流行病学研究中发现在APACG和晶状体悬韧带异常引起的ASACG患者中,患眼和对侧眼的ACD有显着差异,APACG的受试者中,UBM检查发现发作眼和对侧眼的CACD差值在0.06~0.2 mm,而在晶状体悬韧带异常引起的ASACG的患者中,双侧眼间差值在0.57~1.65 mm[10]。而我们的研究中晶状体悬韧带异常引起的ASACG的患者中,CACD发作眼与对侧眼间的差值在0.77~1.40 mm,也证实CACD的重要性。这些研究结果表明,对CACD进行更加细致的评估可能会对晶状体悬韧带的状态进行更深入的了解,这可能就会防止最初的误诊。同时我们的研究中UBM检查还显示,在晶状体悬韧带异常引起的ASACG患者中,AOD500发作眼与对侧眼间的差值在0.18~0.30 mm, 这也就意味着发作眼与对侧眼房角开放程度显著不对称。相比之下,通常APACG患者都是双眼房角狭窄。这也表示ASACG房角开放程度的差异可能也是由于晶状体悬韧带异常造成的。
UBM的检查不仅在CACD的定量评估中发挥了重要作用,而且在评估晶状体悬韧带结构完整性方面也发挥了重要作用。UBM是一种用于记录隐匿性晶状体悬韧带损伤的有效方法[7,11]。在我们的研究中,UBM通过量化晶状体悬韧带松弛或者离断的位置和范围以及房角开放程度同时联合控制眼压下的快速散瞳检查为我们提供了选择手术方法的客观依据。
3.3 晶状体悬韧带导致ASACG的个体化手术治疗的选择
手术方式选择与晶状体悬韧带松弛或者离断的位置和范围密切相关。本组25例患者根据晶状体悬韧带松弛或者离断的位置和范围的不同程度分成3组,分别采用晶状体超声乳化吸除+前房角分离+IOL囊袋内植入术,囊袋拉钩辅助晶状体超声乳化吸除+前房角分离+CTR植入+IOL囊袋内植入术,囊袋拉钩辅助晶状体超声乳化吸除+前部玻璃体切除+IOL睫状沟悬吊缝合固定术。短期结果表明,3种方法均有效且并发症少,并且还显示了个体化手术设计的合理性。但应注意1例IOL在囊袋拉钩辅助CTR植入超声乳化术中术后3个月出现轻度偏位,表明囊袋拉钩辅助CTR植入辅助超声乳化术是可行的,但并不完美。此外,在手术过程中应该全面使用一些技术,防止对已经受损的悬韧带进一步损害,例如使用分散性粘弹剂,使用双手撕囊,应用精巧细致的水分离,并且更多地利用先进的碎核技术使较硬的核变得更小,以最小化囊袋顺应力切线方向进行撕囊及应用可折叠IOL[12-15]。并且应该注意的是,IOL最好是三片式可折叠型,因为它具有更强的张力,其中一个IOL袢接触点应放置在悬韧带异常区的中点,另一个袢接触点位于相反的位置,这样的处理虽然减少了对一个接触点的支持,却可以减少悬韧带异常区的扩大。关于晶状体切除术联合前部玻璃体切除术,我们采用囊袋拉钩辅助牵拉前囊口,稳定悬韧带异常处的囊袋结构完整,可以在保持囊袋完整的同时切除核和皮质,从而防止晶状体碎片掉到玻璃体腔,然后通过前部玻璃体切除术完整去除囊袋。
虽然选择原则不能一概而论,但手术方式的选择基于以下理解:囊袋拉钩辅助晶状体超声乳化是术前悬韧带离断范围<180°时的首选。使用CTR后最常见的长期并发症是确实存在一些难以吸除的外周剩余皮质和后囊膜混浊[16],因此标准CTR没有优于囊袋拉钩的优势。在由囊袋拉钩辅助植入IOL后,建议通过Cionni和Osher[17]描述的反弹测试来测试IOL稳定性。如果IOL在轻度的偏心和移动过程中不能自行恢复到中心位置或者说悬韧带异常区>180°,则优选植入可调整缝合的CTR并将其缝合在悬韧带异常区的睫状沟的中,而不是缝合IOL袢相接触的囊袋,因为缝合囊袋难度大并且增加了悬韧带异常区扩大的风险[18]。对晶状体悬韧带异常范围更大的患者,剩余悬韧带力量通常难以支撑人工晶状体,此时可考虑选择IOL悬吊术,术后患者眼压可控制正常且视力明显改善,由于缺少全面的支撑,IOL呈现不同程度的倾斜偏位[19]。
晶状体悬韧带异常引起ASACG患者多急性发作,病程较短,房角关闭多为暂时性,房角并未产生永久粘连。晶状体超声乳化过程中,在持续低流量灌注压下,前房加深,可使部分粘连的房角重新开放[20]。同时应用高粘滞性和拟塑性的粘弹剂, 360°分离房角,充分发挥其 “软性手术器械”的作用,使房角进一步开放,并具有操作简单、创伤小等特点。本研究术后房角均恢复功能,眼压控制良好,避免了滤过性手术带来的一系列并发症[21]。
总之,本研究表明,临床中晶状体悬韧带异常导致的ASACG患者的临床表现与APACG极其相似,必须正确识别其双眼前房深度不对称的临床特点加以鉴别,减少误诊。建议完善UBM检查,同时在眼压控制的情况下完善散瞳后裂隙灯检查,根据晶状体悬韧带松弛及断裂程度和范围选择个体化的手术治疗方式,均可获得良好的临床疗效。
