微创保留十二指肠的胰头切除术的相关问题探讨
2018-10-30武帅,仵正
武 帅,仵 正
(西安交通大学第一附属医院,陕西 西安,710061)
近十年,胰腺微创外科发展迅速,微创胰腺手术国内外各大中心均有相关报道[1-2],但对于微创保留十二指肠的胰头切除术,目前仅有个别中心报道[3-7]。1972年Beger及其同事报道了首例保留十二指肠的胰头切除术(duodenum preserving pancreatic head resection,DPPHR),用以治疗慢性胰腺炎及其所致的炎性肿块[8],在切除病变的同时保留消化道的完整性,提高了患者生活质量。随着胰腺外科医师手术经验的积累,出现了各种改良术式[9],如Frey术[10]、Berne术[11],以及为降低十二指肠侧残留胰腺胰瘘发生率,Hatori等[12]、Takada等[13]提出了保留十二指肠的胰头全切除术(duodenum-preserving total pancreatic head resection,DPTPHR)。与Beger手术相比,Frey与Berne的手术操作相对简化,微创手术操作难度亦有所降低。本文现重点探讨微创Beger手术中的相关问题。
微创Beger术式的适应证[8,14]主要为:(1)可耐受全麻手术,无严重心肺疾病及腹部手术史;(2)慢性胰腺炎所致的胰头炎性肿块;(3)胰头部良性肿瘤,尤其与主胰管关系密切、无法局部切除的肿瘤;(4)部分未侵及十二指肠、壶腹区域,有完整包膜的胰头部交界性甚至低度恶性肿瘤。近年,部分中心对于壶腹区域低风险原位癌,选择性行DPPHR-S术(duodenum-preserving total pancreatic head resection plus segment resection of duodenum and CBD)[9,15],即壶腹区域十二指肠切除、胰头全切、胆总管切除术,手术操作复杂。
1 DPPHR的优势与争议
诸多研究[16-17]显示,相较经典胰十二指肠切除术(pancreaticoduodenectomy,PD),DPPHR术后早期并发症少,远期对胰腺内外分泌功能影响小,患者生活质量提高。但Zach等[18]对26例DPPHR术后患者进行长期随访发现,5例发生胆管炎性狭窄,4例肿瘤复发引起狭窄,胆道狭窄平均出现在术后7年,鉴于DPPHR术后较高的再次手术率,其更加支持保留幽门的胰十二指肠切除术(pylorus preserving pancreaticoduodenectomy,PPPD)作为首选手术治疗方式。近期一项多中心RCT研究[19]显示,慢性胰腺炎患者DPPHR或PD术后生活质量均较前提高,两种术式在生活质量、并发症发生率、死亡率方面差异无统计学意义,而Whipple术后再次住院次数更少,治疗效果更加彻底。对于慢性胰腺炎及低度恶性肿瘤,本身为癌前病变或具有恶性倾向,行Whipple术也是较为合适的选择。我们的经验是根据患者胰腺病变特点针对性选择合适的手术方式。对于不能除外胰腺癌的患者,首选PD;对于可除外胰腺癌以胰头炎性肿块、胰管狭窄、扩张伴结石及钙化为特点的慢性胰腺炎,优选DPPHR;对于体积较小的低度恶性肿瘤,如胰腺实性假乳头状瘤、<1 cm的胰头部神经内分泌肿瘤等,我们更多考虑行DPPHR术。
2 微创与开腹DPPHR相比的优势与不足
开腹DPPHR最大的优势在于术者手的触觉可更多地了解病灶性质、判断占位或结石部位,通过留置胆管支架管判断胆管走行位置,避免术中误损伤,甚至可准确了解胰头及十二指肠血管弓的走行特点等,术中可引导术者准确的确认手术路线及解剖层次。其次,开腹手术的传统缝合等操作较容易。微创手术的优势在于具有放大的高倍视野,加强了术野的可视化,机器人还具有立体视觉、直觉操作等优势,有助于精细操作,清晰辨认胆道、十二指肠血供。患者取头高脚低位,自下而上的手术方式有助于胰后隧道的安全建立。但不论腹腔镜抑或机器人辅助DPPHR,由于缺少触觉反馈,需要更多依赖于术前影像学的精准规划,包括术中超声等设备及技术的术中准确定位与诊断,以及更加精细的解剖、缝合操作,这些都对术者、手术团队提出了更高要求。对于分离器械的选择,超声刀良好的切割止血,有助于保持术野清晰[4],但应注意刀头工作面应远离保留的器官组织,并保持在术野内,避免余温引起的副损伤。电凝钩产生的热量较小,副损伤减少,有助于保护胆管等结构,但闭合细小胰管能力较弱,可能增加胰瘘风险[3]。对于微创DPPHR,缺少术中触觉探查、力反馈,不易多次活检,术前诊断十分重要,术中应常规行超声、冰冻检查。术中超声有助于确定病变范围,并对定性诊断有一定帮助。术中冰冻病理证实为良性、低度恶性肿块时,应注意保证切缘阴性;如证实为浸润性恶性肿瘤,则行根治性胰十二指肠切除术。此外,与开腹手术相比,腹腔镜手术更加强调团队配合,需要长时间的训练磨合。各团队的微创DPPHR目前多处于探索与学习曲线中,术后并发症及远期效果尚待进一步研究观察。
3 如何保护胆道及十二指肠的血供
保证DPPHR成功的重要措施之一就是避免术中、术后胆道及十二指肠缺血。胆道及十二指肠的血供由胰十二指肠前后弓组成。沿胃十二指肠动脉向下寻找胰十二指肠上前动脉,胰十二指肠下前动脉一般位于十二指肠水平部上方靠近肠系膜上静脉右侧缘的区域,后动脉弓位于胰头背面,Kocher切口可显露。经典的Beger手术保留前后动脉弓,但残留胰腺较多,胰瘘发生率较高;Takada法[13],即保留十二指肠的胰头全切术,术中离断胰十二指肠上前动脉,但不行Kocher切口,要求完整保护后弓;Kimura等[20]提出保留前后动脉弓的胰头全切除术,对动脉弓悬吊保护,逐一保留其十二指肠分支,靠近胰腺处离断胰腺支,手术难度高。Horiguchi等[21]分析84例CTA结果显示前后动脉弓均可能起主导作用。对于微创DPPHR,我们建议尽可能分离悬吊保护胰十二指肠上前动脉、下前动脉,以应对可能发生的损伤,并作为胰头分离操作的指引,至少保证一侧血管弓的完整。术中保护胰后筋膜完整可有效保护胰十二指肠后弓。强调保护胰十二指肠上后动脉,此动脉起始于胆总管前方,行经胆总管右侧,走向胆总管后方,并且发出乳头动脉[22]。保护此动脉可避免胆管、十二指肠乳头缺血,为此应避免分离胆管与十二指肠之间的“危险区域”[21],注意保留胆管右后背侧的胰腺组织>180度。同时也应注意血管变异,尤其异位肝右动脉,可能与胰十二指肠下后动脉形成共干。如术中发生胆道或十二指肠缺血损伤,则行胆肠吻合或PD。
关于施行DPPHR时是否行Kocher游离有不同的看法。打开十二指肠侧腹膜,分离胰后筋膜与后腹膜的融合筋膜,此手术操作的优势在于可观察胰头后方动脉弓与回流静脉,探查胰头病变,简化手术操作[23]。有学者认为有可能破坏胰后筋膜完整性,增加后腹膜积液发生率,部分病例未形成后动脉弓,可能增加缺血等并发症。笔者于开腹DPPHR术中常规行Kocher游离,但在微创DPPHR术中不推荐行Kocher游离。对于微创手术,由于通过Trocar操作,术者不能像开腹手术那样自如的调整操作角度,有时操作角度不合适,可能增加并发症发生率;同时微创手术多采用头高脚低位,Kocher游离后胰头十二指肠区域本身张力减少,不利于手术操作。我们也注意到彭承宏教授团队[3]报道的机器人辅助DPPHR,采用类似于机器人PD的做法,打开Kocher切口,并未增加手术难度及相关并发症发生率。对于微创下Kocher游离的利弊,尚待更多的临床实践与观察。
4 胰腺断面的处理
最初Beger教授报道的经典Beger手术一般会做两个胰肠吻合。根据现有的报道及笔者经验,尤其微创DPPHR手术,对于十二指肠侧胰腺断面,通常残留胰腺组织很少,很难行胰肠吻合术,应找到主胰管进行缝扎或夹闭,其余残端予以电凝闭合或“8”字缝合[24]。笔者近期开展的机器人Beger术,术前在ERCP下放置胰管支架,术中可辅助快速准确找到主胰管。对于胰颈断端的消化道重建与PD原则基本相同。多项RCT研究对于胰颈断端行胰肠吻合抑或胰胃吻合结论并不统一[25]。近期一项多中心RCT研究[26]认为,胰胃吻合后胃肠道更加接近生理状态,术后可方便进行吻合口的内镜检查,但较胰肠吻合术后A/B级出血增多。彭承宏教授团队[3]报道了34例机器人DPPHR与34例机器人PD的回顾性分析,DPPHR组胰瘘发生率高于PD组,DPPHR组采用胰胃吻合方式,但术后并未发现胰胃吻合口漏,认为胰瘘最可能来自十二指肠侧胰腺断面。笔者推荐根据术者习惯与经验,结合患者情况选择最合适的吻合。
笔者近期开展了5例机器人Beger手术,下面是简要的手术步骤。(1)患者取头高脚低15~20度“大”字位,采用5孔法施术。(2)打开胃结肠韧带,进入小网膜囊,继续向右游离结肠肝区,探查显露十二指肠及胰头表面,解剖Henle干并离断。(3)解剖胰颈下方,显露肠系膜上静脉(superior mesenteric vein,SMV),建立胰后隧道,于十二指肠水平部上方与SMV右侧区域寻找胰十二指肠下前血管,予以保护(图1),悬吊SMV,分离显露部分钩突。(4)解剖胰腺上缘,显露肝动脉及胃十二指肠动脉,向下寻找胰十二指肠上前动脉,予以悬吊保护。(5)术中超声探查病变范围,门静脉上方切断胰颈,胰头向右侧翻起,小心保护胰后筋膜(图2),以胰十二指肠下前血管为标志由胰腺钩突部向胆管方向分离胰腺,注意观察十二指肠走行,发现主胰管后结扎切断,继续向右上方分离,显露胰腺段胆管,注意保留胆管右后背侧的胰腺组织,同时避免能量设备损伤胆管表面的血管网。如果能辨认副胰管,则予以结扎。于胰腺前面沿胰十二指肠上前动脉左侧分离,移除标本(图3),送术中冰冻病理。缝合处理十二指肠侧胰腺断面的出血点。(6)左侧横结肠系膜打孔,距屈氏韧带15 cm左右横断空肠。上提远端空肠,采用改良的Blumgart胰腺导管-黏膜吻合术,薇乔线3针U形贯穿胰腺空肠浆肌层缝合,普理灵缝线连续缝合胰腺前后壁,胰管部位行导管-黏膜缝合前后壁各2~3针(图4)。(7)冲洗,放置引流。
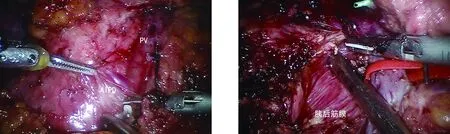
图1 解剖显露门静脉、胰十二指肠下血管图2 胰头向右侧翻起,保护胰后筋膜>(PV:门静脉;AIPD:胰十二指肠下前血管)

图3 切除胰头后术野,主胰管已结扎 图4 胰肠吻合术(ASPD:胰十二指肠上前血管;CBD:胆总管)
结合目前的文献及笔者个人经验,不论腹腔镜抑或机器人辅助下保留十二指肠的胰头切除术目前看来技术上是可行的,短期疗效安全、可靠。微创手术具有放大的视野,操作更精细、安全,但尚缺乏大宗病例的报道,同时微创手术对手术团队的要求更高,与微创PD一样,应在较大的胰腺外科中心开展,术者应具备丰富的胰腺手术经验。术前明确诊断十分重要,应常规行术中超声及术中快速冰冻病理检查。严格手术适应证为慢性胰腺炎、良性或低度恶性肿瘤,同时应有灵活的手术方式,尽量保留器官功能,控制手术损伤。随着外科医师手术经验的积累及材料器械的进步,微创DPPHR会不断地发展成熟。
