CG5033基因在果蝇睾丸中调控生殖干细胞的自我更新和分化
2018-10-30胡兴陈霞颜一丹栾晓瑾于骏
胡兴,陈霞,颜一丹,栾晓瑾,于骏
(江苏大学附属医院妇科,江苏镇江212001)
通常认为睾丸生殖细胞肿瘤可能与生殖干细胞自我更新和分化障碍相关,但具体机制尚不清楚。果蝇睾丸的精子发生过程与哺乳动物睾丸的生精过程相似,而其干细胞微环境结构清晰,可模拟人类正常睾丸生殖干细胞的自我更新和分化过程以及生殖细胞肿瘤的形成过程。
在果蝇睾丸中,早期生殖细胞的自我更新和分化过程严格地受到细胞内源性信号和细胞外信号的共同调控[1-3]。研究表明,中心细胞可分别通过生殖干细胞和体细胞干细胞的膜受体激活JAK-STAT信号通路,从而调控这两类干细胞的自我更新能力[4-5]。值得注意的是,生殖干细胞可分化为包囊细胞,并为生殖细胞提供生长和发育的微环境。有证据表明,在干细胞微环境中,包括中心细胞和生殖干细胞在内的体细胞可分泌骨形态发生蛋白(bone morphogenetic protein,BMP)样细胞因子DPP和GBB蛋白,并通过生殖干细胞的膜受体TKV蛋白激活BMP信号通路,从而抑制分化因子BAM蛋白的表达,进而保持生殖干细胞自我更新的能力[6-8]。在分化的精原细胞中,由于脱离了与中心细胞和生殖干细胞的接触,DPP和GBB蛋白不能激活BMP信号通路,BAM蛋白的表达显著上调,生殖干细胞启动分化过程。
目前,果蝇睾丸生殖干细胞的调控机制依然很不清楚,亟需进一步探索其调控网络以便阐明人非梗阻性无精子症和睾丸生殖细胞肿瘤的发生机制。我们前期的研究通过果蝇UAS-Gal4系统进行大规模的RNAi转基因果蝇筛选,鉴定到多个参与生殖干细胞自我更新的调控因子[9]。本研究探讨CG5033基因在果蝇睾丸干细胞微环境中影响生殖干细胞自我更新和分化过程中的作用。
1 材料与方法
1.1 果蝇品系
UAS-RNAi转基因果蝇购自清华果蝇中心,源自TRiPRNAi转基因果蝇库(Transgenic RNAi Project)。Gal4转基因果蝇品系信息:nos-Gal4(BDSC,#4937),tj-Gal4(DGRC,#104055)。bam-Gal4转基因果蝇品系由陈大华实验室(中科院动物所)赠送。W1118品系果蝇作为野生型(WT)果蝇使用,来源于清华果蝇中心。
保种果蝇和实验用果蝇均在温度25℃、相对湿度60%的条件下饲养。
1.2 主要试剂和仪器
BSA(生工生物工程公司),免疫荧光兔Vasa一抗(1∶1 000,Santa Cruz Biotechnology公司),免疫荧光小鼠眼缺陷蛋白(eyes absent,Eya)一抗(标记成熟的包囊细胞,1∶20)、DE-cad(标记中心细胞和包囊细胞)、1B1一抗(1∶75,DSHB公司),免疫荧光大鼠锌指结构域1蛋白(Zfh1)一抗(1∶5 000,用于标记体细胞干细胞,浙江大学佟超实验组赠予)。免疫荧光488-兔二抗、cy3-小鼠二抗、647-大鼠二抗(美国 Molecular Probes and Jackson Immunologicals公司),Hoechst33342(美国 Invitrogen公司),激光共聚焦显微镜(德国Carl Zeiss Lsm710)。
1.3 果蝇杂交策略
分别挑选nos-Gal4、bam-Gal4及tj-Gal4品系的雄性果蝇,与UAS-CG5033 RNAi品系的处女果蝇进行杂交。在F1代中挑选特定基因型(nos>CG5033 RNAi、bam>CG5033 RNAi及 tj>CG5033 RNAi)果蝇用于后续实验。nos>CG5033 RNAi、bam>CG5033 RNAi和tj>CG5033 RNAi基因型指的是分别在生殖干细胞、分化的精原细胞和包囊细胞中敲减CG5033基因。
1.4 生育率测试
在F1代果蝇中挑选单只特定基因型(Gal4>CG5033 RNAi)的成年雄蝇与3只野生型(W1118)处女蝇杂交,观察其是否可以获得后代果蝇。通过统计F1代单只雄性果蝇生育比例判断雄性果蝇生育能力。4组F1代成年雄性果蝇样本数:野生型组124只,nos>CG5033 RNAi组 91只,tj>CG5033 RNAi组85只,bam>CG5033 RNAi组82只。
1.5 野生型和nos>CG5033 RNAi雄性果蝇睾丸形态观察
将经CO2处理后处于晕厥状态的野生型和nos>CG5033 RNAi雄性果蝇置于盛有1×PBS的解剖皿中,用解剖镊拉出果蝇睾丸,分离周围组织。将睾丸在1×PBS中清洗数遍,然后直接置于盖玻片上,通过光学显微镜观察果蝇睾丸整体结构。
1.6 野生型和nos>CG5033 RNAi果蝇睾丸相对长度测量
根据文献[9]中的方法,通过Image J 1.48软件测量睾丸头部到尾部的最大距离作为果蝇睾丸长度。nos>CG5033 RNAi果蝇组睾丸长度为野生型果蝇组睾丸长度的50%~75%称为小睾丸,微小睾丸是指干预组果蝇睾丸长度小于野生型组睾丸长度的50%。
1.7 免疫荧光染色
取特定基因型果蝇睾丸,用4%多聚甲醛固定20 min后,用含0.1%聚乙二醇辛基苯基醚(TritonX-100)的PBS清洗3次,每次10 min,5%的BSA封闭30 min,加入兔 Vasa、小鼠 Eya、DE-cad、Zfh1一抗于4℃冰箱孵育过夜后再用含0.1%TritonX-100的PBS清洗3遍,除去未结合的一抗,再用相应的二抗[488-兔抗体、cy3-小鼠抗体、647-大鼠抗体(1∶1 000)]在室温孵育1 h,最后用含0.1%TritonX-100的PBS清洗,去除多余的二抗,将睾丸置于普通载玻片,用30 μL 1.0 mg/mL的 Hoechst33342染 DNA 5 min,加入20μL 80%甘油,盖上盖玻片封片。通过共聚焦激光显微镜采集果蝇睾丸免疫荧光图片。
2 结果
2.1 敲减不同细胞CG5033基因对雄性果蝇生育能力的影响
生育率测试结果表明,与野生型组比较,敲减精原干细胞中CG5033基因(nos>CG5033 RNAi组)可导致雄性完全不育(χ2=210.95,P<0.01),而敲减包囊细胞中CG5033基因(tj>CG5033 RNAi组)也可显著降低雄性果蝇的生育能力(χ2=143.02,P<0.01)。bam>CG5033 RNAi组与野生型雄性果蝇组生育率间差异无统计学意义(χ2=0.88,P>0.05)。见表1。

表1 敲减CG5033基因的雄性果蝇生育率测试结果
2.2 在精原干细胞中敲减CG5033基因导致微小睾丸和生殖细胞消失
在光学显微镜下,野生型组均未出现微小睾丸,而nos>CG5033 RNAi组睾丸的形态明显异常,微小睾丸比例达97.65%(83/85)。见图 1。

图1 两种雄性果蝇睾丸形态(光镜)
免疫荧光结果显示,与野生型组睾丸比较,nos>CG5033 RNAi果蝇睾丸中的生殖干细胞完全消失(中心细胞周围一圈细胞Vasa阴性),剩余的生殖细胞也几乎完全消失;睾丸出现了结构性塌陷,充满代偿性增生的包囊细胞(图2)。上述结果表明,CG5033基因可能调控了果蝇睾丸生殖细胞的自我更新过程。
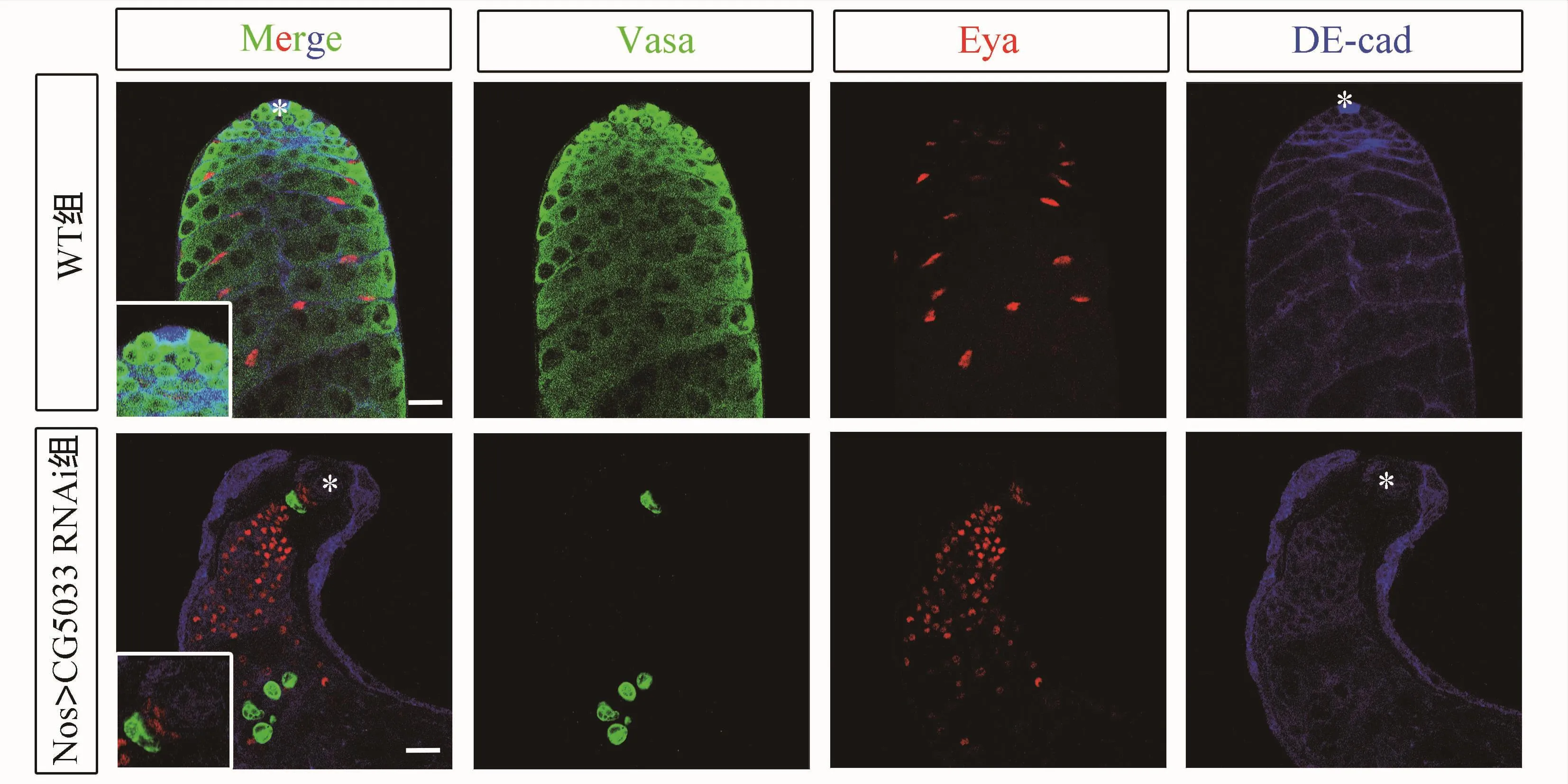
图2 在早期生殖细胞中敲减CG5033基因导致生殖细胞缺陷
2.3 敲减包囊细胞中CG5033基因导致睾丸生殖细胞肿瘤形成
免疫荧光染色结果显示,与野生型果蝇睾丸比较,敲减包囊细胞CG5033基因的雄性果蝇睾丸中出现异常的生殖细胞团块(图3);在tj>CG5033 RNAi睾丸的生殖细胞团中,1B1完全呈现点状分布(图4)。在tj>CG5033 RNAi睾丸中,Zfh 1和 Eya蛋白均未见表达(图5),表明果蝇生殖细胞肿瘤的存活不依赖包囊细胞。
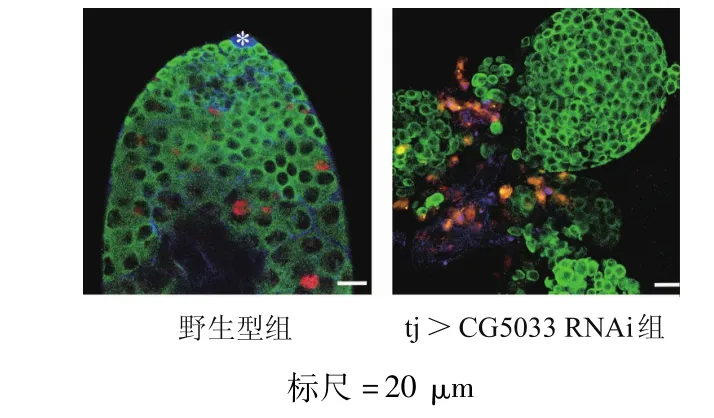
图3 果蝇睾丸生殖细胞肿瘤的表型(免疫荧光染色)

图4 融合体在生殖细胞肿瘤中的表达模式分析(免疫荧光染色)
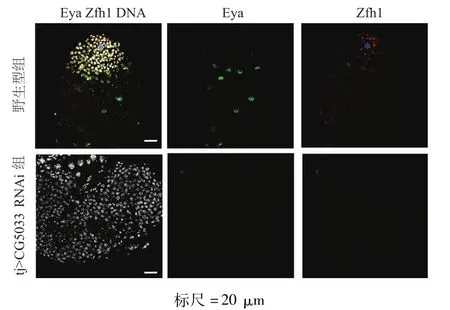
图5 两组果蝇睾丸中Zfh 1和Eya蛋白的表达(免疫荧光染色)
统计结果表明,tj>CG5033 RNAi组睾丸中存在异常生殖细胞团块的睾丸比例达到了86.36%(57/66),这也可能是引起雄性生育功能障碍的重要原因。以上结果表明,睾丸中积累的生殖细胞团块为早期未分化的生殖细胞,并且可不依赖包囊细胞提供的微环境进行生长。
2.4 敲低精原细胞中CG5033基因不影响生殖细胞的自我更新过程
免疫荧光染色表明,bam>CG5033 RNAi组睾丸中存在生殖细胞、包囊细胞和中心细胞,其结构未见明显异常(图6)。统计结果显示,bam>CG5033 RNAi组正常形态睾丸比例为 98.51%(66/67),与野生型组间无明显差异[100%(78/78)]。

图6 敲减精原细胞中CG5033基因不影响生殖细胞的存活
3 讨论
后生动物的组织形态以及细胞的维持和再生都依赖于干细胞发挥作用。果蝇睾丸中存在两种干细胞类型,一类是生殖干细胞,另一类称之为体细胞干细胞,两者对生殖干细胞的自我更新和分化都具有至关重要的作用[10]。然而,这两种干细胞的自我更新和分化能力可被一类从上皮细胞分化而来的体细胞所维持,这类体细胞被称为中心细胞[11]。这3类细胞组成了果蝇睾丸干细胞微环境[12]。生殖干细胞对果蝇的精子发生过程以及生育能力至关重要。目前,干细胞微环境细胞的自主性调控和非自主性调控也是果蝇睾丸发育生物学领域的研究热点。
为了探究CG5033基因与雄性生育能力的相关性,本实验运用3个不同细胞类型中表达的Gal4来驱动UAS-CG5033 RNAi。nos-Gal4主要在生殖干细胞和精原细胞中表达,并在生精过程后期大幅下调[13],而bam-Gal4的表达主要局限在2细胞-16细胞的精原细胞中表达[13-15]。tj-GAL4是体细胞表达的Gal4,主要在包囊细胞中表达。这些Gal4除了表达模式的不同,它们的表达时间和表达水平也具有显著的差异性。Vasa、Eya和DE-cad是果蝇睾丸中常用的抗体,可以在睾丸中标记不同类型的细胞。通过这些标记可观察到果蝇睾丸生殖细胞、包囊细胞以及干细胞微环境的结构。值得一提的是,在干细胞微环境中,中心细胞四周被生殖干细胞(Vasa抗体阳性)和体细胞干细胞(Vasa抗体阴性)包绕。
本研究结果提示,CG5033基因在生殖干细胞微环境中扮演了非常重要的角色。首先,CG5033基因可在生殖干细胞中自主性调控其自我更新能力。在前期的研究中,通过UAS-Gal4系统实现的大规模RNAi筛选实验,我们鉴定到一系列参与调控生殖干细胞自我更新的关键蛋白,CG5033基因也是其中一个重要的调控因子。其次,本研究结果显示CG5033基因还可利用生殖干细胞的非自主性调控发挥作用,主要是通过体细胞干细胞来促进生殖干细胞的分化过程。有研究报道,体细胞干细胞对生殖干细胞的正常分化过程具有重要的调控作用,体细胞干细胞缺陷可以介导生殖细胞的分化阻滞,并导致生殖细胞肿瘤的形成[9,16]。而成熟的包囊细胞缺陷主要影响生殖细胞的维持异常[17]。因此,本实验通过tj-Gal4驱动UAS-CG5033 RNAi介导产生了果蝇睾丸生殖细胞团块的表型。根据我们前期研究推测,这些异常的生殖细胞团块可能是分化过程受阻的生殖干细胞样团块,最终可发展为生殖细胞肿瘤。为了证实这个推测,我们运用1B1抗体观察CG5033基因在这些生殖细胞团块中的表达模式。实验结果证实,这些生殖细胞团块的表型确实是体细胞干细胞影响生殖干细胞的分化过程而导致的。第三,虽然本研究显示CG5033基因主要在睾丸干细胞微环境中发挥作用,但在前期研究中证实了干细胞微环境调控因子可在精原细胞中影响生殖细胞的分化过程,并导致生殖细胞肿瘤形成[9]。本研究利用bam-Gal4驱动UAS-CG5033 RNAi发现睪丸结构并没有明显异常,说明精原细胞中CG5033并不影响生殖细胞的分化过程。
Flybase数据库分析显示,CG5033基因编码的蛋白包含了WD40重复序列的结构域,可结合核糖体蛋白复合体。Demontis等[18]的研究显示,CG5033基因可作为dMyc蛋白转录的报告蛋白,参与Foxo信号通路的调控。多个蛋白复合体组成的调控网络共同参与了干细胞微环境的调控。蛋白合成和降解相关的转录因子在干细胞微环境中可能都参与调节生殖干细胞自我更新和分化[10]。有研究表明,Mei-P26和BAM蛋白在果蝇睾丸中调控早期精原细胞由增殖向分化转变的过程[19-21]。因此,Mei-P26和BAM蛋白也是蛋白翻译机器的重要调控分子。我们推测,Mei-P26和BAM蛋白可能是CG5844的下游调控蛋白。
综上所述,本研究结果显示,CG5033是一个新的干细胞微环境调控因子,可在果蝇睾丸干细胞微环境中通过自主性调控直接影响生殖干细胞的自我更新能力。更重要的是,该基因还可通过体细胞干细胞影响生殖干细胞的分化,最终导致生殖细胞肿瘤的形成。本研究为理解人非梗阻性无精子症和睾丸生殖细胞肿瘤的致病机制提供了实验基础。
