紫杉醇对IL-36γ介导的抗肿瘤作用的影响
2018-10-30鲁翰林宋盈莹申春苹陈晨刘小草冯超卢斌峰朱一蓓孙中文王雪峰
鲁翰林,宋盈莹,申春苹,陈晨,刘小草,冯超,卢斌峰,朱一蓓,孙中文,王雪峰
(1.苏州大学基础医学与生物科学学院,江苏苏州215123;2.苏州卫生职业技术学院医学技术学院,江苏苏州215009;3.苏州大学转化医学研究院,江苏苏州215123)
细胞因子IL-1超家族成员中的IL-36γ可显著促进CD8+T、自然杀伤细胞等抗肿瘤免疫细胞的功能,抑制肿瘤生长[1],但单一的免疫疗法往往并不能彻底抑制肿瘤生长。因此,探讨IL-36γ联合化疗药物实现对肿瘤的协同抑制作用,可推进其在肿瘤治疗中的应用。紫杉醇是临床上常用化疗药物,通常作为有丝分裂的抑制剂,直接杀伤肿瘤细胞并促使肿瘤细胞凋亡[2]。然而,紫杉醇对机体免疫功能也会产生一定的抑制作用。因此,在开展肿瘤免疫治疗的同时,如何合理有效地联合运用紫杉醇等化疗药物,值得探讨分析。
本研究拟借助IL-36γ抗肿瘤的治疗模型,在进一步分析IL-36γ对肿瘤生长抑制特点的基础上,探讨不同剂量紫杉醇对IL-36γ介导的抗肿瘤作用的影响,为采用基于IL-36γ的免疫治疗和化疗药物的联合治疗模式,从策略和方法上提供理论指导。
1 材料与方法
1.1 材料
小鼠黑色瘤B16细胞株(ATCC公司,美国);C57BL/6J 6~8周龄雌鼠购自上海斯莱克实验动物有限公司(动物合格证编号:201800310)。紫杉醇(美国Selleckchem公司);RPMI 1640(美国Hyclone公司);胎牛血清(美国 Gibco公司);限制性内切酶、DNA标准参照物(日本TaKaRa公司);琼脂糖(法国Biowest公司);PCR反应试剂盒(日本TaKa-Ra公司);氨苄西林和DH5α感受态细胞(上海生工生物工程公司);质粒提取试剂盒(北京天根生化科技公司),Trypsin 0.05%EDTA、Lipofectamine 2000、G418(美国Thermo Fisher Scientific公司);RNA提取试剂盒(德国Qiagen公司);逆转录试剂盒、SYBR Green试剂盒(英潍捷基贸易有限公司);真核表达载体pCDEF3由美国匹兹堡大学Lawrence Kane实验室馈赠[1]。
1.2 基因转染细胞株的制备
设计并经金唯智生物科技有限公司合成含有人CD8信号肽序列和具有完全活性的鼠IL-36γ片段(G13至S164)编码区的融合基因片段,将其插入真核表达载体pCDEF3构建成重组表达载体pCDEF3-IL-36γ。通过Bam HⅠ和NotⅠ双酶切插入目的基因片段IL-36γ、PCR检测目的基因片段IL-36γ和基因测序对pCDEF3-IL-36γ进行鉴定。将 pCDEF3-IL-36γ用脂质体常规转染至小鼠黑色素瘤B16细胞株,加入600μg/mL的G418进行加压筛选,待存活的细胞克隆长出后采用有限稀释法进行亚克隆,将亚克隆培养后长出的细胞采用RT-qPCR鉴定目标基因IL-36γ,从而获得高表达IL-36γ的基因转染细胞株 B16-IL-36γ;同时,将空载体 pCDEF3转染B16细胞株,构建成B16-vec作为对照。进一步采用培养和细胞计数法鉴定B16-vec、B16-IL-36γ这2种转染细胞株的生长速度。
1.3 荷瘤小鼠模型的构建和分组处理
将生长至对数生长期且状态良好的B16-vec、B16-IL-36γ细胞于腹部外侧皮下接种C57BL/6小鼠,每组5只,每只小鼠注射2×105个细胞/100μL。在联合紫杉醇进行治疗的小鼠实验中,将B16-vec、B16-IL-36γ细胞按上述方法分别接种C57BL/6小鼠,每种细胞接种4组小鼠,每组5只,在第0,3,7,14,21,28天分别腹腔注射不同剂量紫杉醇溶液100 μL(紫杉醇含量为0,12.5,25,100μg)。
1.4 电子数显卡尺检测肿瘤直径并观察小鼠生存期
小鼠接种肿瘤细胞当天记为第0天,每两天采用电子数显卡尺测量小鼠肿瘤的长和宽,并计算直径。按实验动物伦理委员会审查标准,小鼠肿瘤直径超过20 mm以上即停止进一步测量和实验。按此标准,由于荷瘤小鼠中B16-IL-36γ肿瘤细胞生长速度比B16-vec细胞缓慢,其肿瘤直径的检测时间得以延长一段时间。以B16-vec为对照组,绘制两组小鼠肿瘤生长曲线。
1.5 qRT-PCR检测小鼠肿瘤组织干扰素γ(IFN-γ)mRNA的表达
分别取12.5μg和100μg紫杉醇处理过的B16-IL-36γ肿瘤组织,进行裂解并提取RNA,经逆转录合成cDNA,采用SYBR Green qPCR试剂盒,在95℃预变性5 min,95℃变性30 s和60℃退火1 min条件下进行40个循环,检测IFN-γmRNA的表达量。β-肌动蛋白上游引物:5′-GAAATCGTGCGTGACATCAAA-3′,下 游 引 物:5′-TGTAGTTTC-ATGGATGCCACAG-3′;IFN-γ上游引物:5′-CCTGCGGCCTAGCTCTGAG-3′, 下 游 引 物: 5′-GCCATGA GGAAGAGCTGCA。以 β-肌动蛋白为内参,计算2-ΔCT值。
1.6 统计学分析
数据使用GraphPad Prism 6.0统计学软件进行分析,计量资料采用非配对t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 表达IL-36γ基因转染细胞株的构建及其鉴定
成功构建了重组表达载体pCDEF3-IL-36γ。双酶切和PCR鉴定结果显示,目标基因片段成功插入了载体(图1A和图1B)。进一步的测序结果证实,所插入的目标基因片段序列正确。在此基础上将pCDEF3-IL-36γ用脂质体转染 B16细胞株,通过G418筛选、亚克隆和RT-qPCR鉴定,最终获得高表达IL-36γ的基因转染细胞株B16-IL-36γ(图C)。
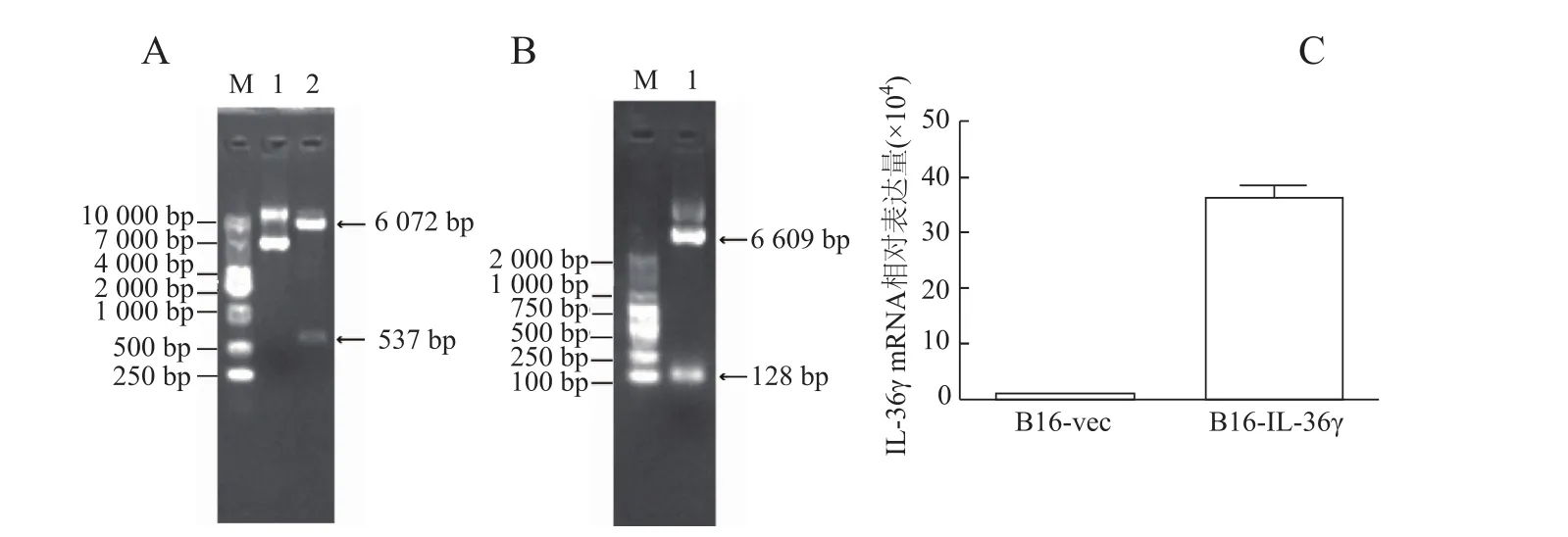
图1 B16-IL-36γ基因转染细胞株的构建及鉴定
2.2 IL-36γ对肿瘤生长及荷瘤小鼠生存期的影响
肿瘤直径测量结果显示,与对照组(B16-vec)相比,B16-IL-36γ分泌表达的IL-36γ能显著抑制肿瘤的生长,在肿瘤接种的第17天,B16-vec组肿瘤直径平均为(19.15±0.70)mm,B16-IL-36γ为(7.15±0.46)mm(t=31.98,P<0.01);同时,B16-IL-36γ表达的IL-36γ能显著延长荷瘤小鼠的生存期。然而,对肿瘤进一步的测量和观察表明,B16-IL-36γ肿瘤在接种的第21天后发生迅速生长,至第33天达到18.48mm,至第52天85%的小鼠死亡;同时对照组在第25天全部死亡。见图2。上述结果说明在肿瘤局部释放的IL-36γ只能在一定时间内延缓肿瘤的生长。
2.3 紫杉醇对IL-36γ介导的抗肿瘤作用及免疫应答功能的影响
联合应用紫杉醇治疗结果显示,紫杉醇对小鼠B16-vec肿瘤的生长未产生显著影响,较高剂量紫杉醇(25和100μg组)在肿瘤生长的后期明显抑制IL-36γ介导的抗肿瘤作用,而较低剂量紫杉醇(12.5μg组)则对IL-36γ介导的抗肿瘤作用产生了一定的协同效应。见图3。
RT-qPCR检测结果显示,与PBS处理的对照组比较,低剂量紫杉醇(12.5μg组)可显著促进B16-IL-36γ肿瘤中IFN-γmRNA的表达,而高剂量紫杉醇(100μg组)则明显抑制了IFN-γmRNA的表达。见图4。

图2 IL36γ对小鼠B16肿瘤直径及荷瘤小鼠生存期的影响
3 讨论
肿瘤微环境中的免疫应答往往处于被抑制状态,采用有效手段恢复、激活肿瘤中浸润淋巴细胞的活性有助于抑制肿瘤进展。细胞因子是免疫系统重要的组成部分,对免疫细胞的活化、增殖和分化具有重要的调节作用。一些白细胞介素如IL-12,IL-15和IL-21等在激活肿瘤中浸润的免疫细胞活性、抑制肿瘤进展方面具有显著效应。
IFN-γ是肿瘤免疫应答中重要的功能性指标,可上调肿瘤细胞的免疫原性,促进CD8+T、Th1等抗肿瘤免疫细胞的功能。IL-1家族成员对IFN-γ、一氧化氮合酶(NOS)、黏附分子等免疫分子的表达具有调控作用。作为IL-1家族成员,IL-36具有 IL-36α(IL-1F6)、IL-36β(IL-1F8)和 IL-36γ(IL-1F9)3种亚型,拥有共同的受体IL-36R。IL-36可通过激活NF-κB和丝裂原激活蛋白激酶(MAPK)途径产生大量的细胞因子、趋化因子、黏附分子、蛋白酶等炎症介质,同时这些调控机体免疫系统的细胞因子也能够发挥抗肿瘤作用[3]。IL-36能激活体内固有和获得性免疫反应,并在调节免疫耐受和自身免疫炎症之间的平衡中发挥关键作用。IL-36也能上调树突状细胞表面的CD80、CD86和MHCⅡ,并诱导树突状细胞分泌 IL-12、IL-1、IL-6、TNF-α和 IL-23。此外,IL-36还能够促进细胞分泌免疫炎症因子IFN-γ等,使浸润肿瘤的T细胞或引流淋巴结中的T细胞分化成具有效应功能的T细胞,从而发挥抗原特异性T细胞抗肿瘤的效应[4-5]。因此,IL-36亚家族成员可有效恢复、激活肿瘤中浸润淋巴细胞的活性,从而有助于抑制肿瘤的进展。
本研究通过制备稳定表达IL-36γ的小鼠黑色素瘤B16细胞株和构建小鼠B16荷瘤模型,阐明了分泌表达于肿瘤中的IL-36γ能显著抑制B16肿瘤的生长,延长荷瘤小鼠生存期。但这种抑制肿瘤生长的效果是暂时的,后期肿瘤仍然迅速生长,这可能与后期IL-36γ激活、诱导的效应性T细胞因免疫卡控点分子PD-1、TIM-3等上调而导致功能耗竭有关,也可能同时与免疫抑制性细胞群体如调节性T细胞、髓源抑制性细胞(myeloid-derived suppressor cells,MDSCs)数量增加而密切相关,其中的详细机制尚待进一步研究。因此,在此基础上,寻求合适的手段与IL-36γ进行联合运用,进一步促进或维持IL-36γ激活的T细胞功能、消除或降低调节性T细胞与MDSCs的抑制作用,对探讨、开辟肿瘤治疗新途径和新方法具有重要的理论指导意义。
紫杉醇具有抑制肿瘤细胞有丝分裂和阻碍纺锤体形成的作用[6-7]。此外,紫杉醇尚具有免疫调节功能。相关文献报道,低剂量紫杉醇对肿瘤微环境中的T细胞、自然杀伤性细胞、树突状细胞等均具有调控作用[8]。因此,在采用IL-36γ进行肿瘤免疫治疗时,给予合适剂量的紫杉醇可能有助于提高IL-36γ抗肿瘤免疫应答作用。但由于化疗药物,特别是在剂量较大的情况下,对机体的抗肿瘤免疫应答具有抑制作用,所以有必要摸索合适的紫杉醇给药剂量,以保证既能在一定程度上发挥其直接的抑肿瘤作用,又能协同促进IL-36γ抗肿瘤免疫应答。
因此,我们进一步探讨了不同剂量紫杉醇对IL-36γ介导的抗肿瘤作用的影响。结果显示,在实验采用的剂量范围内,紫杉醇对无IL-36γ过表达的B16肿瘤生长未产生显著影响。这可能与所采用紫杉醇剂量尚不足以抑制B16生长有关。值得注意的是,较低剂量紫杉醇则对IL-36γ介导的抗肿瘤作用产生了一定的协同效应,这可能与低剂量紫杉醇在一定程度上促进了肿瘤微环境中的T细胞、自然杀伤细胞和树突状细胞的功能有关,也可能与紫杉醇介导了对MDSCs的抑制作用有关,具体作用机制有待进一步研究[9]。然而,较高剂量的紫杉醇对IL-36γ介导的抗肿瘤作用产生了抑制作用,这可能与化疗药物在大剂量存在的情况下,对机体的抗肿瘤免疫应答也同时具有抑制和破坏性作用有关[10]。对肿瘤中IFN-γmRNA表达水平的检测结果也进一步证实了较高剂量紫杉醇对IL-36γ介导的抗肿瘤免疫功能具有抑制作用,而低剂量紫杉醇则对其介导的肿瘤免疫应答具有促进作用。
综上,本研究初步揭示了不同剂量紫杉醇对IL-36γ介导的抗肿瘤作用会产生抑制或协同促进两个相反的影响,这为采用IL-36γ联合化疗药物治疗肿瘤,从策略和方法上提供了理论基础。
