组蛋白脱乙酰酶抑制剂丁酸钠对宫颈癌HeLa细胞增殖与凋亡的影响
2018-10-26罗娟南祖峰罗玲张风莉
罗娟,南祖峰,罗玲,张风莉
1解放军第十五医院妇产科,新疆 乌苏 833000
2解放军69230部队医院门诊,新疆 乌苏 833000
3新疆生产建设兵团农七师125团医院内科,新疆 奎屯 833203
4新疆军区总医院病理科,乌鲁木齐 830000
宫颈癌是一种常见的妇科恶性肿瘤。近年来,随着宫颈细胞学筛查技术的不断提高,宫颈癌的发病率及病死率虽然有所降低,但是发病年龄却呈年轻化趋势[1-3]。与其他肿瘤组织相似,宫颈癌组织呈现较低的组蛋白乙酰化水平,组蛋白的乙酰化主要由组蛋白去乙酰化酶(histone deacetylase,HDAC)与组蛋白乙酰化转移酶(histone acetyltransferase,HAT)调控,因此组蛋白脱乙酰酶抑制剂(histone deacetylase inhibitor,HDACi)成为肿瘤治疗领域的研究热点[4-6]。HDACi包括短链脂肪酸类、氧肟酸类、环形四肽类、苯酸胺类4大类。其中丁酸钠属于短链脂肪酸,具有高效、低毒等特点,不影响正常细胞的活性,因此被逐渐用于肿瘤细胞的治疗中[4-6]。相关研究显示,丁酸钠对宫颈癌HeLa细胞的增殖具有明显的抑制作用[7],但其具体的作用机制尚未明确。因此,本研究将探讨丁酸钠对HeLa细胞增殖与凋亡的影响及其相关机制,旨在为丁酸钠用于宫颈癌的临床治疗提供一定的理论依据。
1 材料与方法
1.1 细胞株
宫颈癌HeLa细胞购自中国科学院细胞库,于含有15%胎牛血清的DMEM培养基中,在37℃、5%CO2条件下培养。
1.2 试剂与仪器
DMEM培养基、胎牛血清均购自美国Gibco公司;兔抗人B淋巴细胞瘤因子-2(bcl-2)、bcl-2相关X蛋白(BAX)、细胞周期蛋白D1(cyclin D1)、p27、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体均购自美国Abcam公司;Annexin V-FITC/PI流式双染试剂盒、BCA蛋白浓度测定试剂盒、细胞周期检测试剂盒均购自南通碧云天生物技术有限公司;ChemiDocTM XRS凝胶成像系统购自美国伯乐公司;FACSCalibur流式细胞仪购自美国BD公司;MK3酶标仪购自美国Thermo公司。
1.3 噻唑蓝(MTT)法检测HeLa细胞活力
取5×103个处于对数生长期的HeLa细胞接种至6孔板中,待细胞贴壁后,加入200 μl终浓度为0、2.5、5.0、10.0 mmol/L的丁酸钠作用细胞24、48、72 h,加入MTT孵育4 h后,小心吸取上清液弃掉后加入150 μl的二甲基亚砜,振荡使结晶物溶解,在570 nm波长处测定光密度(optical delnsity,OD)值,OD570nm值即代表细胞活力。实验重复3次。
1.4 Annexin V-FITC/PI法检测细胞凋亡
取9×103个处于对数生长期的HeLa细胞接种至6孔板中,待细胞贴壁后,加入1 ml终浓度为0、2.5、5.0、10.0 mmol/L的丁酸钠作用细胞48 h,收集1×105/ml细胞,加入结合缓冲液混匀后,继续加入Annexin V-FITC及PI并混匀,1 h内采用流式细胞仪进行细胞凋亡的检测并分析。实验重复3次。
1.5 流式细胞术检测细胞周期
将9×103个处于对数生长期的HeLa细胞接种至6孔板中,待细胞贴壁后,加入1 ml终浓度为0、2.5、5.0、10.0 mmol/L的丁酸钠作用细胞48 h,收集1×105/ml细胞,加入RNase混匀并孵育1 h,再加入PI染液孵育30 min,1 h内采用流式细胞仪进行细胞周期的检测并分析。实验重复3次。
1.6 蛋白质印迹法(Western blot)检测细胞中蛋白的表达
取9×103个处于对数生长期的HeLa细胞接种至6孔板中,待细胞贴壁后,加入1 ml终浓度为0、2.5、5.0、10.0 mmol/L的丁酸钠作用细胞48 h,收集细胞并裂解得到细胞总蛋白,测定蛋白浓度。制作浓缩胶和分离胶,蛋白上样后,进行凝胶电泳,湿法转PVDF膜,脱脂奶粉封闭1 h后,一抗4℃过夜孵育,二抗室温孵育1 h,于凝胶成像系统中曝光。用Quantity One软件分析蛋白条带灰度值,以GAPDH为内参,计算bcl-2、BAX、cyclin D1、p27、PI3K蛋白的相对表达量;以AKT为内参,计算p-AKT蛋白的相对表达量。实验重复3次。
1.7 统计学分析
采用SPSS 17.0-软件对数据进行分析。计量资料以均数±标准差(±s)表示,多组间比较采用F检验,多组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 丁酸钠对HeLa细胞活力的影响
MTT法检测结果显示:与0 mmol/L丁酸钠比较,2.5、5.0、10.0 mmol/L丁酸钠分别作用24、48、72 h后HeLa细胞的细胞活力均明显降低,差异均有统计学意义(P<0.01);不同浓度丁酸钠作用HeLa细胞48、72 h时的细胞活力比较,差异均无统计学意义(P>0.05),因此本研究后续选择48 h作为作用时间。(表1)
表1 不-同浓度丁酸钠作用后HeLa细胞的细胞活力比较(±s)
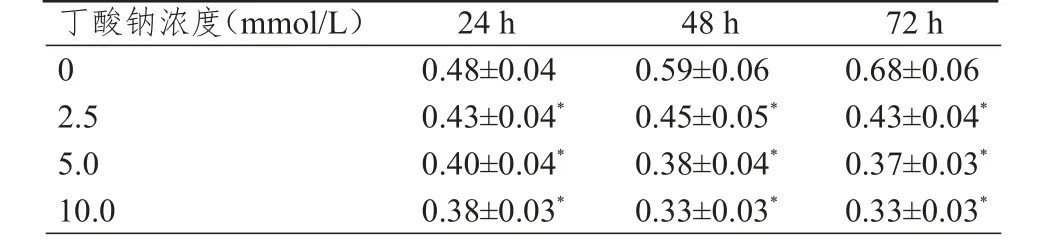
表1 不-同浓度丁酸钠作用后HeLa细胞的细胞活力比较(±s)
注:*与0 mmol/L的丁酸钠比较,P<0.01
丁酸钠浓度(mmol/L)24 h48 h72 h 0 0.48±0.040.59±0.060.68±0.06 2.50.43±0.04*0.45±0.05*0.43±0.04*5.00.40±0.04*0.38±0.04*0.37±0.03*10.00.38±0.03*0.33±0.03*0.33±0.03*
2.2 丁酸钠对HeLa细胞凋亡及细胞周期的影响
采用流式细胞术检测不同浓度丁酸钠作用48 h后HeLa细胞的凋亡及细胞周期情况,结果显示:与0 mmol/L丁酸钠比较,2.5、5.0、10.0 mmol/L丁酸钠作用后HeLa细胞的早期凋亡率和晚期凋亡率均明显增高,G1期细胞所占比例均明显增高,S期和G2期细胞所占比例均明显降低,差异均有统计学意义(P<0.01)。(表2)
2.3 丁酸钠对HeLa细胞中BAX、bcl-2、cyclin D1及p27蛋白表达的影响
Western blot检测结果显示:与0 mmol/L丁酸钠比较,2.5、5.0、10.0 mmol/L丁酸钠作用后HeLa细胞中cyclin D1蛋白的相对表达量均明显降低,BAX、p27蛋白的相对表达量均明显增高,差异均有统计学意义(P<0.01);与0 mmol/L丁酸钠比较,5.0、10.0 mmol/L丁酸钠作用后HeLa细胞中bcl-2蛋白的相对表达量均明显降低,差异均有统计学意义(P<0.01)。(表3)
表2 不同浓度丁酸钠作用后HeLa细胞的凋亡情况及细胞周期的比较(%,±s)
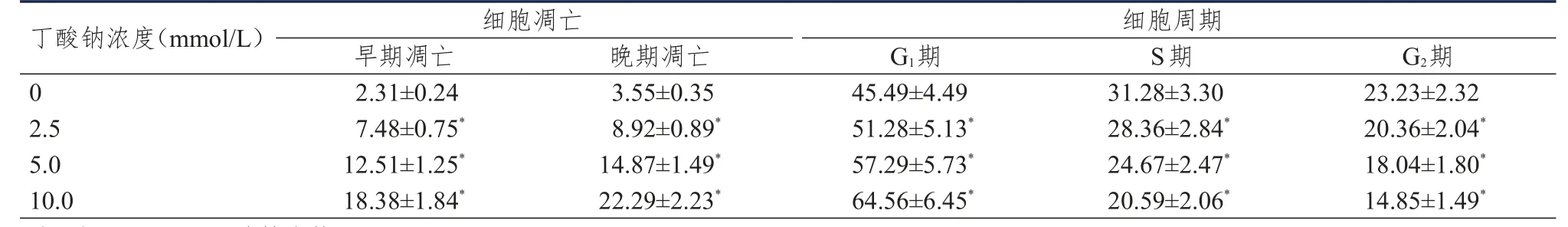
表2 不同浓度丁酸钠作用后HeLa细胞的凋亡情况及细胞周期的比较(%,±s)
注:*与0 mmol/L丁酸钠比较,P<0.01
细胞周期细胞凋亡早期凋亡2.31±0.24 7.48±0.75*12.51±1.25*18.38±1.84*晚期凋亡3.55±0.35 8.92±0.89*14.87±1.49*22.29±2.23*G1期45.49±4.49 51.28±5.13*57.29±5.73*64.56±6.45*S期31.28±3.30 28.36±2.84*24.67±2.47*20.59±2.06*G2期23.23±2.32 20.36±2.04*18.04±1.80*14.85±1.49*丁酸钠浓度(mmol/L)0 2.5 5.0 10.0
表3 不同浓度丁酸钠作用后HeLa细胞中BAX-、bcl-2、cyclin D1、p27蛋白相对表达量的比较(±s)
注:*与0 mmol/L丁酸钠比较,P<0.01
丁酸钠浓度(mmol/L)0 2.5 5.0 10.0 0.58±0.02 0.55±0.02 0.23±0.04*0.10±0.11*0.13±0.01 0.28±0.03*0.72±0.08*1.18±0.12*0.73±0.07 0.42±0.04*0.34±0.03*0.15±0.01*0.13±0.01 0.26±0.02*0.38±0.03*0.40±0.04*bcl-2BAX cyclin D1p27
2.4 丁酸钠对HeLa细胞中PI3K/AKT信号通路相关蛋白表达的影响
Western blot检测结果显示:与0 mmol/L丁酸钠比较,2.5、5.0、10.0 mmol/L丁酸钠作用后HeLa细胞中PI3K、p-AKT蛋白的相对表达量均明显降低,差异均有统计学意义(P<0.01)。(表4)
表4 不同浓度丁酸钠处理后HeLa细胞中-PI3K/AKT信号通路相关蛋白相对表达量的比较(±s)

表4 不同浓度丁酸钠处理后HeLa细胞中-PI3K/AKT信号通路相关蛋白相对表达量的比较(±s)
注:*与0 mmol/L丁酸钠比较,P<0.01
PI3K 0.97±0.09 0.51±0.04*0.35±0.03*0.23±0.02*1.08±0.09 0.83±0.08*0.43±0.04*0.25±0.03*0 2.5 5.0 10.0 p-AKT丁酸钠浓度(mmol/L)
3 讨论
组蛋白的乙酰化水平主要由HDAC与HAT共同调控,二者的失衡,激活下游基因的转录,导致肿瘤的发生,使肿瘤组织呈现低的乙酰化水平[4-6]。HDACi是目前公认的一类高效、低毒、光谱的抗肿瘤新型药物,能够提高染色质组蛋白乙酰化水平,促使肿瘤细胞分化或凋亡[4-6]。丁酸钠作为一种HDACi,是食物纤维在结肠内发酵得到的一种小分子化合物,能够诱导体外培养的肺癌细胞、食管癌细胞、肝癌细胞、宫颈癌细胞等肿瘤细胞的分化、凋亡,并使肿瘤细胞生长阻滞[7-10]。目前,关于丁酸钠对宫颈癌细胞诱导作用的报道相对较少,因此本研究将对此进行阐述。
陈萍等[10]研究结果显示,丁酸钠作用于人食管癌KYSE-150细胞的半抑制浓度(IC50)值为5.6 mmo/L。罗晓华等[7]研究表明,1、2、4、8 mmol/L丁酸钠作用后,能明显降低HeLa细胞的活力。本研究MTT法检测结果显示,与0 mmol/L丁酸钠比较,2.5、5.0、10.0 mmol/L丁酸钠作用HeLa细胞24、48、72 h后,细胞活力均明显降低(P<0.01),但丁酸钠处理48 h及72 h时,对HeLa细胞的作用强度一致,因此本研究后续选择48 h作为作用时间,且本研究的丁酸钠浓度范围与罗晓华等[7]和陈萍等[10]一致,说明在此剂量浓度范围内丁酸钠能明显降低HeLa细胞活力,后续的Annexin V-FITC/PI流式双染实验结果进一步证实,丁酸钠能明显诱导HeLa细胞凋亡。细胞的凋亡受细胞凋亡相关蛋白调控,bcl-2家族中的抑凋亡蛋白bcl-2与促凋亡蛋白BAX结合,可以阻断上游凋亡信号转导,促进细胞存活与生长。而促凋亡蛋白BAX自身还能够形成二聚体,传递上游凋亡信号,最终诱导细胞凋亡。本研究进一步探讨丁酸钠对HeLa细胞中bcl-2及BAX蛋白表达的影响,结果表明丁酸钠能明显上调BAX蛋白表达,下调bcl-2蛋白表达,最终诱导细胞凋亡。细胞周期和细胞凋亡密不可分,细胞周期调控点是细胞增殖与凋亡的双向开关。G1/S期是真核细胞周期重要的检测点,当此调控点缺陷时,DNA修复停止,细胞无法凋亡,同时cyclin D与CDK4/6结合形成复合物,促使Rb磷酸化,进一步诱导E2F3进入细胞核促进增殖相关基因转录,而细胞周期蛋白抑制子p27无法阻挡细胞周期蛋白与CDK的结合,最终促使肿瘤细胞不断复制并恶性化[11-12]。相关研究显示,丁酸钠能够通过上调p21表达并下调CDK7表达,促使HeLa细胞的细胞周期阻滞于G1期[7]。本研究结果显示,丁酸钠能够通过上调p27表达,下调cyclin D1表达,使细胞周期阻滞于G1期,说明丁酸钠能够通过调控细胞周期相关蛋白表达使HeLa细胞周期发生阻滞。
宫颈癌细胞的增殖、凋亡及细胞周期与众多信号通路密切相关,PI3K/AKT信号通路便是其中一种。该信号通路在宫颈癌的发生发展过程中被高度激活,PI3K被激活后,将下游底物二磷酸磷脂酰肌醇的3’羟基磷酸化并使之变成三磷酸磷脂酰肌醇,进而使AKT的丝氨酸-苏氨酸位点磷酸化,活化后的AKT进入细胞核,调控靶蛋白(bcl-2、cyclin D1、MMP等)的表达,最终促进细胞的增殖、侵袭等[13-14]。相关研究显示,丁酸钠能够通过PI3K/AKT信号通路抑制缺血再灌注引起的小鼠神经元凋亡,提示丁酸钠对PI3K/AKT信号通路具有调控作用[15]。本研究继续探讨丁酸钠对HeLa细胞中PI3K/AKT信号通路相关蛋白表达的影响,结果表明丁酸钠能明显下调PI3K及p-AKT的表达。
综上所述,2.5、5.0、10.0 mmol/L的丁酸钠均能明显降低HeLa细胞活力,诱导细胞凋亡,使细胞周期阻滞于G1期,下调bcl-2、cyclin D1蛋白表达,上调BAX及p27蛋白表达,此过程可能是通过阻断PI3K/AKT信号通路实现的。
