性别与心脏性猝死
2018-10-24李艺顾春英
李艺 顾春英
心脏性猝死(sudden cardiac death,SCD)是指急性症状发作后1 h内发生的以意识突然丧失为特征并由心脏原因引起的自然死亡。作为常见的急危重症,SCD正严重威胁着人类的生命。以往观点认为,SCD多发生于合并器质性心脏病患者中[1],如冠心病、肥厚性心肌病、扩张性心肌病、心肌炎等,且大多数SCD为严重快速室性心律失常所致。随着研究的深入,已有学者发现无器质性心脏病者亦可出现SCD[2],且在发病率、病因学乃至致心律失常的电生理机制上存在明显的性别差异。
1 性别与心脏性猝死的流行病学
近年来,越来越多的基础研究与临床证据表明,SCD的发生存在明显的性别差异。Framingham研究显示,在26年随访中,2873例女性中50例发生猝死,2336例男性中146例发生猝死[3]。即便考虑到诸如冠心病、心肌梗死与心衰等危险因素,女性具有更低的SCD发病率以及更高的心脏骤停后存活率。此外,SCD风险随年龄增长而增加,男性SCD风险在任何年龄组均高于女性[4],且女性心脏事件的发病年龄晚于男性10~20年[5]。
一项对SCD幸存者及尸检的病因研究证实,冠心病是SCD最常见的病理改变[6]。其中男性因冠心病致SCD的比例为80%~90%,女性对应比例则为40%~45%。冠心病可使男性发生SCD的长期风险增加3.3倍,而在女性中为增加1.9倍[7]。冠心病致SCD的机制主要是缺血所致的室速及室颤,相比女性而言,罹患冠心病的男性具有更大范围的心肌缺血及瘢痕区域,存在恶性室性心律失常的易感性。除冠心病外,扩张型心肌病、肥厚型心肌病、致心律失常性右室心肌病等器质性心脏病所致SCD的发病率同样存在性别差异[8]。
其他引起SCD的非器质性心脏病,如Brugada综合征、长QT综合征(LQT)、早期复极综合征(ERS)以及特发性室颤患者中,亦表现出显著的性别差异。以Brugada综合征为例,其男女发病比例高达8 ∶1[9]。LQT更多见于女性SCD患者,其致死人数约为男性的两倍。LQT本身不引起任何症状与体征,但在某种条件下可通过早后除极的触发机制,诱发尖端扭转型室速(Tdp),从而危及生命。
在SCD性别差异的原因中,性激素对于心肌不同的电生理效应可能为机制之一,以下将作详细讨论。
2 J波与睾酮
J波与一些室性心律失常的发生关系密切。心室肌内外膜复极1相的电位差是形成J波的必要条件,其离子基础为Ito电流。Ito电流的分布特点如下:心外膜大于心内膜,右室多于左室,左室下壁大于左室前壁。在某些病理条件下,Ito电流增加或其拮抗电流衰减,使得心外膜2相平台期丢失,心室内外膜复极离散度增加,表现为病理性J波。后者可诱发2相折返,继而出现恶性室性心律失常(图1、图2)。
男性性激素为雄性激素,主要包括睾酮、脱氢表雄酮(DHEA)、雄烯二酮和雄酮等,其中,以睾酮的生物活性最强。睾酮的生理作用较为广泛,可影响诸多系统及器官。既往对睾酮的认识以其对生殖过程的影响为主,后来发现睾酮对于代谢亦具有调节作用:它可促进蛋白质合成并抑制其分解;参与水电解质代谢(致水钠潴留);促进肾脏合成促红细胞生成素(EPO),刺激红细胞生成。
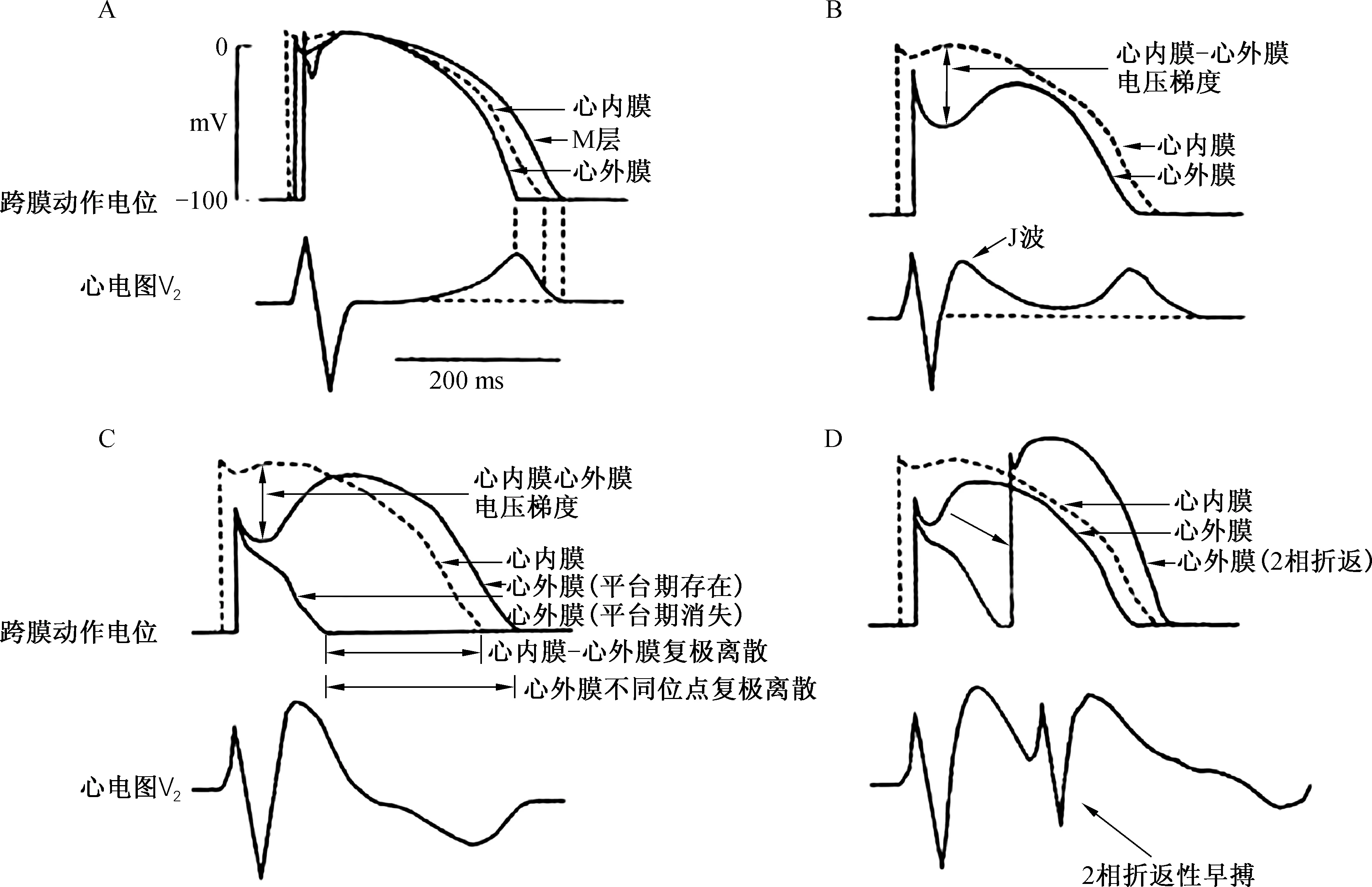
图1 J波形成及2相折返所致心律失常机制Fig.1 The mechanism of arrhythmia induced by J wave formation and 2 phase reentry
近年来,睾酮对于心血管系统的影响研究日益广泛,关于睾酮和硫酸脱氢表雄酮(DHEAs)与冠心病之间的关系的流行病学和临床研究揭示,内源性雄激素在男子体内呈中性,甚至有抗粥样硬化作用,而在妇女体内则起到促粥样硬化作用。同样,外源性睾酮和DHEAs对雄性动物的粥样硬化也呈中性或有益作用,而在雌性动物体内则呈有害作用。亦有研究发现睾酮能够降低高密度脂蛋白胆固醇(HDL-C)水平,而另一些研究发现睾酮对脂蛋白(a)[Lp(a)]呈有益作用。有些研究发现睾酮使低密度脂蛋白胆固醇(LDL-C)水平降低,而未发现Lp(a)水平发生变化。有资料表明,低睾酮血症可能实际上是冠状动脉粥样硬化的一个危险因素[10]。
睾酮对于心肌电生理的影响主要表现如下:① 加快动作电位中复极相;② 促使J波形成或已有J波振幅增大。上述机制分为直接与间接两种形式。
2.1 直接机制
睾酮可增加复极1相Ito电流。已有基础研究证实,雄性犬心肌Ito电流较雌性犬更大。随后在人体心脏研究中得到相同的结果。通过上文对J波形成机制的阐述可知,Ito电流的增强引起的复极2相平台期的丢失,心肌内外膜2相电位离散度增加是J波形成的基础,那么以下临床现象不难解释:① 睾丸癌患者(高睾酮水平)心电图常合并Brugada波样改变,而此现象在术后消失(低睾酮水平);② 与正常男性相比,青壮年男性、黑种人以及高强度训练的运动员(高睾酮水平)中,存在更多早复极心电图改变;③ Brugada综合征多见于青壮年男性(高睾酮水平与离子通道缺陷协同致病)。④ 男性(睾酮水平相对高)下壁合并右室(Ito通道分布密集区域)心肌梗死更易发生难以纠正的室速、室颤。上述试验研究与临床观察均提示,睾酮水平与Ito电流乃至J波(无论原发性或获得性)呈正相关,故后者引起的SCD多见于男性。另外Ito电流的增加将直接缩短动作电位时程[9]。
2.2 间接机制
高睾酮水平常合并相对小的交感张力及大的迷走张力;相反,睾酮水平降低,则可引起交感张力及肾素-血管紧张素-醛固酮(RAS)系统激活,这可能为老年高血压发病机制之一。迷走神经张力增大可使得其末梢乙酰胆碱(Ach)分泌增加,后者则可通过促进乙酰胆碱依赖钾通道(IK-Ach)的表达,导致复极相钾外流增加,复极时相缩短。另外,迷走张力增大所致的自律细胞自律性降低,可引起心动过缓,而J波存在慢频率依赖性,过缓的心率可使原有J波增大,使出现恶性室性心律失常的概率升高。Brugada波本质为J波,以Brugada综合征为例,患病的青壮年几乎均在夜间发生猝死,其机制即在存在基础病变的情况下,夜间迷走张力增大,过缓的心率使得原有的Brugada波增大,从而引起2相折返,诱发室速、室颤,继而发生SCD。
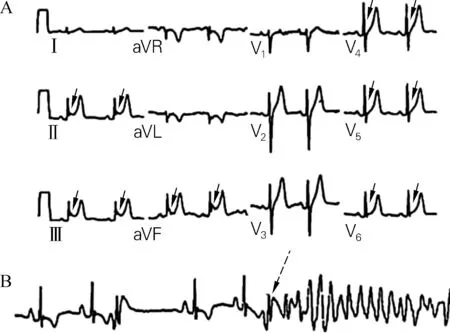
A:同步12导联心电图记录,可见Ⅱ、Ⅲ、aVF导联明显 J波;B:同一患者心电图,可见室性早搏发生,并在一次室性早搏J波显著增大后诱发多形性室性心动过速(如虚箭头所示)
3 LQT与雌激素
通过以上论述不难得出结论,在男性SCD的病因学机制中,雄性激素扮演着不可忽视的角色,尤其是睾酮。相应的机制简要概括如下:男性—睾酮水平高—J波异常风险增加—2相折返—室速/室颤—SCD。
我们常用心率校正QT间期(QTc)反映心肌复极过程及复极储备差异。QTc的长短取决于复极内、外向拮抗离子流的相对强弱,其中外向电流以Ikr为主,Iks为辅;内向电流则主要为L-Ca。任何影响上述离子通道的因素均可改变QTc。如QTC超过正常范围,即会出现LQT。
LQT分为先天性(原发性)与获得性(继发性)两种,前者病因为染色体上基因突变使得心肌细胞表面特定离子通道表达受到影响,从而影响复极时限,以先天性LQT 1型为例,其突变基因为KCNQ1,使得Iks功能丧失,外向复极电流减小,QTc延长。获得性LQT则主要为后天因素所致QTc延长,常见为电解质紊乱(低钾、低钙)、部分药物(Ⅰa、Ⅰc、Ⅲ类抗心律失常药物,三环类抗抑郁药,大环内酯类抗生素等)以及心肌缺血。如前所述,LQT本身不引起任何症状与体征,但过长的QTc可以引起早后除极的发生,同时也为RonT室性早搏创造条件,二者均可诱发恶性室性心律失常而导致SCD,危及生命。
在生理状态下,人类出生时男女QTc相近,青春期后则逐渐表现为女性QTc长于男性,而50岁后男女性QTc再次趋于一致,提示性激素类型以及分泌水平对QTc长短存在一定影响。对于男性而言,性激素以睾酮为主,睾酮对于复极过程中钾通道开放有促进作用,除前文提到的Ito电流外,睾酮亦可通过hERG基因促进Ikr的表达,同时抑制慢钙通道(L-Ca),结果为外向复极电流增大,内向电流减小,继而心肌复极加快,QTc缩短。雌激素的作用则恰恰相反:它可通过调节钾通道及钙通道的活性来延长QTc[9]。上述机制综合作用,使得女性QTc在一定时期内比男性更长。有文献表明,不论男性或女性,高雌激素水平均使心脏性猝死风险升高[11]。
相对长的QTc意味着更长的心肌不应期。因此从某种程度上而言,女性较男性具备更强的复极储备以及抗心律失常能力,但与此同时,其代价也相对昂贵:较长的基础QTc让女性存在更高的LQT易感性,后者可通过早后除极诱发Tdp从而引起SCD。据文献报道,先天性LQT2中女性发病率高达68%。药物引起的获得性LQT所致的Tdp患者中,女性比例显著高于男性:红霉素所致Tdp者女性占70%;索他洛尔所致Tdp者女性为男性的3倍[12]。值得注意的是,Tdp总发病率女性为男性的2倍。有资料表明,女性是Tdp的独立危险因素[13]。图3中女性SCD的病因学机制简要概括如下:女性—雌激素水平高—LQT风险增加—Tdp—室颤—SCD。

图3 QTc间期延长,RonT室性早搏诱发尖端扭转型 室性心动过速(TdP)Fig.3 The prolonged QTc interval and torsades de pointes induced by RonT premature ventricular contraction
4 其他因素
除了性激素对于男女SCD病因学差异的影响外,尚存在其他因素如:① 男性相对女性存在更高的吸烟、酗酒及吸毒比例,上述不良行为均可直接损害心血管系统,提高男性SCD发病率。② 近年来机械性心律失常所引起的心脏震击猝死综合征病例逐渐增多,好发于胸外伤及竞技体育中的暴力身体接触,以男性居多。③ RyR2阳性的儿茶酚胺敏感性多形性室速(CPVT)以男性居多。④ LQT-1所致心脏事件(晕厥、心搏骤停、猝死)以男性居多。⑤ 女性患者房颤是脑卒中和心血管死亡的非常重要的危险因子。⑥ 获得性QT间期延长及伴发的尖端扭转型室速以女性居多。⑦ LQT-2所致的心脏危险事件中以女性居多。⑧ 不明致病基因的儿茶酚胺敏感性多形性室速(CPVT)女性患者死亡率高[9]。⑨ 绝经后女性患者雌激素水平降低与特发性流出道室性心律失常的发生密切相关,且雌激素治疗能有效抑制室性心律失常的发生[14]。⑩ 无症状心室功能不全是男性心肌梗死后死亡的危险因素,但不会增加女性死亡的风险[11]。
5 结论与临床展望
综上所述,部分室性心律失常与LQT发病率的性别差异确实存在,而此类心律失常往往是导致SCD的常见原因,对于其机制的了解可帮助我们更好地制定个体化的临床处置方案。妊娠期间容易发生各种心律失常,机制为雌激素/孕激素水平升高,影响心肌细胞离子通道电生理特性改变,且使得心肌细胞对儿茶酚胺敏感性增加,共同诱发心律失常。先天性LQT发生的心脏事件在产后40周内明显增加,这可能与分娩后雌激素水平升高相关,对于此类LQT患者可在特定时间段密切观察,谨防不良事件;因女性存在获得性LQT及Tdp的易感性,若女性患者合并常见引起获得性LQT的因素,如电解质紊乱、药物及器质性心脏病时,应予以高度重视并及时纠正诱因,避免Tdp甚至室颤的发生;月经周期中雌激素水平与室上性心动过速发病率成反比(相对长的QTc具有一定抗心律失常能力),可为临床及电生理诊断提供一定帮助;绝经后女性房颤发生率升高,对于此类特定人群的诊治更具前瞻性;另外,睾酮对于雌激素依赖LQT的治疗尚处于研究中[9]。
明确性激素与心律失常的相关性及其作用机制,将为心律失常临床个体化治疗提供科学依据及理论基础,同时也为SCD的预防提供新的思路,使得在治疗方面做到有的放矢。
