光动力疗法治疗感染性疾病的动物模型
2018-10-22易雨曦魏若妍冯思嘉吴旸瞿涤
易雨曦,魏若妍,冯思嘉,吴旸,瞿涤
复旦大学基础医学院病原生物学系,医学分子病毒学教育部/卫生部重点实验室,上海 200032
光动力疗法(photodynamic therapy,PDT)是临床上常用于肿瘤治疗的一种新型方法。研究发现PDT对微生物感染亦具疗效,且抗感染效果已在体外实验中得到证实[1-2]。然而,PDT应用于体内治疗的研究较有限,主要原因是缺乏相应的规范化、标准化的动物感染模型[3]。与体外实验相比,利用动物模型可更好地模拟体内细菌感染,检验PDT的安全性及有效性,进而优化治疗参数,但对实验设计也提出了更高的要求。例如,开发对靶组织具有高选择性的光敏剂,优化给光方式,以保证足量的光敏剂能精确到达感染部位等。此外,合理的疗效评价体系对保证实验结果的可信度同样至关重要。本文对用于PDT研究的多种动物感染模型进行综述,以期为PDT体内治疗的研究提供参考。
1 PDT的原理
PDT以特定波长的光源(多为红光,少数用紫外光、白光等)激发对靶组织或细胞(如肿瘤细胞、细菌等)具有选择性的光敏剂,产生单态氧和(或)自由基,攻击靶组织或靶细胞的各种生物大分子,使细胞发生坏死或凋亡,从而达到治疗目的(图1)。

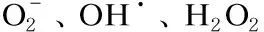
图1PDT作用原理
Fig.1PrincipleofPDT
2 PDT治疗感染性疾病的动物模型及治疗方案
PDT治疗感染性疾病的临床研究与应用涵盖了细菌、病毒、真菌等多种微生物及部分寄生虫。由于不同病原体造成的感染类型不同(皮肤感染、软组织感染、口腔感染、骨髓炎、关节炎等),动物模型的建立需选择不同的实验动物、感染方式及PDT治疗方案。
2.1 实验动物
目前用于PDT体内研究的实验动物多为啮齿类动物,如小鼠、大鼠、豚鼠、沙鼠、新西兰兔等,还包括无脊柱动物蜡螟(Galleriamellonella)。
小鼠是PDT体内研究最常用的实验动物,主要优点是其基因组与人类高度同源,适合与人类进行类比;对其生理学和遗传学已有广泛研究,感染模型的建立也相对成熟;此外,其繁殖迅速,饲养相对廉价。主要缺点是体型较小,处死前可取血及其他体液、组织的量较有限,使感染进展及动物对治疗的反应变得难以监测。生物荧光转基因细菌和光敏成像系统的发展在一定程度上解决了这一问题[4]。在建立PDT小鼠模型中常使用BALB/c品系,少量实验使用C57BL/6、CD1等品系。
大鼠除了具有与小鼠类似的优点外,其较大的体积更便于进行感染病灶的观察和尺寸测量。研究中常使用SD大鼠和Wistar大鼠。此外,豚鼠、沙鼠、新西兰兔及实验犬等也偶有使用。
除以上常见实验动物外,无脊柱动物蜡螟在PDT治疗屎肠球菌和白假丝酵母(又称白念珠菌)感染的体内实验中亦有所应用[5-7]。蜡螟可从细胞、组织、器官多层次体现感染的损伤及PDT疗效,具有易于操作、价格低廉、便于进行统计学分析等优势,常用于研究感染致病机制和治疗方法。但其组织构造与人体存在明显差异,故应用范围较局限。
PDT体内研究实验动物的选择主要与病原体的易感性、所建模型和治疗过程的模拟效果相关。例如,BALB/c株小鼠、长爪沙鼠和黑线仓鼠对利什曼原虫有较好的易感性,因此利什曼原虫感染动物模型常选用仓鼠[8]。
2.2 微生物种类
动物感染模型构建涉及的病原体包括细菌、真菌和寄生虫。其中,细菌较丰富,既有革兰阳性菌(如金黄色葡萄球菌、肺炎链球菌、分枝杆菌等),也有革兰阴性菌(如创伤弧菌、铜绿假单胞菌、鲍曼不动杆菌、大肠埃希菌、流感嗜血杆菌、变形杆菌等);真菌和寄生虫种类则相对较少,前者主要包括白念珠菌和诡谲腐霉[9],后者主要为利什曼原虫。
病原体的来源主要有两类,一类是带有生物荧光标记的稳定遗传基因工程菌株,另一类是自患者体内分离的病原体。后者由于分离自目标疾病(如菌血症[10]、烧伤[11-12]等)患者,且其中部分菌类带有抗药基因,故能更好地模拟临床感染的治疗。其中,模拟牙周病常使用未经分离培养的混合菌样本,较为特殊;或利用动物模型口腔内正常菌群制造机会性感染,不接种外来细菌;或取用患者牙龈上的菌斑样本直接接种。这与疾病本身感染特点相关。
2.3 感染方式
构建PDT体内研究的动物感染模型时,感染方式的选取与模拟的疾病密切相关,后者包括皮肤感染、烧伤、软组织感染、骨髓炎、关节炎、口腔感染、牙周病、中耳炎等,以皮肤感染模型最为多见。
皮肤感染模型多于动物背部皮肤建立伤口后接种菌液,背部浅表伤口使用27G针进行平行刮划[13],切断创口则以切断组织成分类型为标准,分为至皮下蜂窝组织、至肉膜、穿透肉膜(即全层伤口)几种,具体视研究目的而定,将小块组织剪下后接种相应菌液[14]。另一些研究(如真菌、寄生虫和少数细菌)则不直接建立创口,而通过皮下/皮内接种带有病原体的悬液。
烧伤模型的建立大多使用95 ℃预热钢器械,使动物后背皮肤产生非致死性、全层Ⅲ度烧伤病灶,之后接种菌液。建立软组织感染、骨髓炎、关节炎、中耳炎模型的方式较为类似,可直接向目标部位注射菌液。口腔感染则是使用吸收足够菌液的口腔拭子或棉花擦拭动物的口腔或舌背。牙周炎模型可通过使用棉线缠绕下颌第一磨牙牙龈下位置7 d进行诱导[15]。研究发现,此处棉线可导致生物膜积累,预测在7 d内导致附着物和骨质丢失[16]。
2.4 PDT治疗方案
建立感染性疾病动物模型后,对实验动物进行PDT治疗时需考虑的参数包括光敏剂种类、剂量和使用方式,光源波长、光能和给光方式,以及使用光敏剂与给予光照的相隔时间。
2.4.1光敏剂光敏剂种类(包括以卟啉为骨架的去镁叶绿素类和非卟啉染料类,前者研究深入,应用广泛,占PDT抗感染动物模型研究的2/3;后者主要在口腔感染模型中应用较多)和相应剂量的选择较为多样,通常选取体外实验中治疗效果较好的参数进行设置[17]。光敏剂的使用方式与患病部位关系密切。皮肤感染和烧伤模型的建立多数在伤口处局部给药,但基于无法渗透至病灶的可能性,少数研究者选择静脉注射[18],或通过改变溶剂〔如二甲基亚砜(dimethyl sulfoxide,DMSO)[19]〕提高皮肤透过率。骨髓炎、关节炎、中耳炎、口腔疾病及牙周炎模型的建立则通常将药物注射或涂抹至特定病灶内,如骨髓炎注射至骨隧道,关节炎注射至关节腔,口腔感染涂抹至舌背,牙周病在相应牙周浸泡/灌洗等,使光敏剂相对快速且具有部位特异性地到达感染靶点。对其他疾病模型进行治疗涉及腹膜内注射、腹腔注射、静脉注射、肌内注射时,则利用血液循环使光敏剂到达病灶,避免注射对感染靶点组织的损伤,减少干扰。
光敏剂进入机体后需经过一定时间,使感染靶点相对正常组织的药物浓度达到最大,以期得到最佳治疗效果,最大程度减轻不良反应,这一段时间称为“药光间隔时间”。不同光敏剂在不同生物组织中的药光间隔时间不同,需通过预实验确定。
2.4.2光源一般而言,光源波长为所用光敏剂照光时最大吸收峰所对应的波长。研究表明,700~800 nm波长的光波透射普通生物组织的深度为 5~6 mm,故主要以红光(620~750 nm)治疗的PDT多选用仪器要求低、操作简单的表面给光[20],只有极少数实验使用侵入性方法(如组织间隙光纤)照射病灶。除红光外,也有个别研究采用短波长光(400~530 nm)、紫外光、白光等进行治疗。
PDT治疗时光照总能量(fluence rate)的选择与光敏剂、治疗目的、病原体类型等有关,同样需反复摸索。值得注意的是,光照能量过强时不仅可能影响感染伤口的愈合,加重局部炎症,还可能通过增加局部耗氧量降低PDT的疗效,这已在几项研究中得到证实[21-22]。
3 疗效评价参数
评价PDT对动物感染的疗效主要有两个方面:动物感染部位经PDT治疗后的病原体残余量;实验动物的疾病恢复情况。
为测定病原体的剩余量,研究者常运用活体影像技术,或取实验材料(活体组织、相关体液、擦拭表面的拭子)进行细菌培养,另有少数使用荧光显微镜或扫描电子显微镜等观察微生物或生物膜的形态结构改变。 其中,活体影像技术基于菌落产生的生物荧光信号与菌落形成单位(colony-forming unit,CFU)在一定范围内呈近似线性相关,以非侵入方式实现长期实时监测活体内感染情况,可对特定区域的生物荧光图像进行定性观察或定量分析。相关定量指标包括发射光子绝对值、相对光单位(relative light unit,RLU)、RLU曲线下面积(area under curve,AUC)等。而细菌培养适用于菌种未带荧光标记或CFU不在线性范围内的动物模型,可根据培养后的菌落生长特点(如菌落融合或分离等[23])进行评级,也可稀释涂平板后进行CFU计数和比较。
就实验动物的疾病恢复情况而言,一些研究者根据临床表现对治疗结果(如转归、炎症反应强度、器官损伤程度等)进行评分。根据损伤特点,对于致死率较高的感染,生存曲线能相对直观地反映PDT疗效;对于产生开放性创口的疾病(如皮肤感染、烧伤等),可观测伤口愈合情况(如伤口形态、伤口完全愈合时间、伤口面积、间隔特定时间后伤口未愈合面积占比等);对于影响动物运动能力的疾病(如关节炎、骨髓炎),可采用行为学评分;对于利什曼原虫引起的足部感染,可通过测量足垫厚度进行评估。除大体形态外,组织病理切片观察、影像学方法也能反映动物的致病和恢复情况。另有少数研究[24]使用反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)测定不同因子表达的改变,从分子角度探究PDT对机体防御修复机制的影响。也有研究通过检测丙氨酸氨基转移酶(alanine aminotransferase,ALT)、血尿素氮(blood urea nitrogen,BUN)、肌酐在血清中的水平及肝肾的组织学改变,试图评价PDT的毒性[25]。
4 不同感染性疾病动物模型中PDT疗效的研究进展
4.1 皮肤和软组织感染
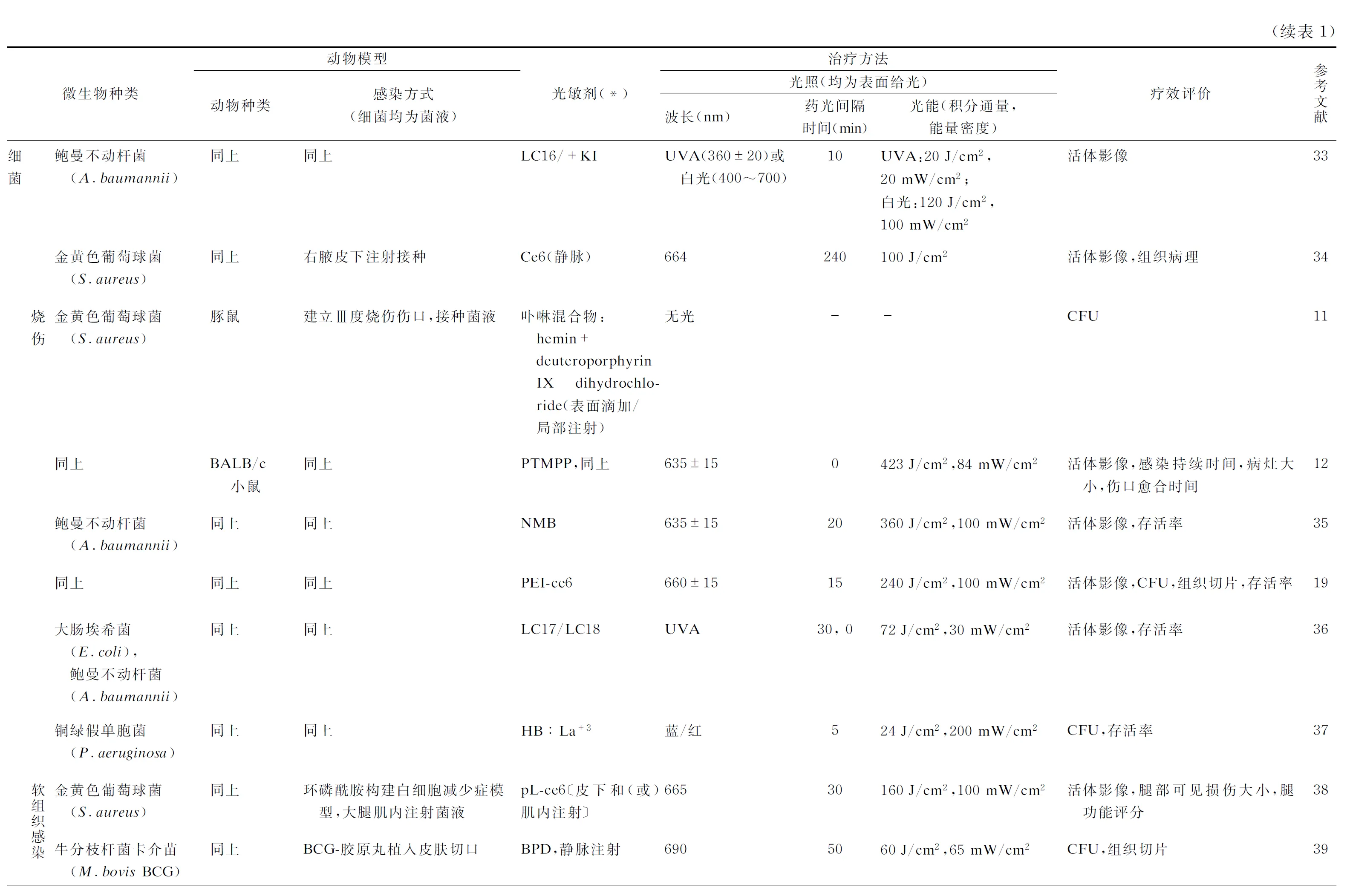
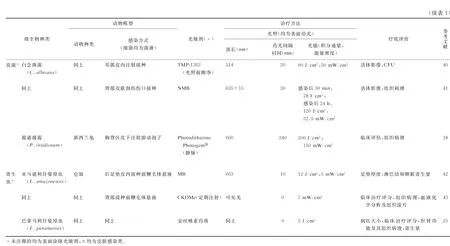
4.1.1皮肤感染皮肤感染类型多样,可由多种细菌、真菌(主要为白念珠菌)、寄生虫(主要为利什曼原虫)等病原体引起。PDT的光敏剂类型多样,所用光源多为窄谱光,偶有宽谱红光或白光。活体影像、伤口的大体和组织病理评价及CFU计数为常用指标,对致死性感染还可统计动物存活率。研究表明,PDT对多数细菌造成的皮肤感染有一定的疗效。有文献显示,与传统抗生素[26]/AgNO3[27]治疗相比,PDT不仅杀菌效果更佳,还能抑制治疗后微生物的再次生长[20],加快伤口愈合,有助于上皮形成、角质化和胶原纤维发育[24,26,28]。对铜绿假单胞菌(ATCC 19660)所致的皮肤感染,单纯使用 BF6 行PDT虽无法使小鼠感染模型存活,但能提高妥普霉素治疗的存活率[29]。对于寄生虫引起的皮肤感染,PDT同样可减少病灶虫体载量。目前对皮肤感染动物模型的研究最广泛,总结详见表1。
4.1.2烧伤烧伤感染的常见细菌包括金黄色葡萄球菌[11-12]、铜绿假单胞菌[37]、鲍曼不动杆菌[19,35-36]等。光敏剂多选用去镁叶绿素类传统光敏剂,也有研究根据需要选用新型光敏剂:如对于抗性较强的铜绿假单胞菌有较好治疗效果的HB∶La+3[37];以富勒烯为核心,对革兰阳性、革兰阴性菌均有较好疗效的改良光敏剂LC18等[36];还可通过结合多聚阳离子链或碘原子等,对光敏剂的选择性、杀菌力、溶解性等进行改良[19,36],均取得了明显疗效。此外,有研究者利用卟啉衍生物的氧化特性,使用两种卟啉混合物,在无光条件下取得了较好的抗感染效果[11](表2)。值得注意的是,不少研究在持续观察中发现感染复发现象,这可能与光敏剂特性及用量、菌株毒力、治疗方案设计(如治疗时机与持续时间、是否结合其他抗感染治疗)等多种因素有关,如鲍曼不动杆菌感染治疗的研究中未观察到复发[19,35]。
4.1.3软组织感染软组织感染包括肌肉感染[38]、皮下结核分枝杆菌感染[39]等。有研究者为更好地模拟临床感染病程,采用环磷酰胺诱导小鼠形成白细胞缺乏的免疫缺陷状态,少量接种金黄色葡萄球菌构建感染模型[38]。除常用评价指标外,还有通过对小鼠腿功能评分进行评价[38](表2)。同样,尽管动物感染模型中PDT疗效较好,但感染复发现象仍存在。


4.2 骨系统疾病
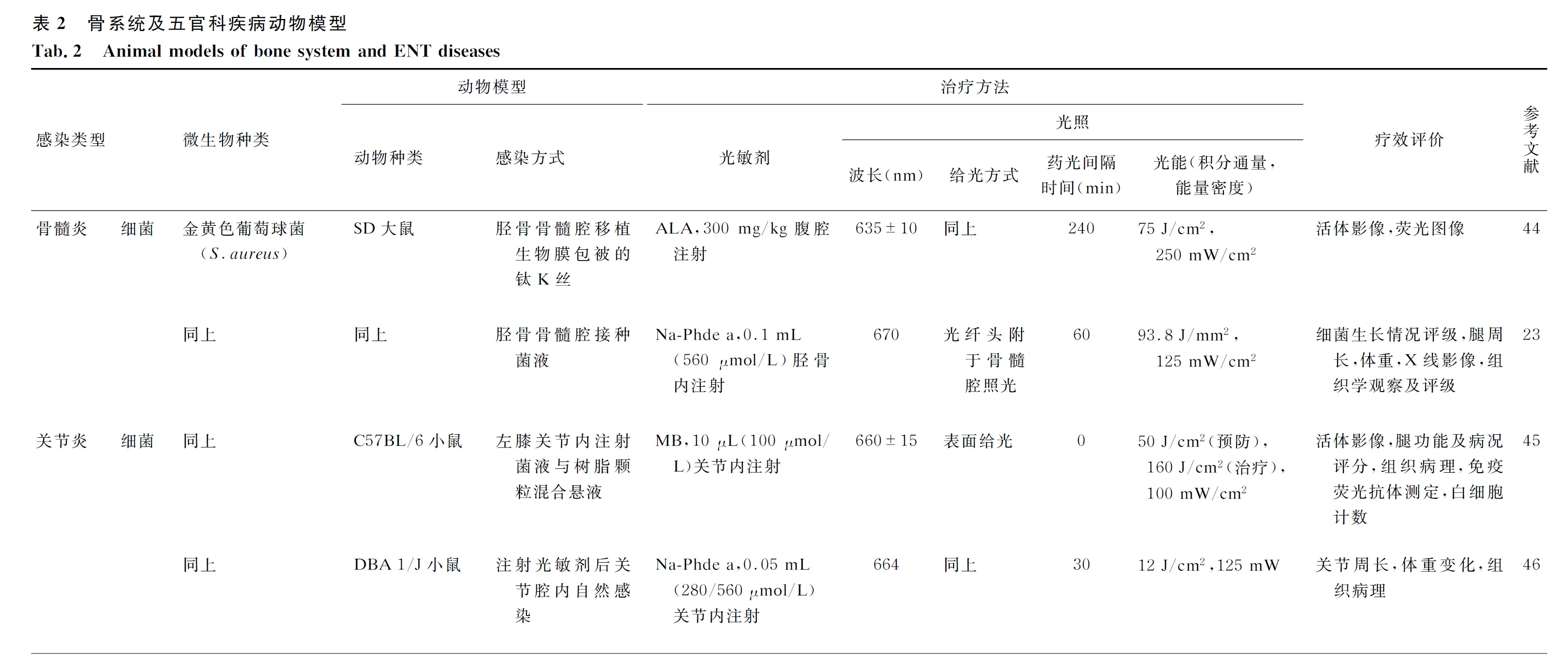
4.2.1骨髓炎骨髓炎最常见的病原体是金黄色葡萄球菌[23,44]。一般在SD大鼠胫骨骨髓腔内建模,可直接接种菌液[24],也可模拟临床植入物医源性污染,向骨髓腔内植入包被有细菌生物膜的钛K丝[44]。不同研究者对光敏剂的选择不同,但均采用光纤进入感染骨髓腔内照射的方式给光。除常用指标外,还有利用腿周长、X线影像、组织观察等方法进行疗效评价(表2)。结果均发现,PDT对骨髓炎感染具有一定的控制效果,但不能完全清除细菌。
4.2.2关节炎关节炎多由细菌感染引起。动物模型多选用耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus)的不同致病性菌株,以注射入关节腔的方式对小鼠进行感染[45],亦有模型直接暴露关节腔引发自然感染[46]。PDT主要选用亚甲基蓝(mythelene blue, MB)等光敏剂注射给药,以波长660 nm的LED为光源直接照射给光。组织病理切片观察是常用的疗效评价方式(表2)。相关文献显示,PDT在治疗关节炎动物模型中,相比对照组(无治疗或只给予光照或光敏剂),在不对正常组织造成危害的条件下有更好的疗效和预防作用,甚至可使机体产生保护性免疫[46]。但也有研究提示,PDT可造成关节内中性粒细胞和滑液组织的损伤,故关节腔内给药优于静脉注射,光量的选择也非常重要[55]。
4.3 五官科疾病
4.3.1口腔感染和牙周病口腔感染和牙周病均可由口腔中的细菌或真菌(主要为白念珠菌[51-53])引起。动物模型中感染的细菌或真菌主要取自口腔内正常菌落,通过结扎大鼠磨牙或人为造创诱发感染(自然感染或注射菌液)[48-50,53,56]。也有模型为暴露实验犬牙根管引发感染[47]。PDT给药方式多样,可填充、浸泡、冲洗或涂抹,皆为对伤口进行直接处理,多通过波长为660 nm和635 nm的光纤或激光照射给光(表2)。值得注意的是,由于给药部位位于口腔,建模需考虑唾液对光敏剂的稀释和光敏剂本身的毒性。组织病理切片观察为最常用的疗效评价方式。此外,由于炎症多由伤口感染引发,故对病灶的性质、外形及愈合程度进行评价也可辅助衡量PDT的疗效。结果证实,PDT对细菌和白念珠菌所致口腔炎和牙周病均能有效杀菌[57],减轻共感染,并对病灶周围正常组织无明显损伤,具有良好的临床应用前景。
4.3.2中耳炎中耳炎可由耳道内和外界细菌引起。动物模型通过在蒙古沙鼠的中耳道鼓泡(tympanic bullae)内注射一定浓度的流感嗜血杆菌和肺炎链球菌菌液,引起中耳炎继发感染[54]。PDT治疗时,向鼓泡注射一定量的Photogem溶液,利用无菌光纤经鼓膜插入鼓泡并经外耳道给光,经较长的药光间隔时间后,通过CFU、透射电子显微镜和细菌流式仪评价其疗效,结果证实PDT对耐抗生素中耳炎有一定疗效。
5 结语
自1995年美国食品药品管理局(Food and Drug Administration,FDA)批准首个用于肿瘤治疗的光敏剂Photofrin®以来[58],PDT的临床研究迅速发展。其应用从肿瘤科扩展到皮肤科、血管科、眼科、牙科等多个领域,在感染性疾病的治疗中更展现出突出的优势——作用范围广,可同时对抗多种类型病原体,对难治性耐药菌、形成生物膜的病原菌均有效[59];杀伤能力强,作用无选择性,不易诱发耐受;安全性高,不易致畸致突变;治疗可控性佳,靶向精准等[60]。
然而,尽管目前大量体内外及临床研究已证实PDT的抗感染疗效,但距其全面进入临床应用还有一定距离。待解决的主要问题包括:①PDT抗感染机制研究及光敏剂的改良优化,光敏剂的性质是PDT抗感染治疗的核心,在充分认识PDT抗感染的光化学及分子机制基础上,不断优化光敏剂光学特性是提升治疗效果、拓展PDT应用范围的关键;②针对不同感染类型的PDT治疗的最优参数尚需进一步摸索,即根据治疗目的选择最经济有效的光敏剂及给药方式,确定药光间隔时间、光源类型及能量等;③PDT治疗后感染复发的机制及有效对策,包括明确治疗时机、疗程及频率等,以及证实不同光敏剂或PDT-抗生素等联合治疗方案的有效性和适应指征等。
尽管PDT在感染性疾病诊治领域中有广阔应用前景,其动物模型的建立仍有可改进之处:①现有动物模型中使用的光敏剂和光源趋于多样化,缺乏统一标准,未成系统(例如,口腔疾病中光敏剂多采用甲苯胺蓝(toluidine blue, TB)且效果较好,而大多数动物模型中采用长波长为主的激光光源),因此尚需建立PDT应用指南。②由于动物模型种类多样,对不同部位或类型的感染可尝试确定一种常用动物模型,便于各项同类研究之间对比分析实验结果。例如,皮肤感染和烧伤几乎均选用小鼠建模,如统一小鼠的品系、基因型甚至体重等生理特征,或许可使动物模型的建立更统一规范,所得结论更具有可比性和推广性,更精准可靠。③感染性病原体有各自的特性(包括产生的毒素和侵袭力等),可尝试寻找其特异性的PDT治疗方案(包括光敏剂、光源、疗效评价等),或通过建立评级评分制度,有针对性地采取治疗而非摸索式建模,从而使动物模型的治疗过程更加程序化。
综上,本文总结了近年来动物体内PDT抗感染治疗的研究成果,欲为后续研究解决上述问题提供参考。倘能在体内实验中摸索出完备的具有临床应用价值的PDT抗感染治疗方案,可使PDT抗感染治疗有望真正走向临床,为众多感染病患者带来福音。
