肺炎支原体肺炎合并Epstein-Barr病毒感染患儿的血清因子及免疫分析
2018-10-22解玲玲孙亚娜吴良霞
解玲玲,孙亚娜,吴良霞
上海交通大学附属第六人民医院儿科,上海 200233
肺炎支原体(Mycoplasmapneumoniae)是一种介于细菌与病毒、能独立生长繁殖的最小原核细胞型微生物,可引起上呼吸道感染、支气管炎、肺炎等疾病,其中肺炎支原体肺炎(Mycoplasmapneumoniaepneumonia,MPP)占儿童社区获得性肺炎(community-acquired pneumonia,CAP)的10%~40%[1]。近年来,MPP导致的免疫损伤机制备受关注。机体感染肺炎支原体后免疫力低下,易合并细菌或病毒感染,其中Epstein-Barr病毒(Epstein-Barr virus,EBV)是常见病原体之一。临床发现,MPP合并EBV感染较单纯MPP引起的肺内及肺外损伤更严重,多数观点认为主要与细胞免疫机制有关[2-3]。本研究拟通过检测MPP合并EBV感染患儿血清中白细胞介素6(interleukin 6,IL-6)、IL-4、γ干扰素(interferon γ,IFN-γ)、IL-10的水平变化,了解患儿机体免疫状态,探讨这些指标在MPP合并EBV感染诊断中的临床应用价值。
1 材料与方法
1.1 研究对象
选取2016年9月—2017年3月上海市第六人民医院儿科住院部收治的MPP合并EBV感染患儿作为观察组(A组),单纯MPP患儿作为单纯感染对照组(B组),小儿骨科择期行六指切除手术患儿(近期无感染)作为健康对照组(C组)。A组61例,B组103例,C组23例。根据2013年中华医学会儿科学分会呼吸学组修订的儿童重症肺炎诊断标准[4],将A组患儿分为重症肺炎组和普通肺炎组,其中重症肺炎组15例,普通肺炎组46例。
1.2 纳入及排除标准
MPP诊断标准[5]:①符合第8 版《诸福棠实用儿科学》支原体肺炎临床特点;②单份血清肺炎支原体特异性IgM抗体效价≥1∶160,或短期(1周)内双份血清肺炎支原体IgM抗体效价上升4倍及以上,或短期(1周)内双份血清肺炎支原体IgM抗体效价阴性转阳性。
EBV感染诊断标准[6-7]:①EBV衣壳抗原(viral capsid antigen,VCA)IgM(+)或早期抗原(early antigen,EA)IgG(+),且抗EBV核抗原(EBV nuclear antigen,EBNA)IgG (-)。
重症肺炎诊断标准[4]:符合2013年中华医学会儿科学分会呼吸学组制定的儿童重度社区获得性肺炎(community-acquired pneumonia,CAP)诊断标准,存在以下任何一项:①一般情况差;②拒食或脱水征;③有意识障碍 ;④呼吸频率明显增快(婴儿>70次/min,年长儿>50次/min);⑤发绀;⑥呼吸困难(呻吟、鼻翼翕动、三凹征);⑦多肺叶或≥2/3的肺受累;⑧胸腔积液;⑨脉搏血氧饱和度≤0.92;⑩肺外并发症。
排除标准:①病程中出现呼吸道以外的感染症状,包括皮肤、泌尿系统感染等;②长期使用糖皮质激素或近3个月内使用免疫球蛋白等免疫抑制剂和免疫调节剂。
1.3 实验方法
所有患儿均于入院第2天采集静脉血。采用被动凝集法检测肺炎支原体特异性IgM 抗体,试剂盒购自富士瑞必欧株式会社。采用德国欧蒙公司酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒检测EBV特异性抗体,按说明书操作。留取静脉血 2.0 mL,自然凝固10~20 min,3 000 r/min离心20 min,取血清,-80 ℃保存。用酶标仪测光密度(optical density,OD)。
本研究获得所有患儿监护人的知情同意,并经上海市第六人民医院医学伦理委员会批准。
1.4 统计学方法
2 结果
2.1 一般资料
A组患儿中,男33例,女28例,平均年龄(5.24±1.38)岁;其中婴幼儿期11例(18.03%),学龄前期31例(50.82%),学龄期19例(31.14%)。B组患儿中,男65例,女38例,平均年龄(4.01±3.25)岁;其中婴幼儿期22例(21.36%),学龄前期36例(34.95%),学龄期45例(43.69%)。C组患儿中,男15例,女8例,平均年龄(6.31±0.65)岁;其中婴幼儿期2例(8.70%),学龄前期5例(21.74%),学龄期16例(69.57%)。3组患儿的年龄分布及性别差异均无统计学意义(图1~2)。
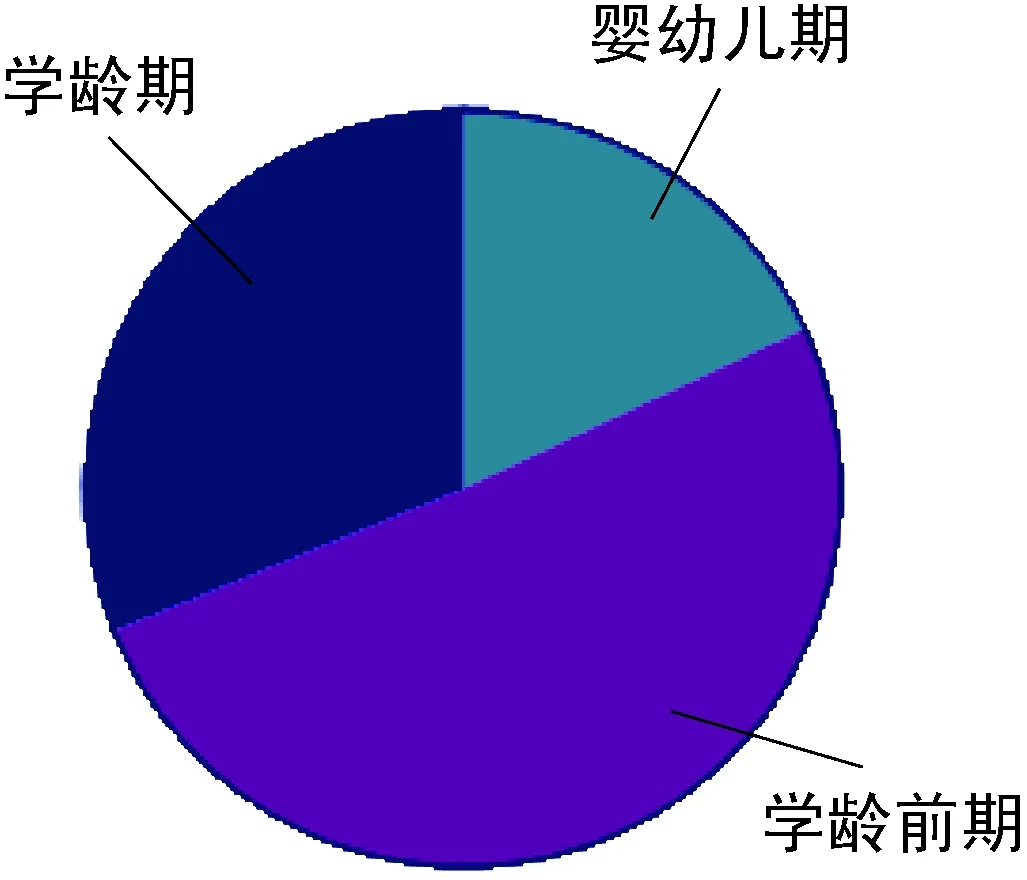
图1MPP合并EBV感染患儿的年龄分布
Fig.1DistributionofageinchildrenwithMPPcombinedwithEBVinfection

图2单纯MPP患儿的年龄分布
Fig.2DistributionofageinchildrenwithMPP
2.2 患儿血清IL-6、IL-4、IFN-γ、IL-10水平检测结果
3组患儿血清IL-6、IL-4、IFN-γ、IL-10水平差异显著。其中A和B组IL-6、IL-4、IFN-γ、IL-10水平高于C组(P<0.05),A组IL-6、IL-10水平高于B组(P<0.05),而A与B组IFN-γ、IL-4水平差异无统计学意义(表1)。
2.3 A组重症与非重症患儿血清IL-6、IL-4、IFN-γ、IL-10水平检测结果
A组重症组患儿血清IL-6、IL-10、IL-4水平高于非重症组(P<0.05),而IFN-γ水平无统计学差异(表2)。
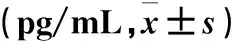
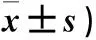

GroupnIL-6 IL-4 IFN-γIL-10 A6168.00±9.17*#13.80±1.06*40.71±1.88*25.50±1.71*#B10335.00±7.46*10.91±2.84*40.50±10.42*15.52±6.03*C2312.51±0.467.93±2.6514.71±1.885.52±1.03F value5.7341.5480.7687.352P value0.034 1.870.9230.001
*P<0.05 compared with group C,#P<0.05 compared with group B.

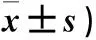
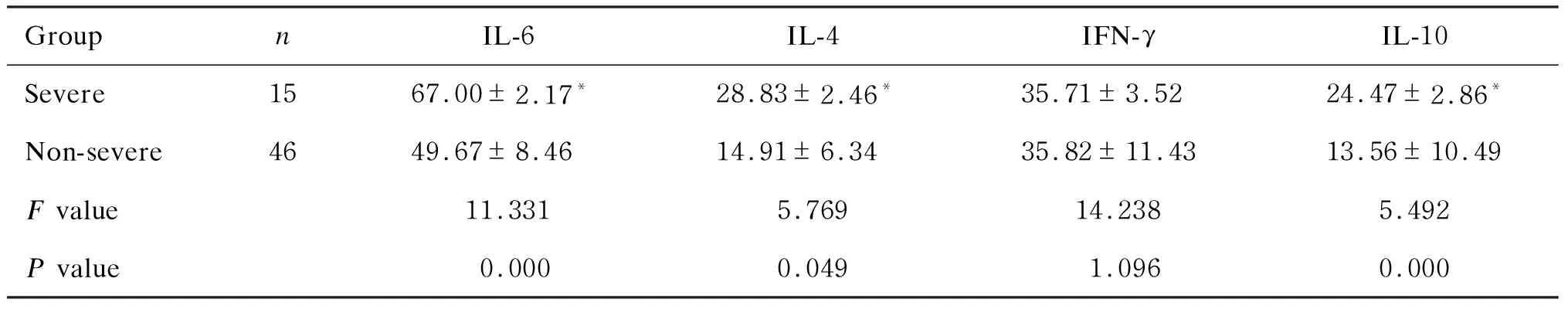
GroupnIL-6IL-4IFN-γ IL-10Severe1567.00±2.17*28.83±2.46*35.71±3.52 24.47±2.86*Non-severe4649.67±8.4614.91±6.3435.82±11.43 13.56±10.49F value 11.3315.769 14.2385.492P value0.000 0.0491.0960.000
*P<0.05.
3 讨论
MPP最常见的临床表现有发热、咳嗽及喘息。由于肺炎支原体与心、脑、肺、肝及平滑肌等多种人体组织器官存在部分相同抗原,其感染后除引起肺部炎症外,还累及血液、皮肤、消化、心血管、中枢神经等引起多系统损伤。MPP的临床症状轻重程度不一,严重者可危及生命。关于MPP的发病机制,国内外学者主要倾向以下两种。①黏附损伤:肺炎支原体借助黏附素吸附于宿主细胞后,产生过氧化氢、超氧化基团和神经毒素等,引起呼吸道上皮细胞的氧化应激反应,并分泌社区获得性呼吸窘迫综合征(community-acquired respiratory distress syndrome,CARDS)毒素等,对呼吸道上皮造成损伤。②免疫损伤:包括自身免疫损伤和免疫抑制损伤。自身免疫损伤即肺炎支原体感染后产生的抗肺、脑及其他组织的自身抗体与抗原结合形成抗原-抗体免疫复合物,补体和免疫细胞在自身抗体和免疫复合物的诱导下被激活,从而削弱机体免疫屏障。免疫抑制损伤即肺炎支原体侵入宿主后破坏正常T细胞与B细胞比例,造成淋巴细胞多克隆活化,破坏CD4+/CD8+动态平衡, 使Th1/Th2失衡,引起机体免疫抑制。EBV是一种嗜B细胞疱疹病毒,在儿科病毒感染性疾病中非常普遍。病毒携带者和病毒感染者是传染源,主要通过亲吻等经口密切接触的行为传播,因此被称为“接吻病毒”。由于传染源广泛、传播途径简单,EBV初发感染多发生于儿童时期,90%以上学龄前儿童曾感染过EBV[8]。EBV首先侵犯上皮细胞和B细胞,通过gp350/200 与B细胞表面的CR2结合而进入B细胞,并诱导其分化为记忆性B 细胞,形成长期潜伏感染,在宿主免疫力低下或环境改变时EBV大量激活,引起疾病[9]。EBV感染可使多器官、多系统受累,首发症状不一。6岁以下儿童原发性EBV 感染大多表现为无症状感染或上呼吸道感染等非特异性表现;但在青少年期,约50% 的原发性EBV 感染可表现为传染性单核细胞增多症[10-11]。
近年来国内大量研究发现,MPP合并EBV感染患儿较单纯MPP患儿的肺内外炎症更严重,疾病更多样化。这可能与肺炎支原体和EBV的免疫机制相似有关,均表现为T 细胞亚群紊乱,即CD4+/CD8+比例失调[12]。肺炎支原体感染可引起CD4+T细胞凋亡,导致细胞免疫功能下降,进而激活长期潜伏于体内的EBV侵入B细胞,致使B细胞变性、凋亡,同时引起T细胞的强烈反应,CD8+T细胞大量增殖,免疫反应叠加,导致组织损伤加重[13-14]。IL-6、IL-4、IFN-γ、IL-10是重要的免疫细胞因子,在细胞免疫评价方面有重要作用。
Th细胞按功能分为Thl及Th2亚群。Th1通过分泌IL-2、IFN-γ、IL-12等促炎细胞因子介导细胞免疫应答,增强杀伤炎症细胞的细胞毒性作用;Th2通过分泌IL-4、IL-10、IL-5等抗炎细胞因子促进B细胞产生抗体,主要参与体液免疫调节。正常情况下,Th1/Th2比值处于动态平衡,一旦病理因素涉入,两者比值失衡,即导致机体出现相应的病理损伤。
刘文彬等[15]认为,肺炎衣原体感染可抑制Th细胞产生IL-2,从而使细胞免疫功能低下,易合并病毒感染或使原有病毒激活。低剂量IL-2可阻止EBV介导的淋巴组织增生性疾病[16]。有研究发现[17],IL-2通过IL-6发挥免疫效应,而IL-6间接抑制细胞免疫功能。IL-6主要由活化的T细胞和B细胞、单核-巨噬细胞、内皮细胞等生成,可诱导B细胞分化并产生免疫球蛋白,促进T细胞增殖生长,具有免疫调节、促炎和抗感染等生物学作用[18-19]。当机体处于炎症和感染状态时,IL-6可促进CD4+T细胞在Th2分化期间的IL-4产生,配合转化生长因子p(transforming growth factor p,TGF-p)抑制Thl分化,阻止活化的CD4+T细胞凋亡[20]。肺炎支原体可通过细胞酪氨酸磷酸化信号转导和核因子κB(nuclear factor κB,NF-κB)激活,诱导单核细胞产生IL-6,继而引发促炎因子级联反应,增强中性粒细胞趋化及脱颗粒黏附作用,加剧炎症反应[21-22]。本研究发现,MPP合并EBV感染和单纯MPP患儿血清IL-6水平高于健康对照患儿,且MPP合并EBV感染所致重症肺炎患儿IL-6水平高于非重症肺炎患儿,表明IL-6可反映免疫损伤程度,与Tian等[23]的研究结论一致。
IL-4是Th0分化为Th2的关键细胞因子;IFN-γ可促进Th0向Th1分化,并减少IL-4 mRNA 表达,从而抑制Th2分化过程[24]。MPP患儿肺泡灌洗液中,高菌量组IL-4水平及IL-4/IFN-γ比值显著高于低菌量组,提示肺炎支原体导致的Th1/Th2免疫偏移以Th2免疫反应占优势[25-26]。这种改变有利于机体清除病原体,削弱肺炎支原体感染引起的炎症反应。有文献报道,肺炎支原体感染机体后,IFN-γ水平明显升高,表明Th1/Th2免疫失衡以Th1占优势[27]。本研究发现,MPP合并EBV感染患儿的IL-4、IFN-γ水平较健康对照组升高,提示MPP合并EBV感染患儿存在Th1/Th2免疫平衡失调。随着病情加重,IL-4升高更显著,且Th2细胞免疫起主导作用。MPP合并EBV感染患儿的IL-4、IFN-γ水平与单纯MPP组相比无明显差异,可能与感染不同时期有关。Li等[28]发现,MPP急性期Th1占优势,恢复期转变为以Th2为主,表明MPP合并EBV感染后细胞免疫可由Th1向Th2转变。
IL-10具有强抗炎和负向免疫调控作用,可直接拮抗IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎性因子的释放以减轻机体炎症反应。出现炎症瀑布反应时,IL-10主要通过抑制抗原呈递细胞(antigen presenting cell,APC),间接降低 T 细胞活性和免疫应答能力来抑制免疫功能,从而大大增加机体再次感染的概率[29-30]。研究证实,诱导性调节性 T 细胞(induced regulatory T cell,iTreg)主要通过分泌 IL-10 来发挥负向免疫调节作用[31],而Th17/Treg免疫平衡与MPP的发生发展密切相关[32-34]。本研究提示,MPP合并EBV感染及单纯MPP患儿血清IL-10水平显著升高,混合感染所致重症肺炎患儿血清IL-10较普通肺炎更高,原因可能是免疫抑制增加了感染概率而使病情加重。
综上所述,Th1/Th2细胞免疫功能紊乱在MPP合并EBV感染的发生发展中起重要作用。肺炎支原体、EBV可通过诱导机体分泌IL-6、IL-4、IFN-γ、IL-10造成组织损伤,这些指标对评估MPP合并EBV感染患儿的细胞免疫紊乱程度有重要意义。
