金黄色葡萄球菌sdhCAB操纵子影响持留菌形成机制的研究
2018-10-22王旭阳陈刚王士勇王文婕陈嘉臻张文宏
王旭阳,陈刚,王士勇,王文婕,陈嘉臻,张文宏
复旦大学附属华山医院感染科, 上海 200040
金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是临床上非常常见的致病菌,30%的健康人体内有定植[1-2]。金黄色葡萄球菌不仅可引起临床常见急性感染,还可引起非常难治的慢性感染如腹膜炎[3]、心内膜炎[4]、骨髓炎[5]、伤口和软组织感染[6]及植入材料所致感染。有研究表明,持留菌的形成是细菌造成慢性感染的重要原因,金黄色葡萄球菌和铜绿假单胞菌尤为如此[7]。持留菌是细菌群体中的一小部分细菌,可耐受致死剂量的抗生素[8]。这部分细菌生长缓慢或不生长,具有一定的异质性,去除抗生素压力后可恢复生长,但其药物耐受并不是药物敏感性改变引起的[9]。
目前,关于金黄色葡萄球菌持留菌形成的机制已有一些研究进展,发现了很多与持留菌形成相关的基因。毒素基因mazF的异位表达可抑制细菌生长从而促进金黄色葡萄球菌对多种药物耐受[10]。研究发现,甘油的摄取可影响持留菌形成,甘油转运体编码基因glpF突变可影响金黄色葡萄球菌对氨苄西林和诺氟沙星的耐受[11]。此外,Xu等研究发现,Agr群体感应系统AgrCD通过酚可溶性调节蛋白抑制持留菌的形成[12-13]。
本课题组前期使用高浓度左氧氟沙星筛选金黄色葡萄球菌USA500[14](以下简写为USA500)转座子突变库,发现了sdhA、sdhB、ureG、mnhG1、fbaA、ctaB、clpX等13个基因的插入突变与持留菌形成相关[15]。其中,sdhA和sdhB来自同一个操纵子sdhCAB,由sdhC、sdhA、sdhB三个编码基因组成的琥珀酸脱氢酶参与电子传递链和三羧酸循环,在细菌的能量代谢中发挥重要作用[16]。虽然本课题组前期已证实sdhA和sdhB对持留菌形成有明确影响,但sdhCAB操纵子对持留菌形成的作用及其机制尚不清楚。为此,本研究构建sdhCAB及sdhAB敲除株及回补株,通过持留菌相关实验研究sdhCAB对持留菌形成的作用;运用RNA测序(RNA sequencing, RNA-seq)方法,比较操纵子sdhCAB对金黄色葡萄球菌转录组的影响,以探究其影响持留菌形成的可能机制;通过对野生株、sdhCAB敲除株、回补株进行微生物表型检测,探讨sdhCAB在金黄色葡萄球菌生化表型中的重要作用。
1 材料与方法
1.1 材料
1.1.1菌株与试剂sdhCAB和sdhAB敲除株及回补株均以USA500为亲本构建。大肠埃希菌(Escherichiacoli,E.coli)DC10B[17]培养于LB培养基(Oxoid,UK),用于回补质粒的构建。菌株ATCC 29213用作药敏试验的阴性对照,来自复旦大学附属华山医院检验科。金黄色葡萄球菌用胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基(BD,USA)、胰蛋白胨大豆琼脂(tryptic soy agar,TSA)培养基(BD,USA)培养,MHB培养基(Oxoid,UK)用于药敏检测中的菌株培养。T4连接酶(TaKaRa, Japan),限制性内切酶KpnⅠ、EagⅠ、HindⅢ和SalⅠ(ThermoFisher,USA),Q5高保真聚合酶(NEB,USA)用于克隆构建。Lysis Buffer(TaKaRa,Japan),Extaq聚合酶(TaKaRa, Japan)用于聚合酶链反应(polymerase chain reaction,PCR)验证。RNAprotect(Qiagen,Germany)、RNeasy Mini Kit(Qiagen,Germany) 用于RNA提取。TruSeq Illumina 试剂盒(Illumina,USA)用于测序文库构建。PrimeScriptTMRT试剂盒(TaKaRa,Japan)、SYBR Green PCR试剂(Qiagen,Germany)用于实时PCR。IF-0培养液(Biolog)用于表型芯片(phenotype microarray,PM)实验中的菌株培养。本研究使用的抗生素浓度:氯霉素(Sigma,USA)为10 μg/mL,氨苄西林[生工生物工程(上海)股份有限公司]为100 μg/mL,左氧氟沙星(Sigma,USA)为25 μg/mL,脱水四环素(Sigma,USA)为1 μg/mL。
1.1.2引物根据USA300 TCH1516基因组序列(https://www.ncbi.nlm.nih.gov/nuccore/CP000730.1)进行引物设计,所有引物合成、测序、鉴定均委托华大基因(上海)有限公司完成。
1.2 方法
1.2.1操纵子sdhCAB同源重组和回补质粒的构建及验证为构建USA500 ΔsdhCAB(ΔsdhCΔsdhAΔsdhB敲除株),分别使用引物sdhCAB-1-KpnⅠ、sdhCAB-1Rev和sdhCAB-2Rev、sdhAB-2-EagⅠ(表1),以USA500基因组为模板扩增基因上下游各 1 000 bp左右的片段,获得两个PCR产物作为模板,再次使用引物sdhCAB-1-KpnⅠ、sdhAB-2-EagⅠ(表1)进行融合PCR。将获得的片段割胶回收后,用KpnⅠ、EagⅠ酶切融合片段及质粒pMX10, 37 ℃水浴4 h。将酶切后的片段电泳后回收,用T4连接酶16 ℃连接过夜。将连接产物分别电转至USA500感受态,电转条件为 2 900 V,25 μF,1 000 Ω。将电转后的菌液涂于含10 μg/mL氯霉素的TSA平板,30 ℃ 过夜培养后挑选克隆转接。然后,根据Bae等报道的方法对突变菌株进行筛选[18]。pMX10[12]中的同源片段会与USA500发生重组,在43 ℃、10 μg/mL氯霉素的条件下筛选获得发生重组的克隆,未发生重组的克隆则被排除。用四环素诱导反义RNAsecY表达抑制细菌生长的方法筛选质粒片段和待敲除基因片段丢失的克隆。为构建USA500 ΔsdhAB(ΔsdhAΔsdhB) 敲除株,分别使用引物sdhAB-1-KpnⅠ、sdhAB-1Rev和sdhAB-2Rev、sdhAB-2-EagⅠ(表1)以USA500基因组为模板扩增基因上下游各 1 000 bp左右的片段,获得两个PCR产物作为模板,再次使用引物sdhAB-1-KpnⅠ、sdhAB-2-EagⅠ(表1)进行融合PCR。后续步骤同USA500 ΔsdhCAB的构建。
表1PCR引物
Tab.1PrimersequencesforPCR

NameSequence (5'-3')sdhCAB-1-KpnⅠATATGGTACCGAATCACTTGATTTTGAACGAGCTAAAsdhCAB-1RevGGGATTAATTTTTATTTATGCAATTGTTCATGTAGGTTCTTsdhCAB-2RevTGCATAAATAAAAATTAATCCCTTTTGAGTTAAAATGTTATGsdhAB-2-EagⅠTTATCGGCCGCAATGCTTTTGCAGCAGCTTCTGsdhAB-1-KpnⅠATATGGTACCCAAACACGTCAAAAGACAGGCTTGsdhAB-1RevGGGATTAATTTAAAAATTTCACTCCCCTAAATTTTCAAsdhAB-2RevGTGAAATTTTTAAATTAATCCCTTTTGAGTTAAAATGTTATGPM01-HindⅢATATAAGCTTATTACAGGGCGTGAGAATCATTCTCAPM02-R-SalⅠTTATGTCGACCCATTCAATTTAATTTTGAAAGGAACATAAsdhCAB-iden ForAAAAAATCCCTTCCAAGTTATTGTGTATCTCCAsdhCAB-iden RevACTTTAGGGGGTTAAGCGTACGTTsdhAB-iden RevGGGTGGACTTCAATCTCCAAAATCACAUSA300HOU_0010-FCTTGTTATGTCTTGTTATATATGCCGGTGCTGUSA300HOU_0010-RCCATGCATCCAACGATCATTGATAGCTTCUSA300HOU_0103-FCAATATCATGTTAAGTTGCCTAGTGATTACAATATGGAUSA300HOU_0103-RCAGTCATCCCCTCTGAACTTCTCCATUSA300HOU_0190-FCCATGTAGATTTAGCGGCAGCAAGTUSA300HOU_0190-RGTGCAGGTTGTGGATACCAAACATCUSA300HOU_0201-FGTGCTGTTGAACAAGGCGGTAAATATGT

(续表1)

(续表1)
为构建回补菌株USA500 ΔsdhCAB∷pRBsdhCAB(sdhCsdhAsdhB回补株)和USA500 ΔsdhAB∷pRBsdhCAB,一个含有启动子区域及sdhCAB基因编码区域用引物PM01-HindⅢ和PM02-R-SalⅠ(表1)以USA500基因组为模板扩增并纯化。PCR产物和pRB473质粒分别用HindⅢ和SalⅠ进行酶切,酶切后的sdhCAB片段与酶切后的pRB473质粒连接,酶切连接条件同上。将获得的连接产物pRB473-sdhCAB通过电转方式分别转入ΔsdhCAB突变株、ΔsdhAB突变株感受态,电转条件同上。将电转后的菌液涂于含10 μg/mL氯霉素的TSA平板,37 ℃ 过夜培养后挑选克隆。
对上述构建的敲除菌株和回补菌株进行PCR验证。将100 μL过夜培养的USA500、USA500 ΔsdhCAB、USA500 ΔsdhAB离心,去除上清液,用20 L Lysis Buffer重悬,80 ℃处理15 min,离心取上清液作为模板,用引物sdhCAB-iden For、sdhCAB-iden Rev和sdhCAB-iden For、sdhAB-iden Rev分别进行PCR验证。USA500 ΔsdhCAB∷pRBsdhCAB、USA500 ΔsdhAB∷pRBsdhCAB同样进行Lysis Buffer处理,以上清液中的基因组DNA作为模板,用引物PM01-HindⅢ和PM02-R-SalⅠ进行PCR验证。
1.2.2药敏检测最小抑菌浓度(minimum inhibitory concentration,MIC)检测使用微量稀释技术在MHB培养基中进行,实验方法和判读标准根据Andrews等报道[19]及美国临床和实验室标准化协会(Clinical Laboratory Standards Institute,CLSI)指南[20],实验重复3次。将含一定浓度抗生素的MHB加入96孔板第1排,第2~11排依次进行倍比稀释,每孔体积100 μL,第12排加入等体积不含抗生素的MHB作为阳性对照。阴性对照选择ATCC 29213。将0.5麦氏比浊度标准的菌悬液按1∶1 000 稀释后,每孔加入100 μL,达到终浓度128、64、32、16、8、4、2、1、0.5、0.25、0.125 μg/mL,密封后于37 ℃ 空气孵箱孵育,24 h后观察。肉眼观察到抑制细菌生长的最低药物浓度即为MIC。
1.2.3持留菌表型实验分别在热压力、氧化压力、酸压力、抗生素压力条件下对菌株USA500、USA500 ΔsdhCAB,以及USA500 ΔsdhCAB∷pRBsdhCAB、USA500 ΔsdhAB、USA500 ΔsdhAB∷pRBsdhCAB进行持留表型实验,方法参见文献[15]。过夜培养菌株按1∶100分别转接至5 mL TSB培养基中,37 ℃ 220 r/min培养18 h后开始进行实验。
热压力处理:取1 mL菌株,于57 ℃孵育3 h,分别于1 h、2 h和3 h取100 μL,用CFU稀释计数法进行计数。 CFU稀释计数时,将原体系混匀后取出少量菌液,用磷酸盐缓冲液(phosphate buffered saline,PBS )进行10倍稀释,稀释到合适浓度后取10 μL滴至TSA板,晾干后于37 ℃孵育过夜,计数。每个稀释度计数3次,取平均值。计数下限是10个CFU。
氧化压力处理:将菌株用TSB 按1∶100稀释后,用终浓度为50 mmol/L的H2O2于37 ℃静置处理3 h,分别于1 h、2 h和3 h取100 μL进行CFU计数。
酸压力处理:取1 mL菌株离心,去除上清液,用1 mL pH 3.0 的TSB重悬细菌,37 ℃静置培养2 d,分别于24 h、48 h进行CFU计数。
抗生素压力处理:取1 mL菌株离心,去除上清液,用1 mL含25 μg/mL左氧氟沙星的TSB重悬,37 ℃静置培养7 d,从第2天起每天进行一次CFU计数。
上述实验均至少重复3次。
1.2.4RNA提取、mRNA富集及RNA-seq将过夜培养菌株USA500、USA500 ΔsdhCAB及USA500 ΔsdhCAB∷pRBsdhCAB按1∶100分别转接至5 mL TSB,37 ℃ 220 r/min培养18 h,用RNAprotect处理后冻存于-80 ℃。共冻存3批样本。用RNeasy Mini Kit从上述样本中提取细菌总RNA,用Bioanalyzer 2100 RNA-6000 Nano Kit测定RNA 样本质量。用Ribo-ZeroTMGold Kit 去除高质量RNA样本中的16S rRNA和 23S rRNA。cDNA文库是由150~250 bp大小的反转录自mRNA样本的多重cDNA构成,建库使用TruSeq Illumina 试剂盒。上述实验均根据说明书指导进行操作。
文库使用HiSeq2500进行单端测序,用Cufflinks系列工具评估和定量总reads数。以USA300 TCH1516基因组序列为参比序列[21],比较不同菌株基因表达量差异,Benjamini-Hochberg法计算错误发现率(false discovery rate,FDR)及P值。
1.2.5荧光定量PCR用于荧光定量PCR的RNA样本来自送检RNA-seq样本。将1 μg RNA用PrimeScriptTMRT 试剂盒反转录为cDNA后,用SYBR Green PCR试剂进行荧光定量PCR以确定靶标基因的相对表达量,所用引物见表1。反应体系(20 μL)包括10 μL SYBR Green PCR Master Mix、0.4 μL上游引物、0.4 μL下游引物、1 μL cDNA(5倍稀释后)及 8.2 μL ddH2O。反应条件:初始激活95 ℃ 2 min,然后进行两步法扩增,95 ℃ 5 s,60° C 30 s,共40个循环。内参基因选择tpi、pta、hu[22],以3个内参基因循环阈值(cycle threshold,Ct)的几何平均数作为内源性参比,用2-ΔΔCt方法分析基因的相对表达量[23]。所有基因的荧光定量PCR实验用独立的RNA样本重复3次。
1.2.6PM检测对菌株USA500、USA500 ΔsdhCAB及USA500 ΔsdhCAB∷pRBsdhCAB用PM微孔板 PM1~PM5、PM9和PM10进行检测,共672个不同条件。从TSA平板上挑选USA500、USA500 ΔsdhCAB及USA500 ΔsdhCAB∷pRBsdhCAB克隆,转接至15 mL IF-0培养液中,培养至浊度计(Biolog,USA)测量达85%的透光率[24],加入微孔板中,每孔100 μL。同时,每孔加入1%(V/V)四唑紫。PM1~2包含192种碳源,PM3包含96种氮源,PM4包含60种磷源和36种硫源,PM5包含96种不同种类或不同浓度的营养补充物,PM9包含76种不同种类或不同浓度的渗透压力和20种毒物,PM10包含96种不同pH值的营养物。将板置于OmniLog Incubator Reader(Biolog,Inc.,Hayward,CA)仪器中,37 ℃培养72 h,每15 min测量一次OD595,数据用OminoLog PM 软件(release OM_PM_109M)进行分析,得到基于四唑紫颜色变化的时间曲线[25]。曲线下面积之差>20 000 作为不同菌株在不同PM条件下判断生长差异的阈值。以USA500为对照,将sdhCAB敲除株、回补株的生长曲线分别与之比较,统计获得菌株生长有差异的生长条件。
1.3 统计学分析
用配对t检验分析持留表型实验中CFU计数结果的统计学差异。RNA-seq差异基因入选标准:入选的基因应满足在敲除株中比在野生株中表达量上调3倍以上且比在回补株中表达量上调2倍以上,或在敲除株中比在野生株中表达量下调3倍以上且比在回补株中表达量下调2倍以上。P均<0.05,所有菌株的FPKM>10。
2 结果
2.1 USA500中sdhCAB、sdhAB敲除株与回补株的构建
本研究采用同源重组方法分别在USA500中实现了sdhCAB操纵子三基因及sdhAB双基因的敲除,并用质粒过表达方法实现了敲除基因的回补。在敲除株验证中,用sdhCAB验证引物,以USA500、USA500 ΔsdhCAB、USA500 ΔsdhAB基因组为模板进行PCR,可见USA500 ΔsdhCAB的PCR条带比野生株短 3 000 bp左右,USA500 ΔsdhAB的PCR条带介于野生株与USA500 ΔsdhCAB之间。用sdhAB验证引物,以USA500、USA500 ΔsdhAB基因组为模板进行PCR,可见USA500 ΔsdhAB的PCR条带比野生株短 2 000 bp左右。
在回补株验证中,引物PM01-HindⅢ和PM02-R-SalⅠ以回补株USA500 ΔsdhCAB∷pRBsdhCAB、USA500 ΔsdhAB∷pRBsdhCAB基因组为模板进行PCR,可见 3 000 bp的sdhCAB条带,表明回补成功(图1)。
2.2 MIC结果
在进行抗生素持留表型处理前,检测USA500 ΔsdhCAB及USA500 ΔsdhAB对左氧氟沙星的MIC,MIC为0.5 μg/mL,与USA500没有差异。
2.3 USA500 ΔsdhCAB、USA500 ΔsdhAB的持留表型
为验证操纵子sdhCAB在持留菌形成中是否发挥作用,采用酸压力、热压力、氧化压力、抗生素压力对稳定初期的USA500、USA500 ΔsdhCAB、USA500 ΔsdhAB及相应回补株进行处理。结果如图2所示,酸压力条件下,与野生株相比,USA500 ΔsdhCAB、USA500 ΔsdhAB存活率下降,24 h的存活率均下降1.2个log(P<0.05),48 h的存活率分别下降 3.8 和 5.0 个log(P<0.05),回补sdhCAB后两菌株对酸耐受能力与野生株没有差异。结果表明,与野生株相比,USA500 ΔsdhCAB、USA500 ΔsdhAB对酸压力的耐受均降低,且USA500 ΔsdhAB比USA500 ΔsdhCAB对酸性条件的耐受能力更差。氧化压力条件下,与USA500相比,USA500 ΔsdhCAB的存活率差异逐渐加大,3 h 时比USA500少 4.4 个log(P<0.05)。USA500 ΔsdhAB比USA500对氧化压力的耐受能力更低,2 h时已全部被杀死(P<0.05)。2 h时USA500 ΔsdhAB比USA500 ΔsdhCAB存活率下降 4.7 个log(P<0.05),回补sdhCAB后两敲除菌株对氧化压力的耐受能力与USA500无差异。热压力条件下,USA500 ΔsdhCAB1 h时存活率比USA500下降 1.0 个log, 2 h、 3 h时差异不显著。
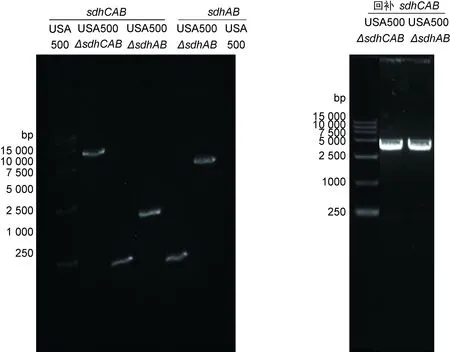
图1PCR鉴定USA500ΔsdhCAB、USA500ΔsdhAB敲除株及回补株
Fig.1IdentificationofUSA500ΔsdhCAB,USA500ΔsdhABandcomplementstrainsbyPCR
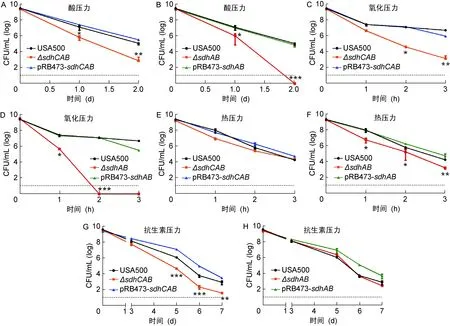
图2稳定初期的金黄色葡萄球菌死亡曲线
Fig.2ThekillingcurveforS.aureusattheonsetofstationaryphase
而USA500 ΔsdhAB在热压力条件下的存活率始终低于USA500,1 h、2 h、3 h时分别低 1.1、2.0、1.0 个log(P<0.05),回补sdhCAB后两菌株对热压力的耐受能力与USA500无差异。
用50倍MIC(25 μg/mL)的左氧氟沙星进行处理,发现与USA500相比,USA500 ΔsdhCAB在抗生素压力条件下的持留菌形成下降,3、5、7 d分别下降1.3、1.4、1.2个log(P<0.05),回补sdhCAB后持留表型得到回复。但USA500 ΔsdhAB在抗生素压力下的持留表型与野生株没有差别。USA500 ΔsdhAB与USA500 ΔsdhCAB相比,3、5、7 d存活率分别高 1.80 (P<0.05)、1.45 (P<0.05)、0.99 个log。
2.4 USA500、USA500 ΔsdhCAB及回补株的 RNA-seq分析结果
为进一步了解sdhCAB操纵子影响持留菌形成的机制,对培养18 h的稳定期菌株USA500、USA500 ΔsdhCAB及回补株进行RNA-seq检测。结果显示,USA500、USA500 ΔsdhCAB及回补株检测到的总reads数目均为 15.30 Mb左右,数据过滤后reads数目分别为 14.49、14.47、14.30 Mb,数据质量较高(表2)。
表2RNA-seqreads质量统计
Tab.2ReadsqualityforRNA-seq
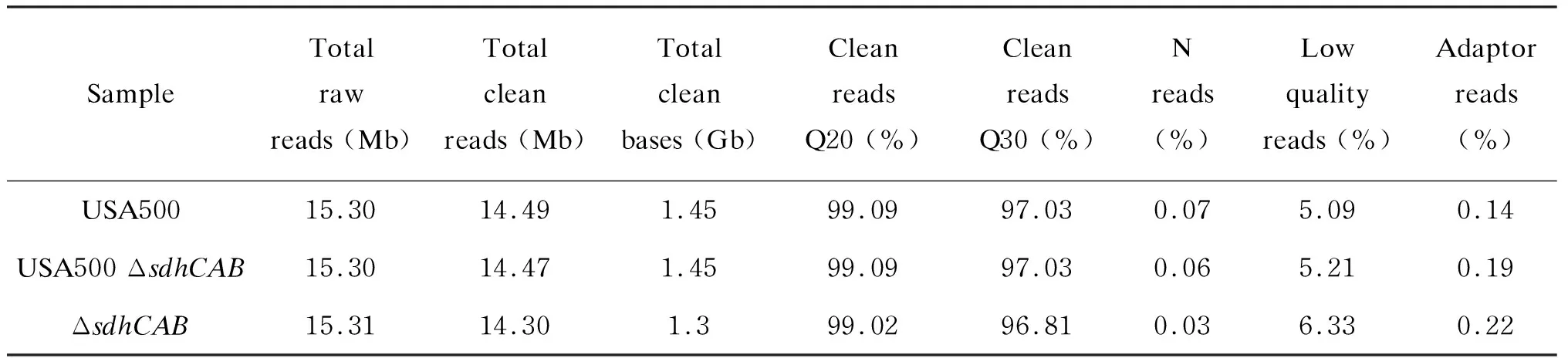
SampleTotal raw reads (Mb)Total clean reads (Mb)Total clean bases (Gb)Clean reads Q20 (%)Clean reads Q30 (%)Nreads(%)Lowqualityreads (%)Adaptorreads (%)USA50015.3014.491.4599.0997.030.075.090.14USA500 ΔsdhCAB15.3014.471.4599.0997.030.065.210.19ΔsdhCAB15.3114.301.399.0296.810.036.330.22
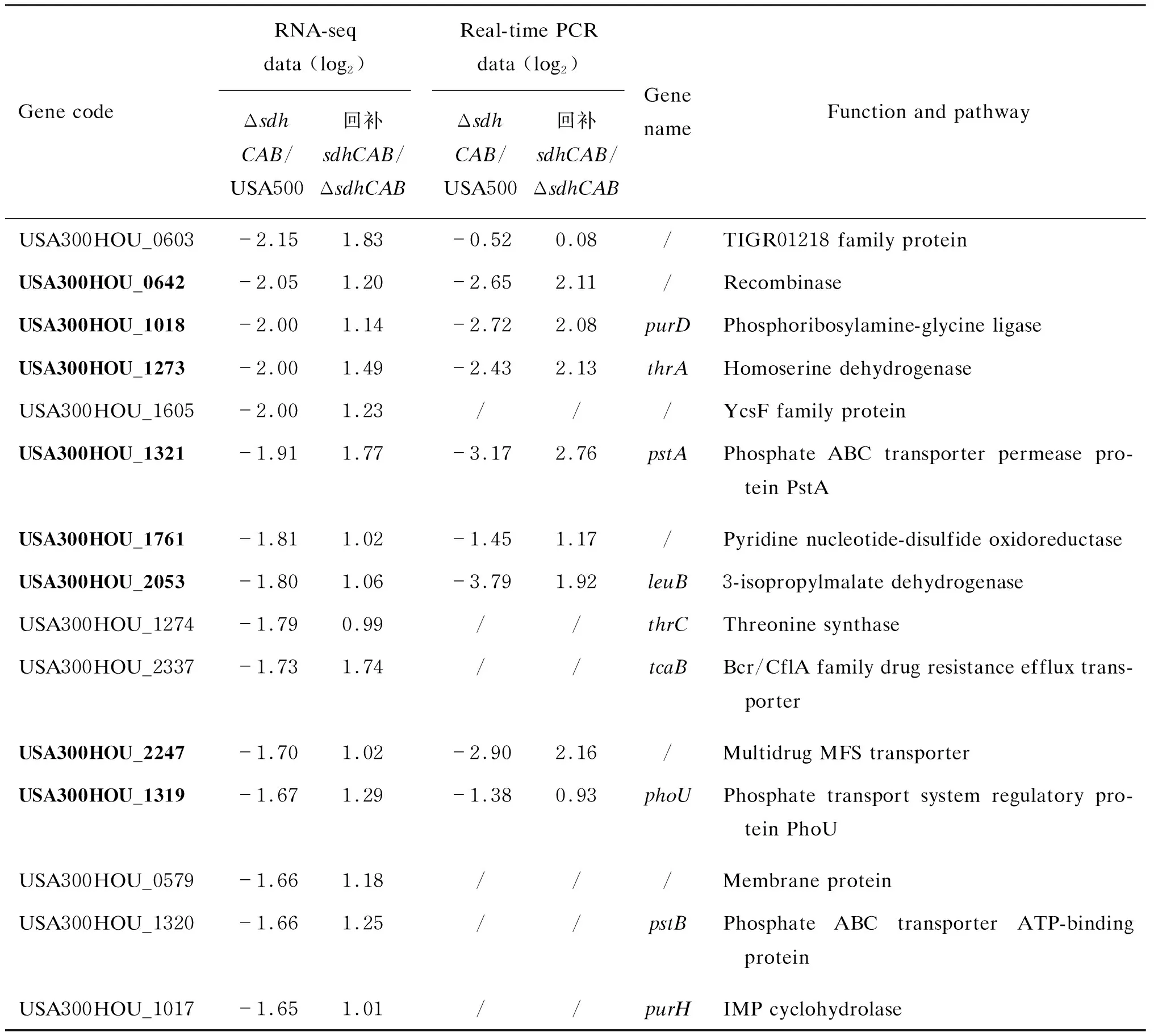
sdhCAB敲除后表达量上调的基因共有12个,表达量下调的基因共有28个。上调的基因包括甲酸脱氢酶编码基因fdh,2-酮戊二酸/2-酮酸铁氧化还原蛋白氧化还原酶编码基因porA、porB,铁氧化还原蛋白编码基因fer,核黄素转运体的编码基因USA300HOU_1423,水解酶活性的膜蛋白编码基因USA300HOU_1864及USA300HOU_2181,DNA聚合酶Ⅳ的编码基因USA300HOU_1894,可能的乙醇脱氢酶编码基因USA300HOU_2180,FMN还原酶的编码基因USA300HOU_2512,硫转移酶编码基因USA300HOU_2691,还有功能未知基因USA300HOU_0189(表3)。
下调的基因涉及通路包括耐药相关基因、氨基酸代谢相关基因、糖类代谢相关基因、卟啉代谢相关基因,还有转运体基因等。其中耐药相关基因包括USA300HOU_0010、USA300HOU_2247、tcaB、USA300HOU_2524;氨基酸代谢相关基因包括丝/苏氨酸代谢相关的thrA、thrC及亮氨酸合成相关的leuB;糖类代谢相关基因包括USA300HOU_1605、USA300HOU_1606、USA300HOU_1607;卟啉代谢相关基因包括purH、purD;还有数个转运体基因,包括磷转运体基因USA300HOU_1319、pstB、pstA及pstC,以及未知转运体基因USA300HOU_0339。此外,下调的还有重组酶编码基因USA300HOU_0642、色素合成基因USA300HOU_2560及致病性相关基因USA300HOU_2561。
2.5 实时PCR确认RNA-seq结果
用实时荧光定量PCR确定RNA-seq结果。挑选38个转录发生变化的基因进行检测,按变化倍数>2、变化方向与RNA-seq相同的标准进行筛选,共验证20个基因,包括fdh、purD、thrA、leuB、oppF1、sucC、porB、nrdI、rsbW、Nth、fer、ribA等。结果详见表3,表明上述20个基因所在通路与sdhCAB敲除降低持留菌形成的水平明确相关。
2.6 PM检测明确敲除sdhCAB影响碳源代谢
PM是一种高通量技术,可同时检测菌株的大量表型。检测板各孔中预先设置了各种代谢条件,仪器可连续自动地记录细菌在不同条件下的代谢变化。细胞在代谢过程中可将四唑紫不可逆还原成紫色的甲臜,被电荷耦合的相机记录下来,每15 min记录1次,经过软件分析之后可得到时间变化曲线,从而定量、动态地记录细菌的代谢变化。比较不同菌株的曲线,可获得不同菌株在一定代谢条件下生长的异同[25]。敲除sdhCAB后,菌株对包括葡萄糖二酸等19个羧酸、半乳糖醇等20个糖类在内的碳源的代谢能力下降(表4)。对天冬氨酸等10个氨加粗字体表示此实时PCR结果与RNA-seq一致。
表3USA500与USA500ΔsdhCAB稳定初期差异表达基因列表
Tab.3ThelistofdifferentlyexpressedgenesforUSA500vs.USA500ΔsdhCABattheonsetofstationaryphase
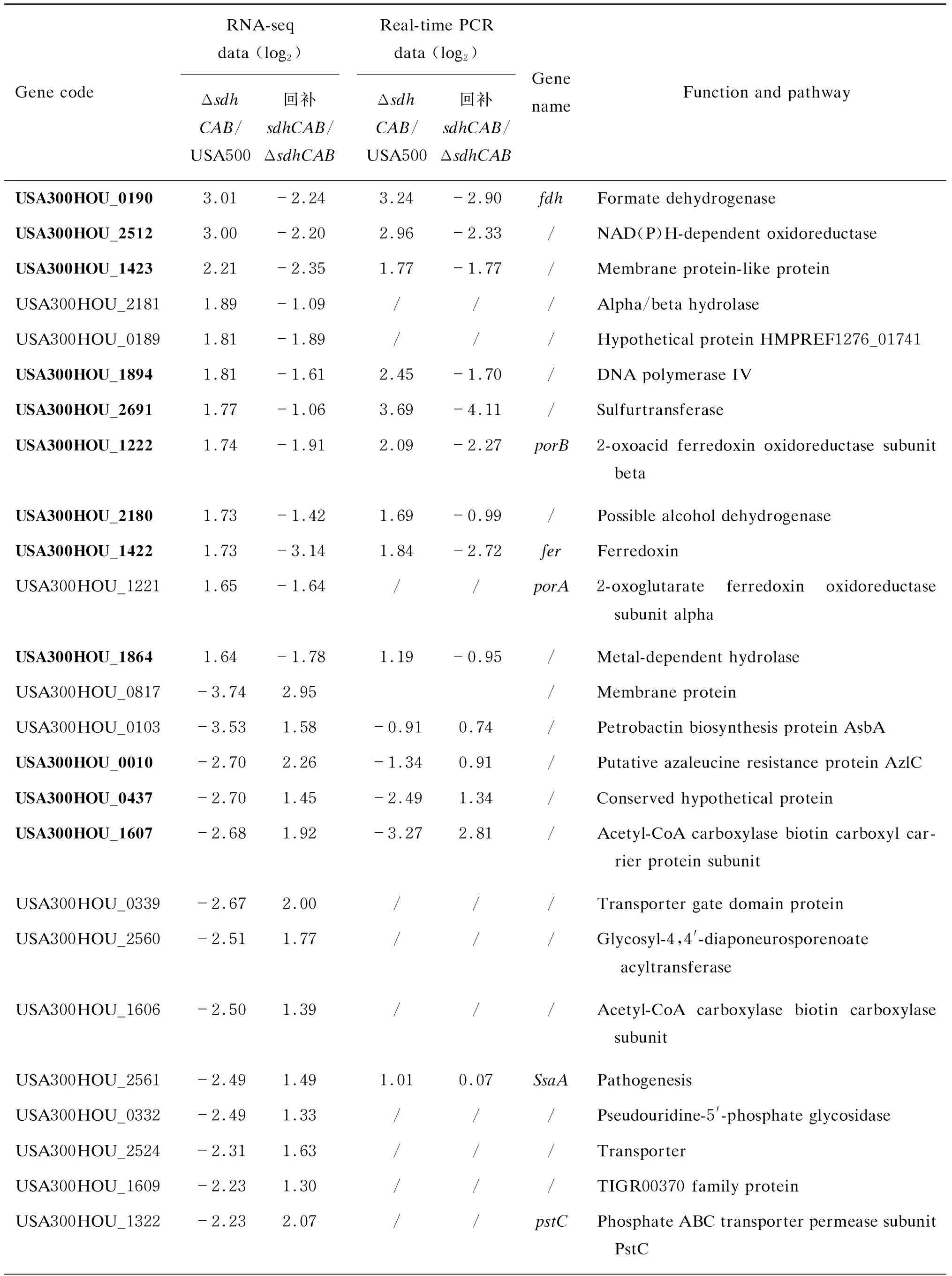
Gene codeRNA-seq data (log2)Δsdh CAB/USA500回补sdhCAB/ΔsdhCABReal-time PCR data (log2)Δsdh CAB/USA500回补sdhCAB/ΔsdhCABGene nameFunction and pathwayUSA300HOU_01903.01 -2.24 3.24 -2.90 fdhFormate dehydrogenaseUSA300HOU_25123.00 -2.20 2.96 -2.33 /NAD(P)H-dependent oxidoreductaseUSA300HOU_14232.21 -2.35 1.77 -1.77 /Membrane protein-like proteinUSA300HOU_21811.89 -1.09 ///Alpha/beta hydrolaseUSA300HOU_01891.81 -1.89 ///Hypothetical protein HMPREF1276_01741USA300HOU_18941.81 -1.61 2.45 -1.70 /DNA polymerase IVUSA300HOU_26911.77 -1.06 3.69 -4.11 /SulfurtransferaseUSA300HOU_12221.74 -1.91 2.09 -2.27 porB2-oxoacid ferredoxin oxidoreductase subunit beta USA300HOU_21801.73 -1.42 1.69 -0.99 /Possible alcohol dehydrogenaseUSA300HOU_14221.73 -3.14 1.84 -2.72 ferFerredoxinUSA300HOU_12211.65 -1.64 //porA2-oxoglutarate ferredoxin oxidoreductase subunit alphaUSA300HOU_18641.64 -1.78 1.19 -0.95 /Metal-dependent hydrolaseUSA300HOU_0817-3.74 2.95 /Membrane proteinUSA300HOU_0103-3.53 1.58 -0.91 0.74 /Petrobactin biosynthesis protein AsbAUSA300HOU_0010-2.70 2.26 -1.34 0.91 /Putative azaleucine resistance protein AzlCUSA300HOU_0437-2.70 1.45 -2.49 1.34 /Conserved hypothetical proteinUSA300HOU_1607-2.68 1.92 -3.27 2.81 /Acetyl-CoA carboxylase biotin carboxyl car-rier protein subunitUSA300HOU_0339-2.67 2.00 ///Transporter gate domain proteinUSA300HOU_2560-2.51 1.77 ///Glycosyl-4,4'-diaponeurosporenoate acyltransferaseUSA300HOU_1606-2.50 1.39 ///Acetyl-CoA carboxylase biotin carboxylase subunit USA300HOU_2561-2.49 1.49 1.01 0.07 SsaAPathogenesisUSA300HOU_0332-2.49 1.33 ///Pseudouridine-5'-phosphate glycosidaseUSA300HOU_2524-2.31 1.63 ///TransporterUSA300HOU_1609-2.23 1.30 ///TIGR00370 family proteinUSA300HOU_1322-2.23 2.07 //pstCPhosphate ABC transporter permease subunit PstC
(续表3)
基酸及D-乳酸甲酯和硫酸软骨素C等7个多聚物,以及腐胺、丙氨酰胺盐酸盐、1,2-丙二醇的代谢能力下降。回补sdhCAB后,菌株对这些化合物的代谢能力恢复。USA500 ΔsdhCAB对氨、亚硝酸盐等氮源及D-葡萄糖-1-磷酸盐等磷源的代谢能力均无显著差异。此外,与野生株相比,USA500 ΔsdhCAB对渗透压力及毒素压力、酸压力的应激没有差别。
3 讨论
本研究发现,敲除sdhCAB或sdhAB基因都会造成持留菌形成的缺陷。sdhCAB编码的琥珀酸脱氢酶可催化琥珀酸形成延胡索酸,它是细菌能量代谢中的关键,也是唯一一个同时参与三羧酸循环和电子传递链的酶[16]。sdhCAB操纵子影响持留菌的形成可能与下游代谢产物延胡索酸的形成相关。敲除sdhCAB会造成细胞内延胡索酸含量下降,从而导致持留菌形成下降[26],本研究证实了该结论。此外,琥珀酸脱氢酶作为能量代谢中的重要一环,sdhCAB操纵子可能通过影响能量代谢而影响持留菌形成。与之相似,Ma等发现能量代谢相关基因sucB及ubiF缺陷会造成持留菌形成水平下降[27]。
本课题组在以往研究中分别探究了sdhA和sdhB对USA500持留菌形成的影响,发现sdhA或sdhB基因敲除可显著影响压力条件及抗生素条件下持留菌的形成。本研究进一步证实,同时敲除sdhA和sdhB两个基因或整个操纵子,对持留菌形成的影响更明显,表明琥珀酸脱氢酶与持留菌形成密切相关。本研究还发现,敲除sdhCAB后,菌株对酸压力、氧化压力和热压力的耐受能力比敲除sdhAB更强。在抗生素压力下,sdhAB敲除株的耐受能力更强。sdhC可能是造成差异的原因,其可能在不同条件下持留菌的形成中发挥重要作用。
表4PM检测中USA500ΔsdhCAB影响碳源代谢物列表
Tab.4ThelistofthecarbonsourceswhosemetabolismattenuatedinUSA500ΔsdhCABstrainsinphenotypemicroarrayanalysis
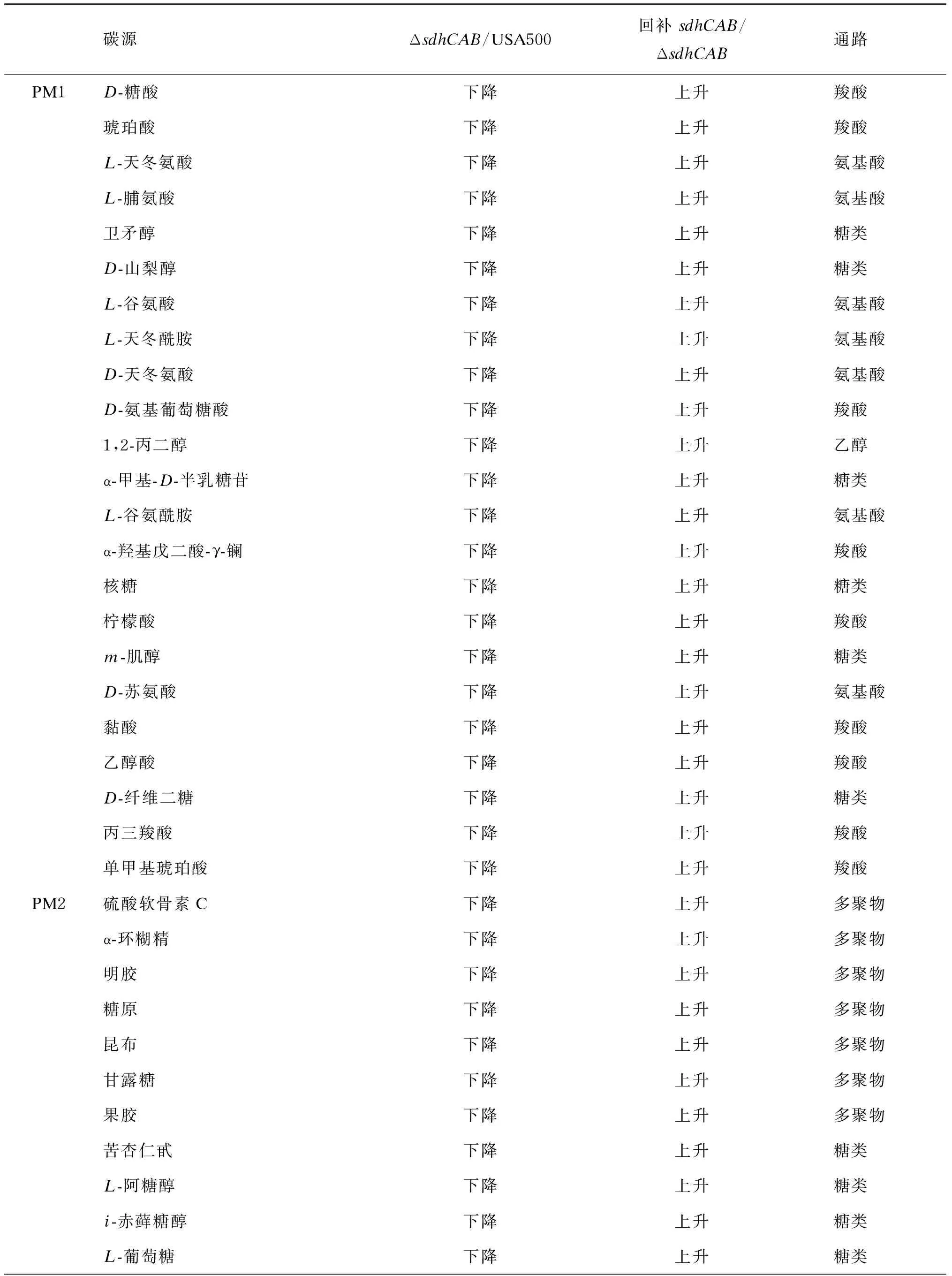
碳源ΔsdhCAB/USA500回补sdhCAB/ΔsdhCAB通路PM1D-糖酸下降上升羧酸琥珀酸下降上升羧酸L-天冬氨酸下降上升氨基酸L-脯氨酸下降上升氨基酸卫矛醇下降上升糖类D-山梨醇下降上升糖类L-谷氨酸下降上升氨基酸L-天冬酰胺下降上升氨基酸D-天冬氨酸下降上升氨基酸D-氨基葡萄糖酸下降上升羧酸1,2-丙二醇下降上升乙醇α-甲基-D-半乳糖苷下降上升糖类L-谷氨酰胺下降上升氨基酸α-羟基戊二酸-γ-镧下降上升羧酸核糖下降上升糖类柠檬酸下降上升羧酸m-肌醇下降上升糖类D-苏氨酸下降上升氨基酸黏酸下降上升羧酸乙醇酸下降上升羧酸D-纤维二糖下降上升糖类丙三羧酸下降上升羧酸单甲基琥珀酸下降上升羧酸PM2硫酸软骨素C下降上升多聚物α-环糊精下降上升多聚物明胶下降上升多聚物糖原下降上升多聚物昆布下降上升多聚物甘露糖下降上升多聚物果胶下降上升多聚物苦杏仁甙下降上升糖类L-阿糖醇下降上升糖类i-赤藓糖醇下降上升糖类L-葡萄糖下降上升糖类
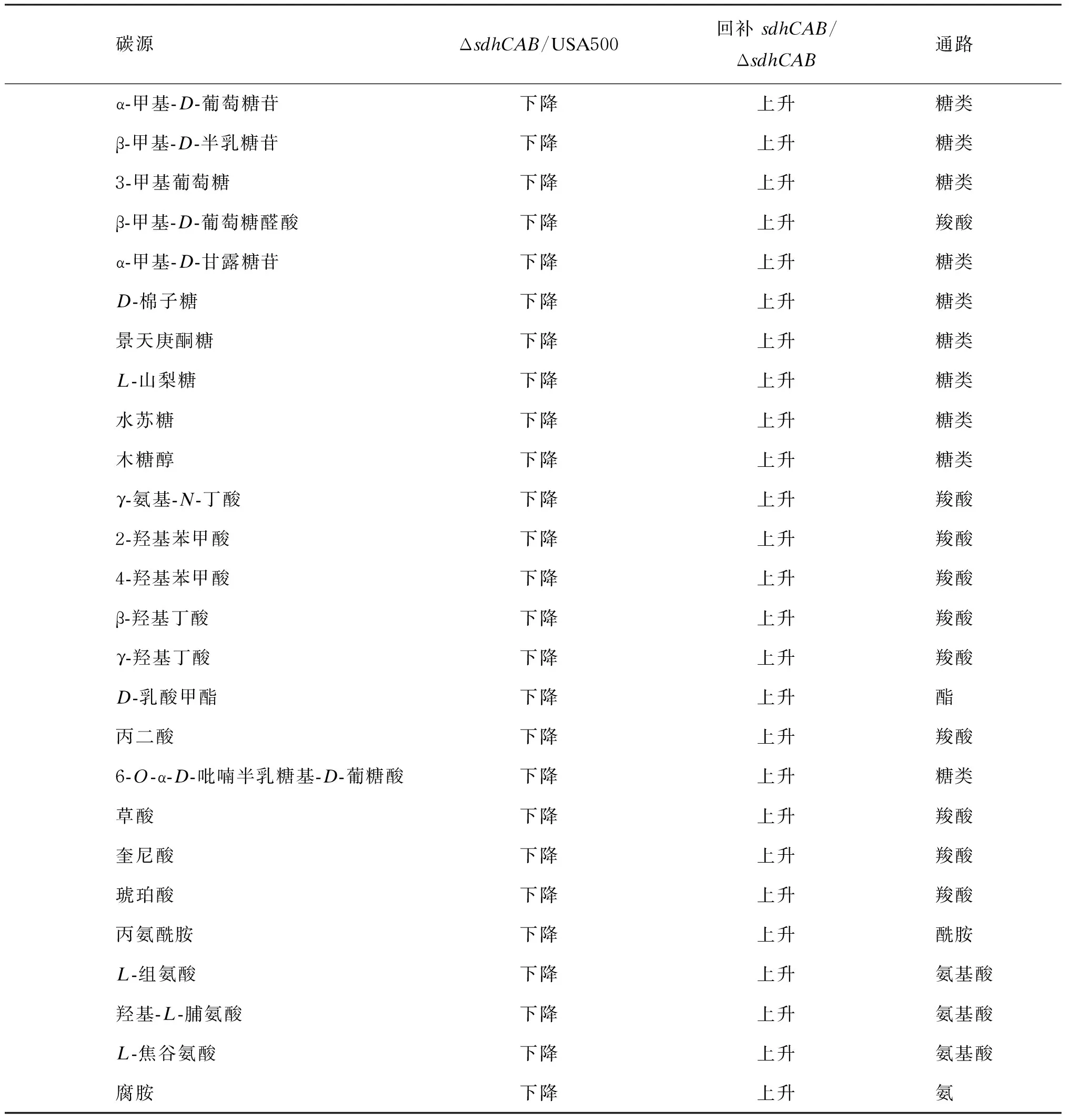
(续表4)
RNA-seq结果显示,sdhCAB操纵子敲除后三羧酸循环、甲烷代谢通路及聚合酶Ⅳ等基因表达上调,而耐药相关基因、氨基酸代谢相关基因、糖类代谢相关基因、卟啉代谢相关基因,还有一些转运体基因等表达下调,提示这些通路可能参与持留菌的形成。
在发生变化的代谢通路中,磷酸盐特异性转运系统(Pst)相关基因表达量下降。磷酸盐特异性转运系统由pstA、pstB、pstC、pstS、phoU组成,其中PstS 是结合蛋白,负责将周围的磷酸捕捉至PstA和PstC组成的跨膜孔道,进行磷的运输。PstB位于细胞内,可能为跨膜转运提供能量[28]。PhoU并没有明确功能,但其敲除后在大肠埃希菌中可造成持留菌形成缺陷[29-30]。与RNA-seq结果一致的是,Namugenyi等发现结核分枝杆菌中pst相关基因敲除会引起持留菌水平下降[31]。sdhCAB操纵子敲除后,还可能通过特定通路降低pst相关基因表达而影响持留菌形成,但确认这两者的相关性还需进一步验证。
PM检测结果显示,sdhCAB敲除后主要降低了金黄色葡萄球菌对多种碳源的代谢,但对氮源和磷源的代谢没有明显影响,这与琥珀酸脱氢酶本身主要参与糖类能量代谢相关。碳源代谢的多样性下降可能与持留菌形成相关。Amato等在大肠埃希菌中发现,虽然葡萄糖是大肠埃希菌的偏好碳源,但代谢过程中碳源代谢转换的发生可提高氧氟沙星压力条件下持留菌形成水平[32]。此外,碳源代谢的重要形式是呼吸作用。在大肠埃希菌中,抑制稳定期的呼吸作用可减少Ⅰ型持留菌的形成。Orman等[33]发现,在稳定期抑制呼吸作用后氧化还原反应受影响,持留菌水平明显下降。与代谢相关基因sucB[34]、mdh、icdA、acnB[33]、ubiF[27]的敲除均可使持留菌水平下降,进一步表明代谢水平对持留菌形成有重要影响。
持留菌是引起感染慢性化的重要原因[30,35],sdhCAB操纵子是影响持留菌形成的关键基因。sdhCAB编码的琥珀酸脱氢酶可作为重要的药物设计靶点,研发针对性杀伤金黄色葡萄球菌持留菌的药物,从而促进临床治愈金黄色葡萄球菌引起的持续性感染。Keohane等发现,天然代谢物Promysalin对铜绿假单胞菌有窄谱杀菌作用,其作用靶点就是琥珀酸脱氢酶[36],提示琥珀酸脱氢酶作为一个治疗靶标在临床治疗慢性感染方面具有巨大价值。
综上所述,sdhCAB敲除后可能通过影响下游物质合成抑制三羧酸循环及能量代谢,同时可能通过特定通路影响pst、甲烷代谢通路相关基因、聚合酶Ⅳ基因、耐药相关基因、氨基酸代谢相关基因、糖类代谢相关基因、卟啉代谢相关基因等的表达,从而降低金黄色葡萄球菌持留菌的形成,但对具体的下游通路仍需进一步探索。作为有重要生理功能的酶,琥珀酸脱氢酶对金黄色葡萄球菌毒力、生物膜形成等表型的影响也值得进一步研究。
