基于RT-LAMP的10种烈性病毒快速检测方法的研究
2018-10-22赵娜赵望刘淇夏菡师永霞袁志明
赵娜,赵望,刘淇,夏菡,师永霞,袁志明
1. 中国科学院武汉病毒研究所,武汉 430071; 2. 上海科源电子科技有限公司,上海 201611; 3. 复旦大学环境科学与工程系,上海 200433; 4. 广东出入境检验检疫局检验检疫技术中心,广州 510627
克里米亚-刚果出血热病毒(Crimean-Congo hemorrhagic fever virus, CCHFV)、埃博拉病毒(Ebola virus,EBOV)、马尔堡病毒(Marburg virus, MARV)、发热伴血小板减少综合征布尼亚病毒(severe fever with thrombocytopenia syndrome bunyavirus,SFTSV)、拉沙病毒(Lassa virus,LASV)、尼帕病毒(Nipah virus,NiV)、亨德拉病毒(Hendra virus,HeV)、鄂木斯克出血热病毒(Omsk hemorrhagic fever virus,OHFV)、裂谷热病毒(rift valley fever virus,RVFV)和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)在国际上均被列为烈性病毒,其高致死率和传染性对国际社会造成严重影响,引起了全人类的关注和警戒。其中CCHFV属于布尼亚病毒科内罗病毒属,传播媒介是蜱,在我国新疆维吾尔自治区发生过较大规模的暴发。我国多样复杂的自然条件,具备了RVFV滋生、传播的天然条件和疫情暴发的诱发条件[1]。EBOV和MARV属于丝状病毒科丝状病毒属。EBOV的自然宿主为果蝠,接触传播为最主要途径,感染后的人或动物的血液、体液、分泌物或尸体具有高度传染性。EBOV中苏丹型埃博拉病毒(Sudan Ebola virus,SEBOV)和扎伊尔型埃博拉病毒(Zaire Ebola virus,ZEBOV)的传染性极强,感染后病死率高达50%~80%[2-3],MARV感染的病死率为88%[4]。我国尚未发现埃博拉出血热、马尔堡出血热等病例。SFTSV属于布尼亚病毒科白蛉病毒属,其感染可引起发热伴血小板减少综合征,主要临床表现为发热伴血小板、白细胞减少和消化道症状,病情严重者可出现多脏器功能衰竭、弥漫性血管内凝血,甚至死亡,病死率达10%以上,2010年在我国首次发现[5-8]。NiV属副黏病毒科亨德拉尼帕病毒属,自然宿主是果蝠,传播过程中猪为主要传染源,感染后可致脑炎,潜伏期为亚临床症状,表现为中枢神经系统和呼吸系统症状,伴随体温升高、头痛、头晕和呕吐,严重者可发生败血症、胃肠道出血、肾功能损伤等并发症,曾在马来西亚等多个东南亚国家暴发[9]。我国作为亚洲经济贸易往来中心,虽然未在境内暴发NiV感染,但在我国大陆蝙蝠体内检出NiV或尼帕样病毒抗体[10]。HeV属副黏病毒科亨德拉尼帕病毒属,1994年于澳大利亚首次发现,其感染人和动物与NiV类似,出现中枢神经系统和呼吸系统症状。HeV可感染马,虽不能在人和人之间传播,但可通过接触感染马匹的尿液等发生传播[11]。我国尚未出现HeV感染病例,但鉴于HeV与NiV的特征类似,有存在的可能性。RVFV属于布尼亚病毒科白蛉病毒属,传播媒介是蚊类,人类可通过接触染病动物而感染,另有文献证明该病毒可经气溶胶传播[12]。感染后症状为中枢神经症状和出血倾向,有类似于其他出血热的典型症状,如发热、呕吐、腹痛、腹泻等,病死率约为1%[13]。2016年我国北京报道1例输入性RVFV感染病例。MERS-CoV是一种新型冠状病毒,2012年首先发现于沙特阿拉伯[14],可感染人和动物,引起严重呼吸系统症状,重者出现肾脏衰竭和死亡,近年来引起国际社会的广泛关注。2015年5—7月,韩国发生MERS暴发流行,我国于2015年发现首例输入性病例[15]。目前,尚无特效药物针对这些烈性病毒感染的治疗,一旦暴发,有迅速传播的风险,需提高警戒。
2015年3月28日,国家发展和改革委员会、外交部、商务部联合发布了《推动共建丝绸之路经济带和21世纪海上丝绸之路的愿景与行动》。随着“一带一路”政策的推进,中国与丝绸之路沿线的亚、非、欧洲国家的战略往来日益频繁,边境地区互通互联。边境口岸作为通道节点,人口流通性较大,也使境外病毒传入我国或使我国公民境外感染的概率增大,进而可能导致我国境内烈性病毒的传播。因此,需提前做好防控工作,一旦发现疑似病例,快速检测确认并进行控制。
环介导等温扩增法(loop-mediated isothermal amplification,LAMP)是Notomi于2000年开发的一种恒温核酸扩增技术,技术要点是在恒温(63~65 ℃)条件下,通过4~6条特异性引物与模板的 6~8 个区间特异结合,在具有链置换作用的BstDNA聚合酶作用下,快速高效进行扩增。其产物为具有不同茎环数的DNA双链混合物,产物经琼脂糖凝胶电泳检测可见梯形条带。
LAMP在核酸快速检测中有重要意义,通常检测可于60 min内完成,且1 h产物可达109数量级,高效、快速、简洁的特点使其成为近十几年来各类病原快速检测方法之一。针对以上10种烈性病毒,已有多篇文献采用LAMP,但报道的引物与本研究所用研发试剂和仪器的适配性需进一步筛选验证。因此,本研究使用前期研究验证的可稳定高效扩增的试剂和操作简便的恒温扩增荧光读数仪[16],通过筛选已报道的或自主设计的针对10种烈性病毒的高特异度、高灵敏度恒温扩增引物,建立实验室快速便捷的反转录LAMP(reverse transcription-LAMP,RT-LAMP)高通量检测方法,并用于人血清样品检测。
1 材料与方法
1.1 体外RNA标准品制备
以含10种烈性病毒靶基因的质粒[pcDNA3.1(+)-RVFV、pcDNA3.1(+)-ZEBOV-NP-Mayinga、pcMNP-2、pcDNA3.1(+)-CCHFV-S、pcDNA3.1(+)-NiV-NP、pcDNA3.1(+)-LASV-NP、pcDNA3.1(+)-HeV-NP、pcDNA3.1(+)-OHFV-NP、pcDNA3.1(+)-SFTSV、pBlunt-MERS-NP]为模板,选取合适酶切位点进行酶切。然后使用NEB HiScribe T7 Quick High Yield RNA Synthesis Kit进行体外转录,饱和酚-氯仿抽提核酸。按试剂盒说明依次加入RNase-free水、NTP Buffer Mix、Template DNA和T7 RNA Polymerase Mix,37 ℃孵育2 h,加入2 μL DNase Ⅰ和30 μL RNase-free水,继续37 ℃孵育15 min;加入25 μL LiCl,于 -20 ℃ 沉淀RNA 30 min,以最大离心速度4 ℃离心15 min,弃上清液,加入500 μL预冷的 70%乙醇洗涤。最后用50 μL DEPC水溶解RNA,-80 ℃ 冻存备用[16]。
1.2 方法
1.2.1RT-LAMP检测引物的设计和筛选4种病毒采用自主设计引物:在GenBank中收集EBOV、HeV、NiV和OHFV的序列信息。EBOV的NP基因为核衣壳编码基因,是一段高度保守的序列,因此收集GenBank中已发表的致死率最高的ZEBOV NP基因相关序列信息;NiV和HeV的NP基因较保守,因此收集GenBank中全部NiV NP和HeV NP基因的序列信息;收集OHFV不同代表毒株中保守基因E的序列信息,共33个。使用MEGA软件对以上病毒基因序列进行比对,选取200 bp左右片段,用在线LAMP引物设计软件Primer Explorer V4(http://primerexplorer.jp/e/)进行特异性引物设计,每个病毒设计5套引物,比较5套引物扩增效率和特异性以获得最佳引物(表1)。
另外6种病毒采用筛选已报道引物的方法:通过查找收集RVFV、CCHFV、LASV、MARV、SFTSV和MERS-CoV相关文献获得LAMP检测引物信息[17-23],获得同一病毒的多套已报道引物,再次进行筛选以获得最优引物对。
表1LAMP引物设计相关GenBank信息
Tab.1DesignedprimersforLAMPinGenBank

GenBank accession numberOHFV (E)AF482341.2, AF482354.2, AF482352.2, AF482351.2, AF482350.2, AF482348.2, AF482347.2, AF482346.2, AF482345.2, AF482344.2, AF482343.2, AF482342.2, JX315615.1, JX315614.1, JX315613.1, JX315612.1, JX315611.1, JX315610.1, JX315609.1, JX315608.1, JX315607.1, JX315606.1, JX315605.1, AB507800.1, AY193805.1, GU290187.1, AY438626.1, AY323489.1, AF482355.1, X66694.1EBOV (NP)AF272001.1, KY425656.1, KY425652.1, KY425649.1, KU174142.1, KU174141.1, KU174140.1, KU174139.1, KU174138.1, KU174137.1, KR063671.1, KM655246.1, KC242801.1, KC242791.1, AF086833.2, AY142960.1, L11365.1, AF499101.1, J04337.1, EU224440.2, KU321146.1, KT762962.1HeV (NP)HM044317, HM044318, HM044319, HM044320, HM044321, JN255800, JN255801, JN255802, JN255803, JN255804, JN255805, JN255806, JN255812, JN255814, JN255817, JN255818, NC001906NiV(NP)AF376747, AJ564621, AJ564622, AJ564623, AJ627196, AY029767,AY029768, AY858110, AY988601, FJ513078, FN869553, JN808857,JN808858, JN808859, JN808860, JN808861, JN808862, JN808863, JN808864, NC002728
1.2.2RT-LAMPRT-LAMP体系为自主研发,具体如下。总反应体积25 μL:1×Buffer(含2 mmol/L MgSO4)、6 mmol/L MgSO4、dNTP Mix(10 mmol/L)、FIP/BIP Primers 1.6 μmol/L、F3/B3 Primers 0.2 μmol/L、LoopF/B Primers 0.4 μmol/L、BstDNA聚合酶(8 U)、反转录酶(2 U)、1×核酸染料、RNA(2 μL),加入矿物油20 μL。反应条件为63 ℃ 45 min。本研究使用的新型恒温扩增荧光检测仪(version 1.0)和试剂均已在蚊媒病毒检测中得到验证和评估[16]。
1.2.3待检测样品及其RNA提取本研究中10个检测对象均为国家重大传染病病原,有些病毒在国内尚无感染病例,本实验室也无这些病毒的储备资源。为了生物安全,本研究使用体外转录RNA,安全可靠。为评估检测方法,通过与广东出入境检验检疫局检验检疫技术中心合作,检测30份血清样品,分别从泰国、菲律宾、老挝、缅甸、墨西哥、马来西亚、印度尼西亚、迪拜、苏里南、日本、菲律宾、埃及、印度、越南、新加坡等地归国,于广州天河机场入境的发热患者中采集。
使用QIAamp Viral RNA Mini Kit试剂盒,在生物安全二级实验室对未知样品进行核酸提取。提取步骤如下:吸取560 μL Buffer AVL,加至 -20 ℃ 冻存的1.5 mL含5.6 μL配好的Carrier RNA的EP管内。取细胞上清液140 μL,加入装有Buffer AVL-Carrier RNA的离心管中,振荡混匀15 s,室温放置10 min后瞬时离心;加入560 μL无水乙醇,振荡15 s充分混匀后瞬时离心;吸取630 μL上述溶液,加至已装入到2 mL离心管中的吸附柱,8 000 r/min离心1 min;换新收集管, 重复上一步骤;加入500 μL Buffer AW1,8 000 r/min离心1 min;换新收集管,加入500 μL Buffer AW2,14 000 r/min离心3 min;换新收集管,同速离心 1 min。将吸附柱放至1.5 mL无RNase离心管中,弃收集管,加入60 μL Buffer AVE,室温放置 1 min,8 000 r/min离心1 min,-80 ℃冻存。
广东出入境检验检疫局检验检疫技术中心使用QIA Tube,只需加入 Buffer AVL,后续操作均由仪器完成。单次可处理12份样品,1 h内即可获得60 μL样品RNA,-80 ℃分装冻存。
2 结果
2.1 引物信息
LAMP引物包括2条外引物(F3和B3)、2条内引物(FIP和BIP)和2条环引物(LF和LB)。选取OHFV的E基因,经序列比对后选取保守区域作为引物靶区域,扩增范围为203 bp,位置为2147~2350。EBOV的NP基因经序列比对后选取保守区域作为引物靶区域,扩增范围为184 bp,位置为2068~2252。HeV和NiV的NP基因经序列比对后的保守区域作为引物靶区域,扩增范围为254 bp,位置为367~621。EBOV、NiV、HeV和OHFV的详细引物序列及位置信息详见表2。
2.2 引物特异度
尚无研究报道EBOV、NiV、HeV、OHFV的LAMP引物,因此采用在线软件设计引物,对10个检测目标进行无交叉扩增,特异度良好。RVFV、MARV、 CCHFV、LASV、SFTSV和MERS-CoV的RT-LAMP引物已有报道,经筛选,最终选用的引物均具备良好的特异度。10种检测病毒之间无交叉扩增,且设立3个蚊媒病毒寨卡病毒(Zika virus,ZIKV)、登革病毒2型(dengue virus type 2,DENV2)和黄热病病毒(yellow fever virus,YFV)为阴性对照,检验其特异度。10套引物的特异度详见表3。
2.3 引物灵敏度
10套引物在本研究所用研发试剂体系中对10种烈性病毒的最低检出限为1~100拷贝/反应体系。各病毒的检出限和检出时间具体如下(每个反应体系25 μL):EBOV使用实验室设计引物,可于 23.3 min检出10拷贝;OHFV使用实验室设计引物,可于 44.0 min检出10拷贝;RVFV使用文献引物,可于 18.0 min检出10拷贝;SFTSV使用文献引物,可于 23.0 min检出10拷贝;NiV和HeV使用实验室设计引物,可于 14.3 min分别检出 1和10拷贝;LASV使用文献引物,可于 23.0 min检出10拷贝;MARV使用文献引物,可于 32.0 min检出 10 000 拷贝;CCHFV使用文献引物,可于 38.0 min检出100拷贝;MERS-CoV使用文献引物,可于 29.0 min检出1拷贝。其中MARV和CCHFV使用文献引物,经过多次实验且优化体系后,两套引物均未达所报道的灵敏度,检出限高出2个数量级,有待进一步分析。10套引物的灵敏度及对应出峰时间详见表4。
2.4 血清样本检测
对从泰国、菲律宾、老挝、缅甸、墨西哥、马来西亚等地入境广州的发热人员的30份血清样品进行检测,同时采用本实验室已建立的蚊媒病毒引物进行检测。结果筛选到1份ZIKV阳性样品,与报道的2016年2月我国首例输入性寨卡病例[24]一致。筛选到2份DENV阳性样品:1例2016年4月从巴厘岛归国,在广州天河机场入境的发热患者,检测到DENV1;1例2018年2月从柬埔寨经广州天河机场入境的发热患者,检测到DENV2。筛选到1份RVFV阳性样品,来自2016年从安哥拉经广东天河机场入境的患者。以上阳性结果均与传统反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)结果一致,检测结果详见表5。
表2LAMP引物信息
Tab.2LAMPprimers
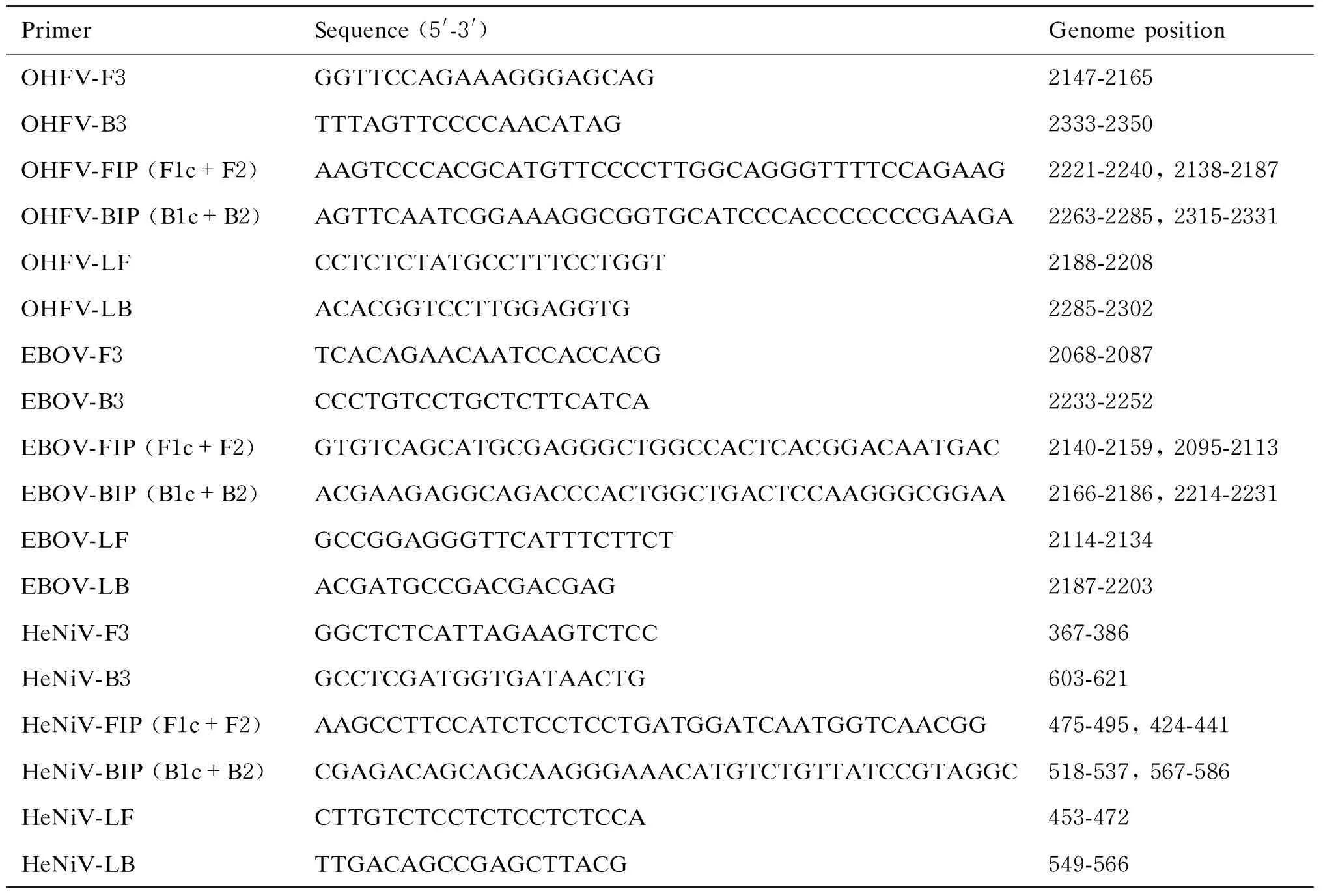
PrimerSequence (5'-3')Genome positionOHFV-F3GGTTCCAGAAAGGGAGCAG2147-2165OHFV-B3TTTAGTTCCCCAACATAG2333-2350OHFV-FIP (F1c+F2)AAGTCCCACGCATGTTCCCCTTGGCAGGGTTTTCCAGAAG2221-2240, 2138-2187OHFV-BIP (B1c+B2)AGTTCAATCGGAAAGGCGGTGCATCCCACCCCCCCGAAGA2263-2285, 2315-2331OHFV-LFCCTCTCTATGCCTTTCCTGGT2188-2208OHFV-LBACACGGTCCTTGGAGGTG2285-2302EBOV-F3TCACAGAACAATCCACCACG2068-2087EBOV-B3CCCTGTCCTGCTCTTCATCA2233-2252EBOV-FIP (F1c+F2)GTGTCAGCATGCGAGGGCTGGCCACTCACGGACAATGAC2140-2159, 2095-2113EBOV-BIP (B1c+B2)ACGAAGAGGCAGACCCACTGGCTGACTCCAAGGGCGGAA2166-2186, 2214-2231EBOV-LFGCCGGAGGGTTCATTTCTTCT2114-2134EBOV-LBACGATGCCGACGACGAG2187-2203HeNiV-F3GGCTCTCATTAGAAGTCTCC367-386HeNiV-B3GCCTCGATGGTGATAACTG603-621HeNiV-FIP (F1c+F2)AAGCCTTCCATCTCCTCCTGATGGATCAATGGTCAACGG475-495, 424-441HeNiV-BIP (B1c+B2)CGAGACAGCAGCAAGGGAAACATGTCTGTTATCCGTAGGC518-537, 567-586HeNiV-LFCTTGTCTCCTCTCCTCTCCA453-472HeNiV-LBTTGACAGCCGAGCTTACG549-566
表310种烈性病毒RT-LAMP引物的特异度
Tab.3SpecificityofRT-LAMPprimersoftenviruses

EBOVMARVLASVNiVHeVOHFVSFTSVCCHFVRVFVMERS-CoV10 detected virusesEBOV+---------MARV-+--------LASV--+-------NiV---++-----HeV---++-----OHFV-----+----SFTSV------+---CCHFV-------+--RVFV--------+-MERS-CoV---------+ControlDENV2----------YFV----------ZIKV----------
表410种烈性病毒RT-LAMP引物的灵敏度
Tab.4SensitivityofRT-LAMPprimersoftenviruses

VirusEBOVMARVLASVNiVHeVOHFVSFTSVCCHFVRVFVMERS-CoVCopies/25 μL1010 000101101010100101Time (min)23.332.023.014.314.344.023.038.018.029.0
表5广东省30份血清样品RT-LAMP检测结果
Tab.5RT-LAMPresultsof30serumsamplesfromGuangdongProvince
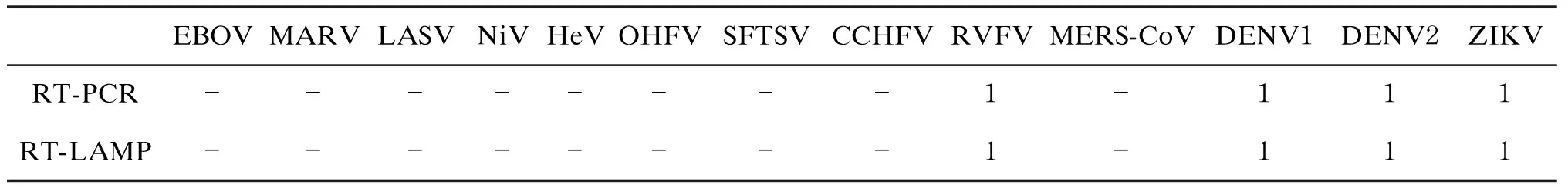
EBOVMARVLASVNiVHeVOHFVSFTSVCCHFVRVFVMERS-CoVDENV1DENV2ZIKVRT-PCR--------1-111RT-LAMP--------1-111
3 讨论
我国自然环境丰富,人口基数大,与各国贸易往来频繁,人口流动逐年增加,各类病毒暴发的风险也上升。其中CCHFV和SFTSV在我国本土均发生过流行,CCHFV于2001年流行尤为严重,共报道209例患者,死亡40例[25]。RVFV、EBOV、MARV、NiV、LASV、HeV、OHFV和MERS-CoV等烈性病毒虽未在我国本土暴发,但随着输入性病例的相继报道[24,26],以及我国石正丽等在蝙蝠体内发现NiV或尼帕样病毒抗体,表明这些病毒对我国生物安全仍存在潜在威胁,可能给经济发展和公共卫生造成严重影响。因此,提前建立健全烈性病毒的快速、高效、高通量检测方法尤为重要。
传统病毒检测方法中,常见各类基于PCR的核酸检测技术、病毒分离培养、形态学鉴定、抗原抗体反应等。传统的病毒检测方法具有周期长、需专业人员操作、所需试剂繁多等缺点,不能满足现在检测的需求。其中实验室常用的以PCR为基础的各种核酸检测技术,虽然方法简单,但仪器设定程序繁琐,且需附加检测步骤才可判定结果;病毒分离培养,需精细的细胞培养和安全防护,操作繁琐,对实验人员和实验环境要求很高,不适合在室外现场检测;基于抗原抗体反应的免疫学检测技术,依赖高质量抗体,成本高,不具备大量检测的优势。近年来,很多新兴检测技术逐渐取代了传统方法,其中恒温扩增方法有很多优越性,尤其是LAMP方法,在现场检测方面展现了很大的优势。
LAMP方法有以下优势:反应为等温条件,减少了对仪器设备的要求,在低配实验环境中使用普通加热装置如水浴锅即可实现扩增;反应高效,1 h可扩增108~1010数量级;灵敏度高,最低检出限为1拷贝[27],比PCR高10~100倍[28];特异度高,可使用4~6条引物靶向6~8个目标序列区域。LAMP方法也有不足之处,即多条引物产生的非特异结合、气溶胶中核酸污染产生的假阳性,以及同属病毒的亲缘性导致的非特异性扩增,导致检测灵敏度、精确度降低。本研究采用研发新体系和恒温扩增荧光检测仪,研发试剂为固定化反应管,检测时只需加入待测模板,配制体系简单易行,不易污染。新型恒温扩增荧光检测仪可实时监测,数据可导出分析,仪器轻便,适合在现场快速检测。本研究通过引物的多套优化筛选,最终采用的引物均有很高特异度,其中EBOV、OHFV、NiV和HeV的LAMP引物为本实验室设计。NiV和HeV为同属病毒,对人的危害极高,被列为我国生物安全四级病原。两种病毒使用同一套引物,对同属其他病毒无交叉扩增,特异度良好。建立该方法时,使用标准核酸模板进行特异度实验,RT-LAMP引物表现出较高的特异度。在初步应用中,因检测样品数较少,未发现RT-LAMP非特异性扩增。但今后检测组织或环境样品等复杂样品时,待检测核酸的复杂性可能导致非特异性扩增,进而对结果产生误判。因此,本研究仅为疑似病例的初步筛查提供检测手段,其在大量样本中应用的特异度需进一步扩大样品量后补充数据并改进。
本研究中检测方法的灵敏度或总耗时优于已报道的方法。Park等[29]针对EBOV和MARV的NP片段建立RT-PCR,灵敏度为5×10-6ng/μL(BEBOV、TEBOV、ZEBOV),本研究建立的LAMP方法灵敏度较之高1个数量级。Sun等针对SFTSV的S片段建立的RT-PCR检出限为10拷贝/μL[30],本研究建立的LAMP方法较之高2个数量级。袁帅等[31]针对CCHFV的S片段设计荧光定量RT-PCR,灵敏度为726拷贝/μL,本研究建立的LAMP方法较之高10~100倍,且仪器设备操作简化,检测体系配制更简单。针对OHFV的E基因尚未有研究报道基因LAMP检测方法的建立,本研究结果显示LAMP方法的灵敏度较RT-PCR高2个数量级。Drosten等[32]建立针对LASV NP基因的RT-PCR,灵敏度为200拷贝/μL,比本研究高2个数量级;其针对RVFV G2基因设计实时RT-PCR,检出限为 820拷贝/μL,低于本研究3个数量级。针对NiV和HeV NP的RT-PCR,检出限为100拷贝/μL[33]。针对MERS-CoV NP基因建立的多重荧光定量RT-PCR,检出限为10 pfu/mL[34],与本研究相同,但其需设计探针引物,成本高,操作复杂,不适合大量样品筛查。
此外,将LAMP方法的灵敏度与其他检测方法如芯片技术、探针技术等进行比较。其中基于多重PCR结合液相芯片技术建立的液相芯片筛查方法,灵敏度如下:RVFV为10 ng/PCR,西尼罗病毒(West Nile virus,WNV)为1 ng/PCR,EBOV为10 ng/PCR,CCHFV 为10 pg/PCR[35]。蛋白质芯片检测ZEBOV的灵敏度为 100 pfu/mL[36]。这两种结合芯片的检测方法虽然灵敏度较高,但完成整个检测耗时长,且操作要求高,不适用现场检测。2016年有研究建立LAMP检测EBOV的方法,检出下限为 64 拷贝/反应[37],比本研究低6倍。本研究采用的研发体系中,模板量为108拷贝时,可于7 min报告检测结果;配合研发试剂,可检测1~10拷贝的模板,具有较高灵敏度。
本研究从30份人血清样本筛查到的蚊媒病毒中,1份YFV阳性,2份DENV阳性,1份ZIKV阳性。另有1份RVFV阳性,来自2016年从安哥拉经广东天河机场入境的患者。以上结果与RT-PCR检测结果一致,证明LAMP方法可靠、可行。本研究使用的研发试剂和研发仪器简化了检测反应,适合在海关口岸、现场进行快速高通量检测,挖掘了采用LAMP快速筛查海关口岸等地出入境人员是否携带重大烈性传染病病毒的潜力,前景非常好。目前,本实验室正合作开发常见蚊媒病毒RT-LAMP检测芯片和烈性病毒RT-LAMP检测芯片,以实现整合检测,目标是单次反应可在芯片上同时检测多种病毒,单个芯片可一次筛查多份样品,从而实现更高通量的检测。希望今后能应用于海关口岸等人口流动性大的地区或实验室配置较低的基层地区疑似患者的检测,以确保边境出入境人员及基层地区人员的安全。
