不同比生长速率对毕赤酵母发酵生产植酸酶的影响
2018-10-19赵凯葛菁华王海
赵凯, 葛菁华, 王海
(青岛蔚蓝生物集团有限公司,山东 青岛 266101)
植酸酶作为一种高效的饲料添加剂,在动物体内可以帮助其降解植酸盐,改善磷和其他养分的消化吸收,减少养分排泄,提高磷的利用率,增加养殖户的经济效益,同时对降低植酸磷对环境的污染有重要作用。目前,养殖业对植酸酶的需求越来越大,同时更加关注其成本。因此,提高植酸酶表达量,降低发酵成本成为植酸酶研究、生产的当务之急。
毕赤酵母植酸酶发酵工艺优化的研究已有很多报道。李洪淼等[1]对巴斯德毕赤酵母的高密度发酵条件进行了实验,并根据摇瓶发酵的优化结果进行了补料方式的研究。黄魁英等[2]对植酸酶毕赤酵母基因工程菌PEY-2的发酵条件进行了研究。郭美锦等[3]对重组毕赤酵母表达工程植酸酶过渡相参数进行了分析研究。闵兆升等[4]采用单因素试验和正交试验考察了不同工艺条件对毕赤酵母工程菌H311产植酸酶的影响。王兴吉等[5]对毕赤酵母H工程菌30 L发酵产植酸酶的发酵条件及该酶的热稳定性进行了研究。

1 研究方法
1.1 实验材料
1.1.1 菌株
重组毕赤酵母基因工程菌(Mut+),由本公司自行构建,分泌表达植酸酶。
1.1.2 培养基
种子培养基为酵母浸出粉胨葡萄糖(YPD)培养基,发酵培养基为基础盐(BSM)培养基(用葡萄糖替换甘油)。
1.2 方法
1.2.1 种子培养
将保藏菌种接种到50 mL的YPD培养基中培养18~24 h,再按照10 %接种量接种YPD培养基扩培16~24 h,然后按照8 %接种量接入发酵罐BSM培养基中发酵培养。
1.2.2 发酵控制
流加氨水控制pH 4.5,底糖耗尽后通过流加含12 mL/L 微量盐(PTM1)培养基的60 %的葡萄糖增加湿重,控制相同湿重(180 g/L左右)开始诱导,根据实验需求和测量的湿重控制不同比生长速率(μ)0.01 h-1、0.015 h-1、0.02 h-1进行相应的甲醇补料诱导植酸酶表达。每隔8 h或16 h取样测湿重,然后调节甲醇补料量为湿重与比生长速率乘积。
1.2.3 分析方法
细胞湿重测定:10 mL发酵液10 000 r/min离心10 min后弃上清称重;植酸酶酶活测定:GB/T 18634—2009饲用植酸酶活性的测定分光光度法[12]。
2 结果与讨论
2.1 对照实验
发酵液底料中含有30 g/L葡萄糖,葡萄糖耗尽之后DO回升,此时开始流加60 %的葡萄糖直至诱导所需湿重180 g/L(大约发酵时间24 h时),之后停止流加葡萄糖,饥饿30 min左右,开始流加甲醇诱导产酶。对照组甲醇流加策略参照Invitrogen毕赤酵母发酵手册[13]进行控制,速度从1 g/(L·h)开始,每两小时提高0.5 g/( L·h),直到甲醇流加速度为4.5 g/(L·h)时,停止继续提高,并以该流速至发酵结束。
由图1可知,发酵40 h时(大约诱导后15 h左右),湿重186 g/L,酶活691 U/mL,随后酶活和湿重随发酵时间增加,发酵144 h时湿重出现轻微下降,最后两个取样点酶活基本相同,至发酵168 h时下罐,此时湿重408 g/L,酶活10 282 U/mL。
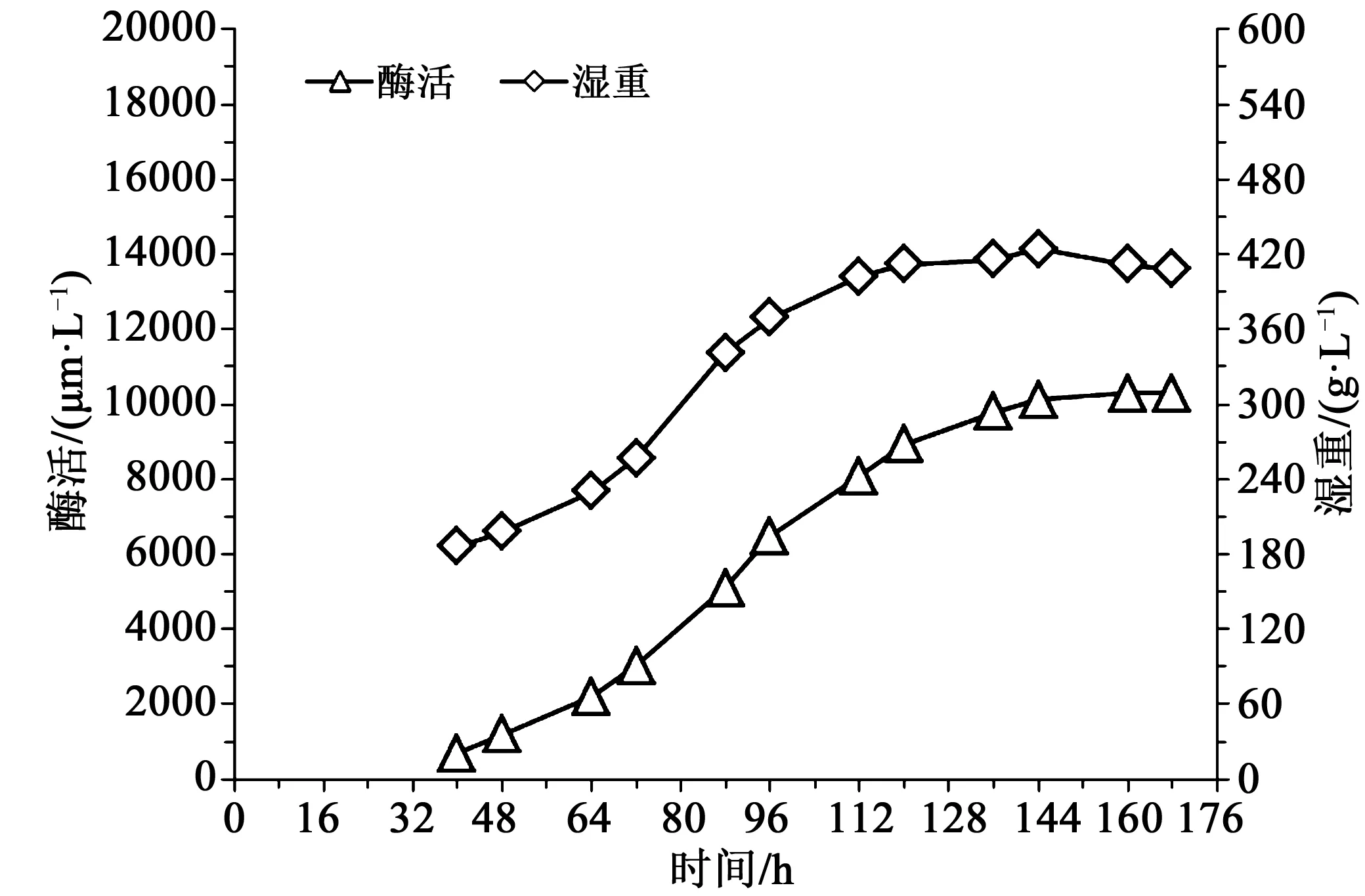
图1 对照酶活湿重曲线Fig.1 Enzyme activity and wet cell weight profile of the control group
2.2 比生长速率为0.01 h-1时的产酶状况
甲醇诱导产酶之前的过程同2.1。甲醇流加速度从1 g/(L·h)开始,按照0.01 h-1乘以相应的湿重(每8 h或16 h取样测湿重,然后进行相应的甲醇流速调节)所得的速度进行甲醇补料。
由图2可知,发酵40 h时,湿重192 g/L,酶活583 U/mL,随后酶活和湿重随发酵时间增加,酶活168 h时出现轻微下降,至发酵168 h时下罐,此时湿重457 g/L,酶活11 763 U/mL。以0.01 h-1的比生长速率进行甲醇流加,发酵最终消耗甲醇5.3 L,而对照组甲醇消耗6.2 L,尽管甲醇消耗比对照少14.5 %,但是酶活却比对照高14.4 %。
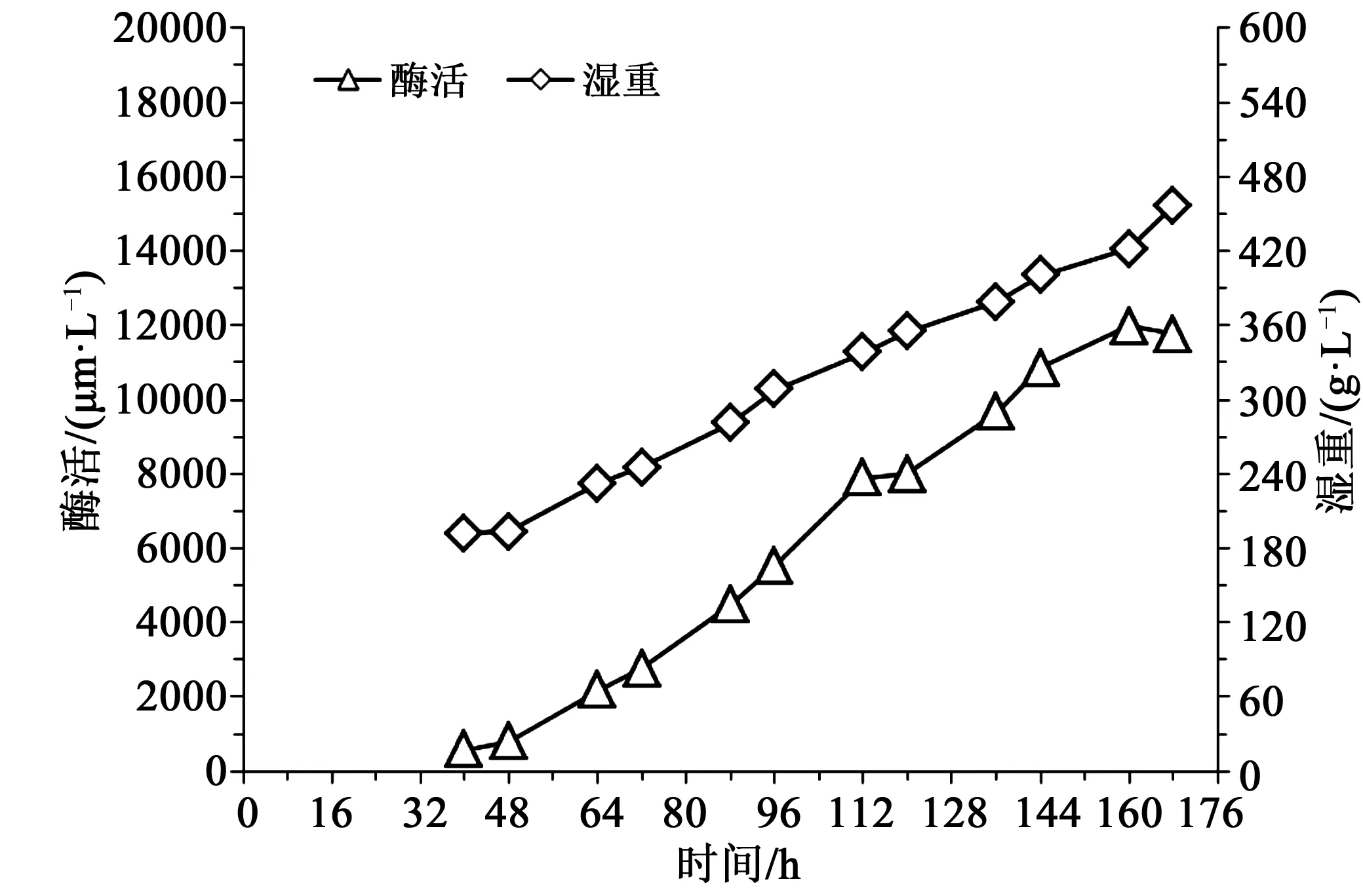
图2 比生长速率0.01 h-1时酶活湿重曲线Fig.2 Enzyme activity and wet cell weight curve at specific growth rate adjusted to 0.01 h-1
2.3 比生长速率为0.015 h-1时的产酶状况
甲醇诱导产酶之前的过程同2.1。甲醇流加速度从1 g/(L·h)开始,按照0.015 h-1乘以相应的湿重(每8 h或16 h取样测湿重,然后进行相应的甲醇流速调节)所得的速度进行甲醇补料。
由图3可知,发酵40 h时,湿重185 g/L,酶活423 U/mL,随后酶活和湿重随发酵时间增加,144 h时湿重出现下降,至发酵168 h时下罐,此时湿重482 g/L,酶活13 644 U/mL。以0.01 h-1和0.015 h-1的比生长速率进行甲醇补料,中前期酶活和对照相当甚至比对照低,但是随着发酵进行,菌体湿重增大,甲醇流加量增大,最终发酵酶活都超过对照组。
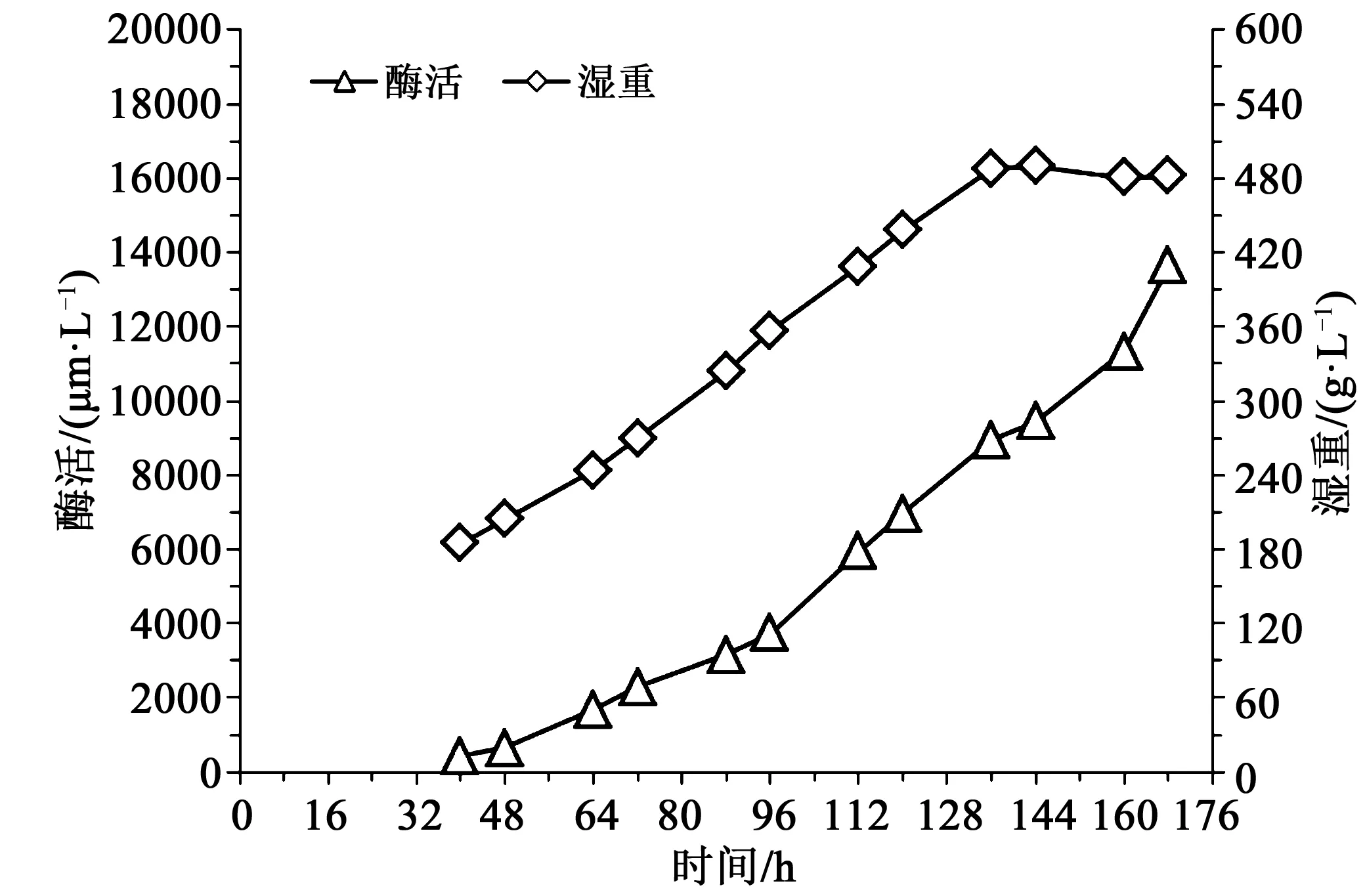
图3 比生长速率0.015 h-1时酶活湿重曲线Fig.3 Enzyme activity and wet cell weight curve at specific growth rate adjusted to 0.015 h-1
2.4 比生长速率为0.02 h-1时的产酶状况
甲醇诱导产酶之前的过程同2.1。甲醇流加速度从1 g/(L·h)开始,之后按照0.02 h-1乘以相应的湿重(每8 h或16 h取样测湿重,然后进行相应的甲醇流速调节)所得的速度进行甲醇补料。
由图4可知,发酵40 h时,湿重190 g/L,酶活712 U/mL,随后酶活和湿重随发酵时间一直增加,至发酵168 h时下罐,此时湿重524 g/L,酶活17 445 U/mL。以0.02 h-1的比生长速率进行甲醇补料时,酶活一直比对照和其他两个实验组高,可以推断前期菌体适应甲醇后,在一定范围内,甲醇量越高对产酶越有利。而以0.02 h-1的比生长速率进行甲醇流加,最终酶活比对照提高69.7 %,因此,以合适的比生长速率控制甲醇流加,可能会引起菌体代谢流的改变,更多的代谢能量和物质流向产酶通路。
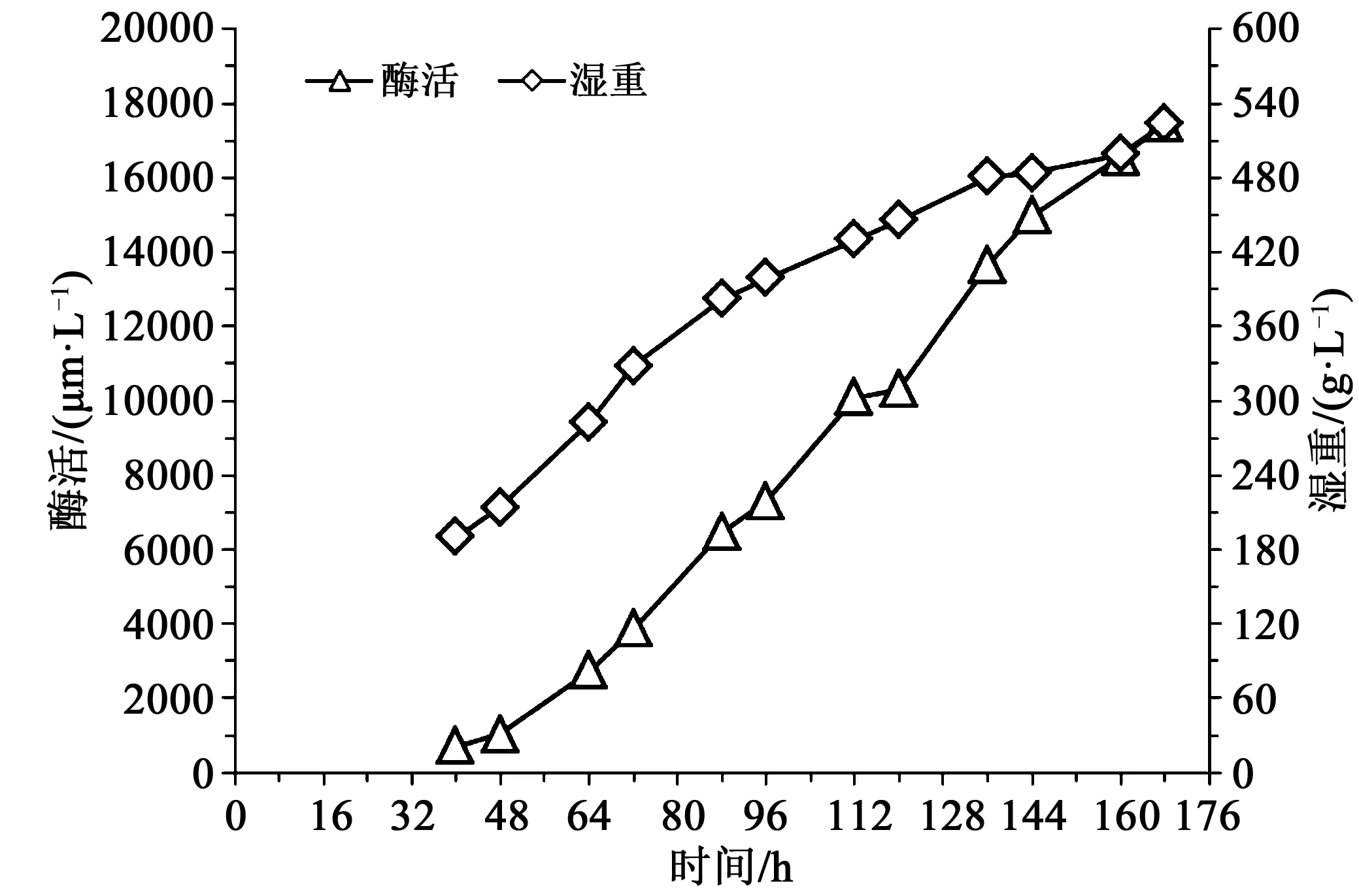
图4 比生长速率0.02 h-1时酶活湿重曲线Fig.4 Enzyme activity and wet cell weight curve at specific growth rate adjusted to 0.02 h-1
由图5可知,随着底糖消耗DO逐渐降低,至16 h左右,底糖耗尽,DO回升,随之开始补糖流加,至发酵24 h左右湿重达到180 g/L,停糖饥饿30 min,此时DO大幅回升,然后按照1 g/(L·h)的速度流加甲醇3 h,之后按照各自甲醇流加策略分别进行甲醇流加。发酵中期DO水平与甲醇流加量相关,甲醇流加量大,DO水平低,而发酵后期DO基本都跌零,但是通过对发酵液进行液相检测,甲醇几乎没有残留。
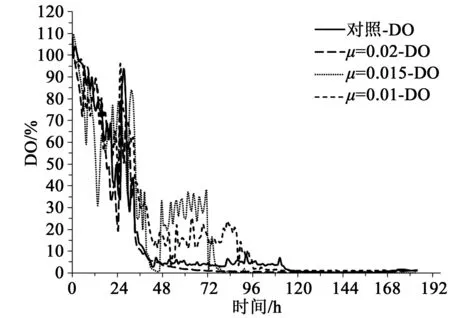
图5 不同比生长速率下的溶氧量曲线Fig.5 Time course of dissolved oxygen at different specific growth rates
3 结论
以不同的比生长速率进行甲醇流加补料,发酵酶活均比对照提高。以0.01 h-1,0.015 h-1,0.02 h-1比生长速率进行甲醇补料,酶活分别提高14.4 %,32.7 %,69.7 %。以比生长速率指导甲醇补料,既可以提高甲醇的利用率,又可以提高酶活力,从而降低发酵成本。受取样时间的限制,本文根据比生长速率进行甲醇流速调整的时间间隔为8 h或16 h,如果利用可以在线检测菌体密度的发酵反应器,根据测得的菌体密度在线实时反馈调节甲醇流量,可能会得到更优的结果。随着比生长速率的提高,酶活提高越多,在DO允许的情况下,继续提高比生长速率可能会更大地提高产酶量,而受反应器及DO的限制,本文得到的最适比生长速率为0.02 h-1。
