甲基转移酶SETDB2对肝癌侵袭迁移的影响及其机制研究
2018-10-19贾龙梅殷香宝曾磊陈新饶燕飞
贾龙梅,殷香宝,曾磊,陈新,饶燕飞
肝细胞肝癌(HCC)是最常见的肝脏原发性肿瘤[1]。由于临床症状隐匿且易发生转移,大部分HCC患者被诊断时即已经是肿瘤晚期,因而失去了手术或者肝移植的机会[2]。阐明HCC转移的分子机制对于防治肝癌有着重要的意义。研究表明,表观遗传学的改变对肿瘤的诊断和治疗有重大意义[3-4],大量的证据表明DNA或者组蛋白甲基化导致的抑癌基因转录沉默与肝癌发生发展密切相关[5]。SETDB2是一种组蛋白甲基转移酶,可使组蛋白H3第9位赖氨酸残基(H3K9)发生三甲基化(H3K9me3),其包含1个分成两段的SET区域、1个前置的SET区域和1个甲基化的CpG结合区域,可通过抑制成纤维细胞生长因子8(FGF8)的转录活性调控石斑鱼胚胎发育[6]。最新研究表明SETDB2在胃癌中高表达,并通过沉默抑癌基因WWOX和CADM1促进胃癌的侵袭迁移[7],但SETDB2在肝癌中的表达水平以及对肝癌的侵袭转移的影响及其分子机制并不清楚。本研究旨在阐明SETDB2对肝癌侵袭迁移的影响及其分子机制,为肝癌的防治提供新的治疗靶点。
1 资料与方法
1.1 一般资料
1.1.1 病例标本 收集2017年1月—6月我院手术切除的37例肝癌及对应癌旁组织标本,经病理学检查,所有癌组织标本均确诊为HCC,癌旁组织标本为正常肝组织。所有患者术前均未接受放化疗,其中男29例,女8例,平均年龄(53.4±2.5)岁,标本收集后立即液氮保存或者浸泡在10%福尔马林溶液中。标本均由患者本人知情同意并通过南昌大学第二附属医院伦理委员会审核同意后收集。
1.1.2 细胞及试剂 肝癌细胞株MHCC97H购于中国科学院上海细胞库,DMEM培养基和胎牛血清购自美国Gibco公司。即用型免疫组化试剂盒购自福州迈新生物技术开发有限公司。LipofectaminTM3000、Trizol试剂购自Invitrogen公司(美国);逆转录及PCR试剂盒购自TAKARA生物工程有限公司;Transwell小室购买于Corning公司(美国);靶向SETDB2的短发卡RNA(sh-SETDB2)和靶向PTEN的短发卡RNA(sh-PTEN)及对应的空载体对照质粒均购自上海吉凯基因化学技术有限公司。兔抗人SETDB2和PTEN多克隆抗体购自美国Abcam公司;兔抗人H3K9me3多克隆抗体以及SimpleChIP®Enzymatic Chromatin IP Kit(Magnetic Beads)购自美国Cell Signaling Technology(CST)公司;鼠抗人GAPDH单克隆抗体购自美国Proteintech。羊抗兔或羊抗鼠IgG二抗购自北京中杉金桥生物技术有限公司。SETDB2、PTEN和GAPDH引物均由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 Western blot法检测蛋白的表达 将收集的肝癌组织、癌旁组织和培养的肝癌细胞用RIPA裂解液(含PMSF)裂解后提取细胞总蛋白。制备的蛋白样本经10%SDS-PAGE电泳分离,然后以260 mA恒流电转移2 h将蛋白转印至PVDF膜上。室温下在含5%脱脂奶粉的封闭液中封闭1 h;加入1∶500稀释的一抗(SETDB2、PTEN、H3K9me3和GAPDH),4℃反应过夜;TBST漂洗3次,每次10 min,加入辣根过氧化物酶标记的羊抗兔或羊抗鼠IgG二抗(1∶10 000),室温下反应l h;再次用TBST漂洗3次,每次10 min,加入化学发光试剂显影成像,ECL发光系统曝光检测。采用Image J分析所得图像,SETDB2/GAPDH、PTEN/GAPDH和H3K9me3/GAPDH灰度比值分别表示SETDB2、PTEN和H3K9me3蛋白相对表达水平。
1.2.2 免疫组织化学染色检测组织蛋白表达 采用免疫组化EnVision两步法。将浸泡在10%福尔马林的肝癌组织和对应的癌旁组织用石蜡包埋,然后按照3~4 μm厚度组织切片,经过脱蜡、梯度乙醇水化、PBS清洗、抗原修复等过程后,滴加SETDB2抗体,孵育,滴加增强复合物和二抗,37℃孵育30 min,PBS清洗后,DAB试剂盒显色,苏木精复染细胞核,盐酸乙醇分化,乙醇脱水,二甲苯透明30 min,中性树胶和盖玻片封片。用奥林巴斯显微镜采集图像,以PBS作为阴性对照,同时设空白对照,已知阳性片作为阳性对照,根据染色程度判定SETDB2蛋白的表达情况,染色越强,表达越高。肝癌组织中SETDB2表达强于癌旁组织的病例纳入为高表达组,低于癌旁组织的病例纳入为低表达组。
1.2.3 Real-time PCR检测mRNA表达情况 Trizol法分别提取肝癌组织、癌旁组织和培养的肝癌细胞中的RNA并逆转录成cDNA(反应条件:37℃15 min,85℃ 5 s)。然后以cDNA为模板应用SYBR®Premix Ex Taq™(Tli RnaseH Plus)进行PCR扩增。PCR反应条件:95℃ 30 s;95 ℃ 5 s,60℃ 30 s,共40个循环。SETDB2引物:上游5'-CCATTTCACAGGCGAT⁃GCAA-3',下游5'-GGTGGCAGACCCATCTTTGA-3';PTEN引物:上游5'-TGTAAAGCTGGAAAGGGACGA-3',下游5'-GGGAATAGTTACTCCCTTTTTG-3';GAPDH引物:上游5'-GACAGTCAGCCGCATCTTCT-3',下游5'-GCGCCCAATAC⁃GACCAAATC-3'。使用 2-ΔΔCt分析法分析 SETDB2、PTEN mRNA的表达水平,实验独立重复3次。
1.2.4 sh-SETDB2质粒和sh-PTEN质粒及对应的空载体对照质粒的提取 取少量靶向SETDB2的短发卡RNA(shSETDB2)质粒和靶向PTEN的短发卡RNA(shPTEN)质粒及对应的空载体对照质粒的菌液接种于10 mL的LB液体培养基中,37℃恒温箱内摇晃8 h,先小量扩增菌液,然后再倒入500 mL的LB液体培养基中,37℃恒温箱内摇晃过夜,大量扩增菌液。按照质粒提取试剂盒的说明书步骤提取质粒,备用。
1.2.5 细胞转染及稳转细胞的构建 将MHCC97H细胞接种于6 cm2培养皿中,待细胞长到70%时换无血清培养基培养,按照LipofectamineTM3000转染试剂操作说明分别将20 μg空载体质粒(shNC)和20 μg shSETDB2转染入细胞,静置6 h后换有血清培养基继续培养。48 h后,用遗传霉素(G418)筛选阳性克隆;挑选阳性的单克隆细胞簇,在低剂量G418的条件下将单克隆细胞扩大培养,同时采用Western blot和Realtime PCR法对稳定转染的细胞株进行鉴定。转染空载体质粒的细胞记为shNC-MHCC97H,转染shSETDB2质粒的细胞记为shSETDB2-MHCC97H。
1.2.6 Tanswell实验检测细胞的侵袭能力 取对数生长期的shNC-MHCC97H和shSETDB2-MHCC97H细胞,经胰酶消化并计数后,取约1×105个细胞加入Transwell小室,用不含血清的培养液在5%CO2、37℃封闭环境下孵育36 h,甲醛固定20 min,0.1%结晶紫染色30 min,PBS洗3~5遍。显微镜下计数穿到滤膜外表面的细胞数,细胞数越多说明细胞的侵袭能力越强。本实验独立重复3次。
1.2.7 划痕实验检测细胞的迁移能力 制备shNCMHCC97H和shSETDB2-MHCC97H细胞悬液,细胞计数后种植约5×105个细胞于6孔板中,培养过夜后细胞均匀成单层铺满于每孔中,用相同大小枪头进行划痕,每孔划痕粗细均匀,PBS清洗划下的细胞,添加不含血清的培养液,放入37℃、5%CO2细胞培养箱中培养,倒置显微镜下于划痕后0 h和24 h拍照,测量划痕的宽度,计算细胞愈合率。实验独立重复3次。愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度,愈合率越高表示细胞的迁移能力越强。
1.2.8 基因芯片实验 取1×107个shNC-MHCC97H和shSETDB2-MHCC97H细胞,用Trizol将细胞裂解后送样至上海康成生物工程有限公司行转录组测序,在2组细胞中测序结果有差异的基因制作成热图。
1.2.9 染色质免疫共沉淀(CHIP) 取对数生长期的1×108个shNC-MHCC97H和shSETDB2-MHCC97H细胞,以IgG和H3K9me3做免疫共沉淀,按照SimpleChIP®Enzymatic Chromatin IP Kit(Magnetic Beads)的操作步骤进行实验,所得染色质用针对PTEN启动子区域DNA序列的引物进行Realtime PCR定量分析。
1.3 统计学方法 采用SPSS 17.0统计软件,数据以均数±标准差(±s)表示,2组间比较采用配对t检验,多组间比较采用方差分析,组间多重比较用Tukey法,分类资料的统计分析采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织中SETDB2的蛋白及mRNA表达水平 Western blot结果显示:在肝癌组织中SETDB2的蛋白表达高于癌旁组织;Real-time PCR的结果显示:肝癌组织中SETDB2 mRNA的相对表达量高于癌旁组织,差异均有统计学意义(P<0.01),见表1。
2.2 SETDB2的表达与肝癌患者临床病理特征的关系 SETDB2表达的高低与肝癌组织学分级和TNM分期有关,而与年龄及术前甲胎蛋白(AFP)水平无关,见表2。
Tab.1 The expression of SETDB2 in hepatocellular carcinoma and adjacent tissues表1 SETDB2在肝癌及对应癌旁组织中的表达情况(n=37,±s)

Tab.1 The expression of SETDB2 in hepatocellular carcinoma and adjacent tissues表1 SETDB2在肝癌及对应癌旁组织中的表达情况(n=37,±s)
**P<0.01
组别癌旁肝癌t SETDB2蛋白表达量0.557±0.051 1.254±0.073 7.770**SETDB2 mRNA表达量0.271±0.067 0.731±0.048 5.552**
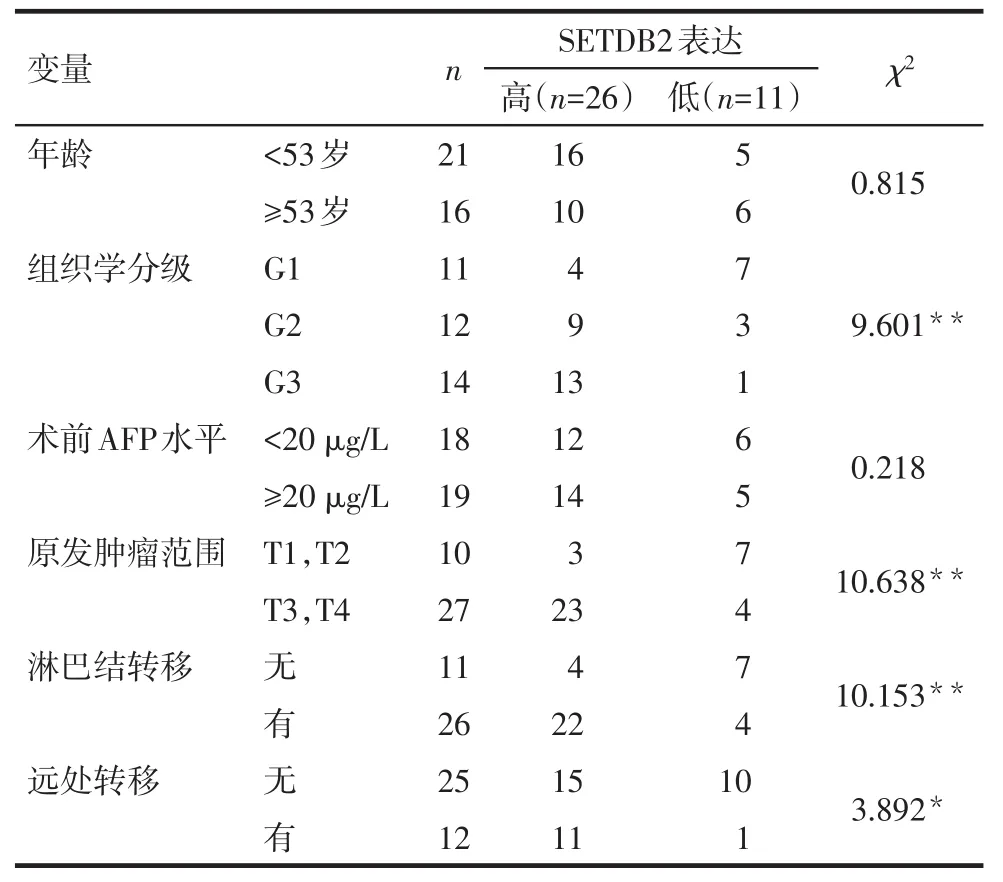
Tab.2 Relationship between SETDB2 expression and clinicopathological features表2 SETDB2的表达情况与肝癌临床病理特征的关系
2.3 稳定干扰SETDB2细胞的构建 Western blot检测shNC组和shSETDB2组SETDB2的蛋白表达结果显示,相比于shNC质粒,shSETDB2质粒可有效降低细胞中SETDB2的蛋白表达;荧光显微镜观察细胞中绿色荧光蛋白的表达情况显示两种质粒均已转染入细胞并稳定表达,见图1。
2.4 降低SETDB2的表达导致肝癌细胞的侵袭迁移能力下降 Tanswell侵袭实验结果显示,shSETDB2-MHCC97H组细胞穿过小匙的数量少于shNCMHCC97H,差异有统计学意义,见图2A、表3。而划痕实验结果表明,shSETDB2-MHCC97H细胞的愈合率低于shNC-MHCC97H细胞,差异具有统计学意义,见图2B、表3。
2.5 SETDB2上调PTEN的表达 基因芯片结果显示,下调SETDB2的表达后,PTEN的mRNA表达水平升高,此外β-catenin及其下游某些靶基因如MMP-2、MMP-7、C-myc和CyclinD1表达下调,见图3A。Western blot和Real-time PCR结果同样显示,下调SETDB2的表达导致PTEN的蛋白和mRNA表达增加,见图3B、表4。
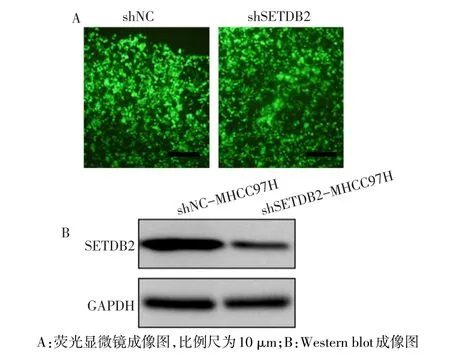
Fig.1 shSETDB2 plasmids can effectively reduce the expression of SETDB2 in MHCC97H cells图1 shSETDB2质粒可有效降低MHCC97H细胞中SETDB2的表达
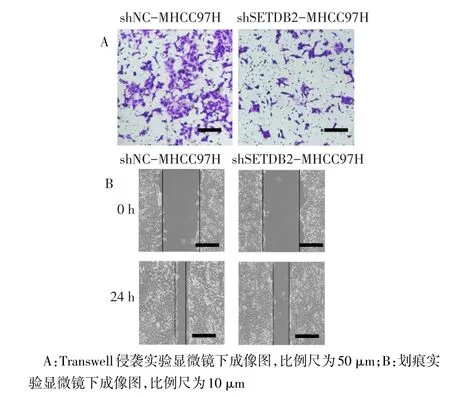
Fig.2 The invasion and migration capacity declined in shSETDB2-MHCC97H cells图2 shSETDB2-MHCC97H细胞的侵袭和迁移能力下降
Tab.3 Results of Tanswell invasion assay and W oundhealing assay表3 Tanswell侵袭实验和划痕实验结果 (n=3,±s)
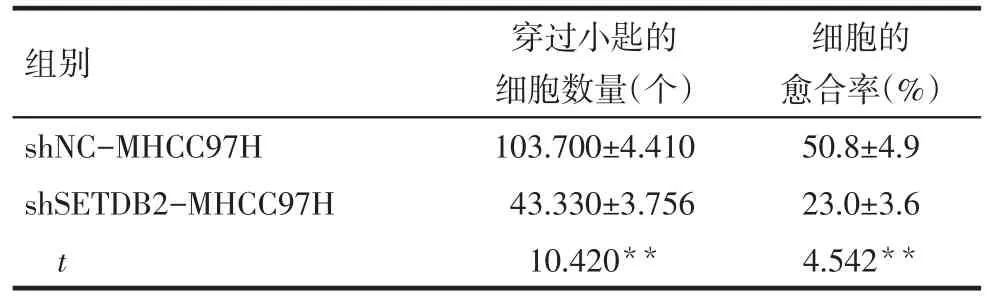
Tab.3 Results of Tanswell invasion assay and W oundhealing assay表3 Tanswell侵袭实验和划痕实验结果 (n=3,±s)
**P<0.01
组别shNC-MHCC97H shSETDB2-MHCC97H t穿过小匙的细胞数量(个)103.700±4.410 43.330±3.756 10.420**细胞的愈合率(%)50.8±4.9 23.0±3.6 4.542**
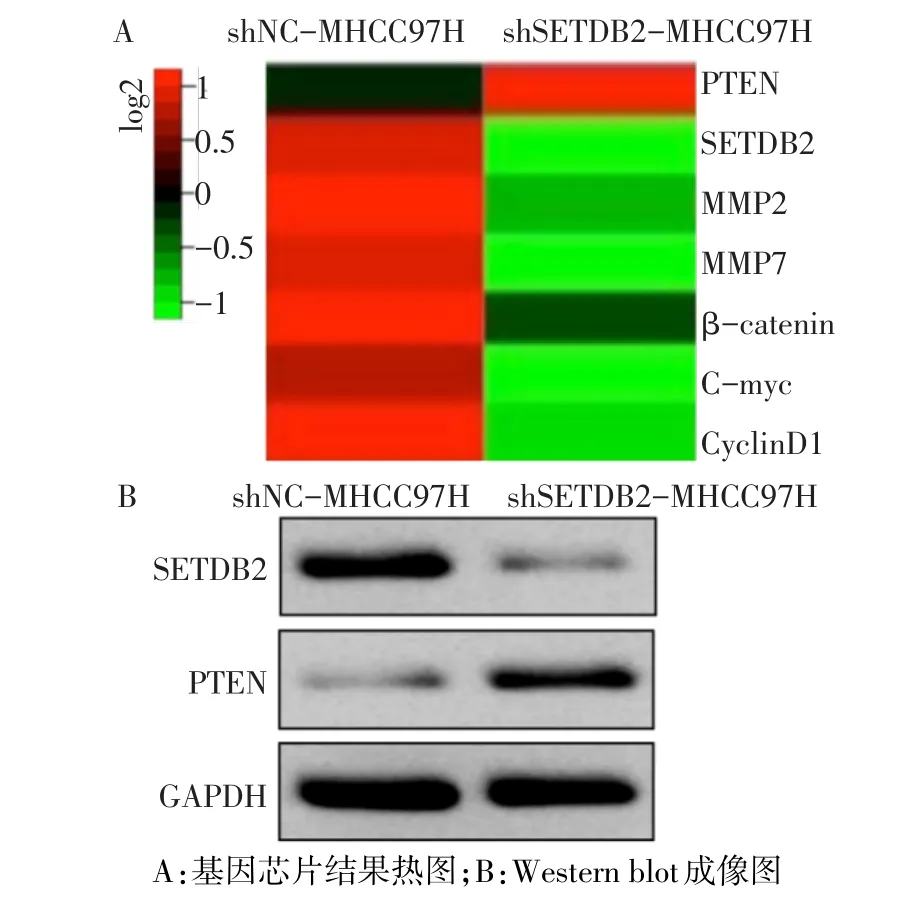
Fig.3 Reduced SETDB2 up-regulated PTEN expression图3 下调SETDB2导致PTEN表达上调
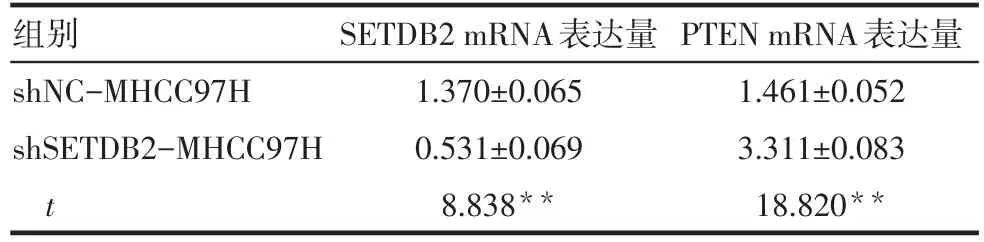
Tab.4 Expression levels of SETDB2 and PTEN m RNA表4 SETDB2与PTEN m RNA的表达量
2.6 shSETDB2导致PTEN基因的启动子区域H3K9me3水平下调 Western blot结果显示,下调SETDB2导致H3K9me3水平下降,见图4。CHIP结果显示,下调SETDB2后PTEN基因的启动子区域的H3K9me3减少,见表5。
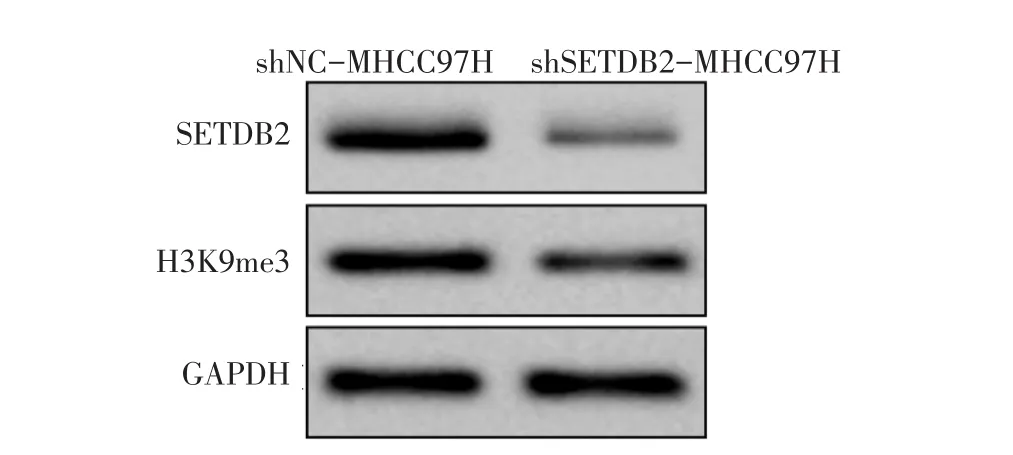
Fig.4 The reduced expression of SETDB2 down-regulated the level of trimethylation of H3K9图4 降低SETDB2的表达使H3K9的三甲基化水平下调
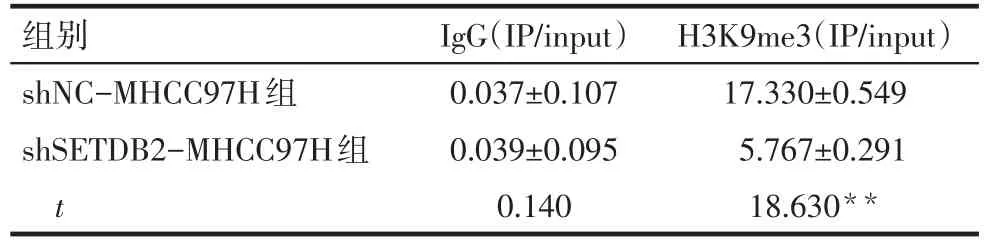
Tab.5 The CHIP results of IgG and H 3K 9me3表5 IgG和H 3K 9me3 CHIP结果
2.7 PTEN是SETDB2调控肝癌细胞侵袭能力的关键因子 在稳定敲低SETDB2表达的MHCC97H细胞中同时敲低PTEN的表达,应用Tanswell侵袭实验检测细胞的侵袭能力发现:与敲低SETDB2组相比,在敲低SETDB2的同时敲低PTEN表达后,细胞的侵袭能力恢复,见图5。
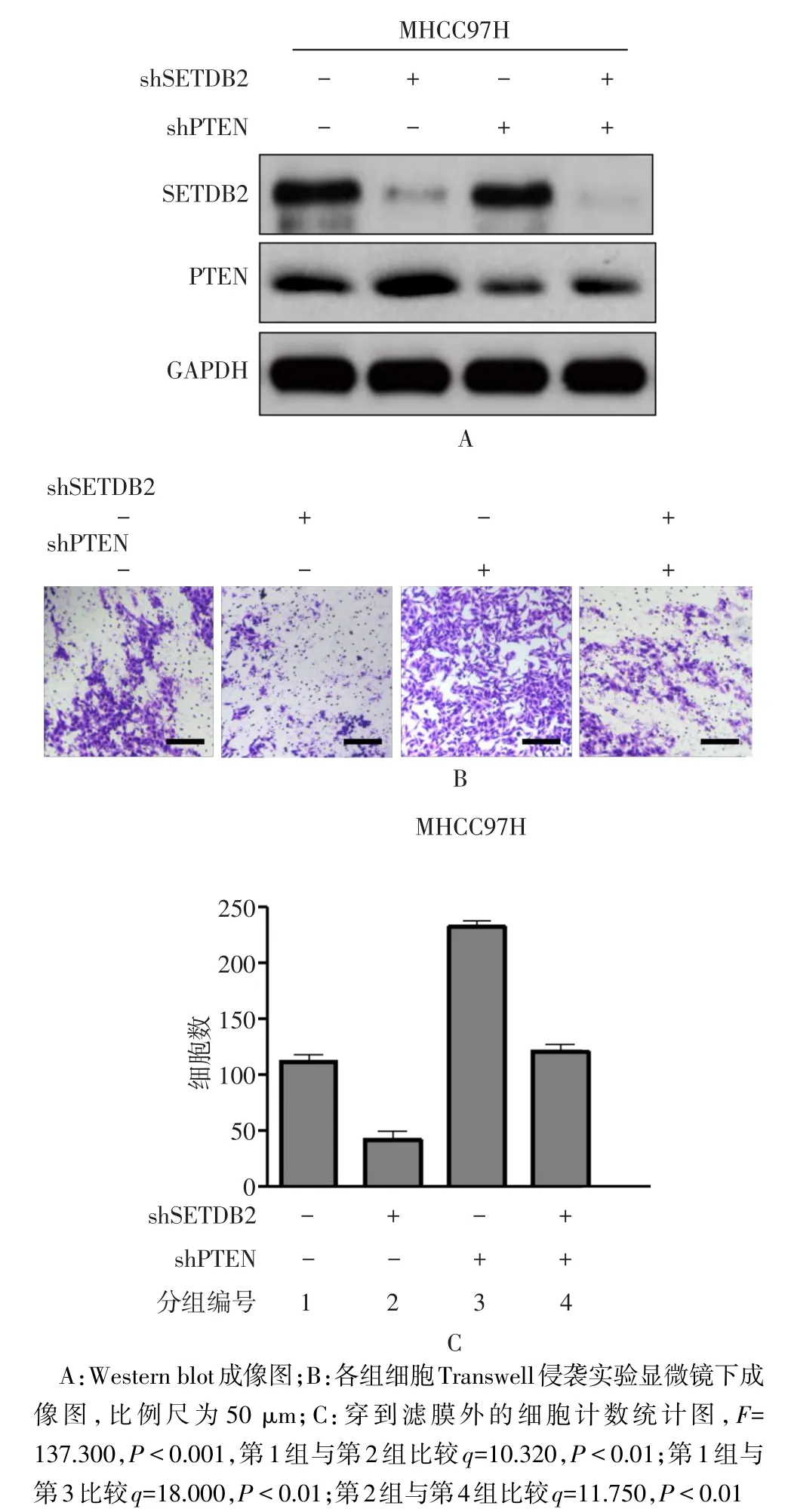
Fig.5 PTEN is a key factor for SETDB2 regulating the invasion ability of hepatoma cells图5 PTEN是SETDB2调控肝癌细胞侵袭能力的关键因子
3 讨论
组蛋白是组成核小体的核心部分,可以受多种共价修饰,如甲基化、乙酰化、磷酸化等;其中,组蛋白H3(Histone H3)的赖氨酸发生甲基化与基因转录的激活或者沉默密切相关[8]。一般来说,H3K9的三甲基化与基因转录抑制相关[9]。催化组蛋白发生甲基化的蛋白质叫甲基转移酶,组蛋白赖氨酸甲基转移酶通常都具有SET结构域。研究已经表明,SETDB1(SET domain,bifurcated 1)具有催化 H3K9甲基化的作用[10],且其对肿瘤的发生发展具有促进作用也已经有大量的文献报道[11-13]。然而,SETDB1的同源蛋白SETDB2对肿瘤的作用仍不清楚,尤其是在肝癌中的表达情况及其作用,目前少有研究。本研究发现SETDB2基因在肝癌组织中的表达高于癌旁组织,且降低SETDB2表达可导致肝癌细胞的侵袭、迁移能力下降,虽然还缺少更多的样本量验证以及对SETDB2的表达与肝癌预后的风险进行评估,但是这些结果表明SETDB2可能促进肝癌的发生发展。肿瘤的分型、分级和分期是目前评价肿瘤生物学行为和预后的最重要的三项指标,其中组织学分级是反映生物学行为和侵袭转移能力的内在参数,肿瘤的TNM分期是反映肿瘤侵袭转移能力的临床可观察参数。本研究分析SETDB2表达与肝癌临床病理特征发现SETDB2与肝癌组织学分级和TNM分期有关。转移和复发是导致肝癌患者死亡的主要原因,许多抗肿瘤药物都是针对阻断肝癌的转移而发挥抗癌作用,最经典的药物就是索拉菲尼;但是索拉菲尼的有效率仅为20%左右[14]。仍然有大部分患者没有特异的靶向药物治疗。本研究的结果表明SETDB2可以促进肝癌的侵袭和转移,为肝癌的治疗提供了一个新的靶向治疗靶点。
肿瘤的发生发展是一个多步骤、多基因、多因素的过程,与癌基因激活、抑癌基因沉默有密切关系[15]。研究表明,抑癌基因PTEN在胰腺癌、肝癌等肿瘤中低表达并发挥抑癌作用[16-17]。然而,对PTEN表达的调控仍不是很清楚。本研究结果显示SETDB2通过调控PTEN的表达进而影响肝癌的侵袭和转移。此外,基因芯片结果还显示敲低SETDB2不仅使PTEN上调,还会使β-catenin及其下游靶基因C-myc、CyclinD1等下调,这与PTEN可抑制Wnt/β-catenin信号通路的研究结论是一致的[18]。
虽然SETDB2蛋白包含有SET结构域,被定义为甲基转移酶,但是仍少有证据表明SETDB2对H3K9me3的影响。本研究发现敲低SETDB2的表达使H3K9me3水平下降,应用CHIP实验证明,在PTEN的启动子区域的H3K9me3也是下降的。这些实验结果说明SETDB2是通过组蛋白修饰从而抑制PTEN的表达。
在本研究中,通过检测肝癌组织中SETDB2的表达以及体外细胞实验证明SETDB2在肝癌中高表达并促进肝癌的侵袭转移;此外,基因芯片和CHIP实验结果证实甲基转移酶SETDB2是通过影响PTEN的启动子区域的H3K9me3水平进而抑制PTEN的表达,从而发挥促进肝癌侵袭转移的作用,为肝癌的防治提供了一个新的靶点。
