脂筏蛋白质组学分析揭示快速老化因素对SAMP8小鼠海马组织的关键影响
2018-10-19张雪竹付于贾玉洁韩景献聂坤
张雪竹,付于,贾玉洁,韩景献,聂坤
阿尔兹海默病(AD)是一种常见的神经退行性疾病,其发病机制一直是困扰医学界的主要问题之一,其病理表现主要是神经元内神经纤维缠结形成和神经元外的老年斑,临床表现多为伴随衰老出现明显的记忆障碍、失语、认知能力下降等[1]。近年来有关AD的研究不断深入,但其发病机制复杂,迄今为止无论是其生物学机制还是临床疗法如淀粉样蛋白疫苗均未取得关键性的突破[2]。已知衰老是AD最主要的危险因素,然而衰老因素如何在分子和细胞水平引起神经元功能障碍,相关机制并未得到充分阐明。
SAMP8小鼠作为典型的快速老化、痴呆小鼠,是常用的AD动物模型。相对于正常老化的SAMR1小鼠,SAMP8小鼠在进入成年期时迅速出现显著的老化特征,在形态上出现明显衰老态,病理上表现以脑干为中心出现海绵状变化,同时出现典型的认知障碍,因而成为研究脑老化和痴呆关系的理想动物模型[3]。本研究以SAMP8小鼠为模型,利用高效液相色谱-串联质谱(HPLC-MS/MS)定性蛋白质组学方法,检测小鼠老化过程中海马组织脂筏募集的蛋白质种类的变化,在细胞生物学层面揭示海马组织在老化过程中的关键变化。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SAMP8小鼠和SAMR1小鼠,均由天津中医药大学第一附属医院SAM鼠繁育中心提供[许可证号SXCK(津)2015-0003]。SAMP8和SAMR1小鼠饲养在完全相同条件下,自由取食饮水。本研究经天津中医药大学伦理委员会批准。
1.1.2 主要试剂 Ficoll分离液和线粒体膜电位检测试剂盒(JC-1)购于Sigma公司,蛋白酶抑制剂购自美国Promega公司。
1.2 方法
1.2.1 分组 抓阄法随机选取2月龄和8月龄SAMP8小鼠各40只,雌雄各半,分别定义为SAMP8幼年组、SAMP8老年组;另外抓阄法随机选取同月龄SAMR1小鼠各40只,设为正常老化对照,分别定义为SAMR1幼年组、SAMR1老年组。
1.2.2 提取小鼠海马组织脂筏 脂筏提取采用蔗糖密度梯度超速离心法[4]:小鼠颈椎脱臼处死,剥取完整海马组织,投入事先加入预冷脂筏提取液的玻璃匀浆器中充分匀浆,脂筏提取液的体积按质量/体积比(m/V)400 g/L计算,并加入5 mL的蛋白酶抑制剂。匀浆液先在EP管中静置90 min(4℃),再以1 000×g离心15 min。上清液置于40%蔗糖中超速离心,离心管由下至上蔗糖密度梯度依次为40%、30%和5%,蔗糖离心参数:Hitachi Himac CP80WX,转头P80AT,4℃,200 000×g离心20 h。超速离心完成后,5%蔗糖与30%蔗糖分界处的乳黄色脂质物质即为脂筏,用注射器取出后置于-80℃冰箱备用。
1.2.3 高效液相色谱-串联质谱法蛋白质分析(HPLC-MS/MS 1D-LTQ) 脂筏样品的酶解和肽链纯化以及后续的质谱分析和蛋白质鉴定均由上海中科新生命生物科技有限公司提供技术服务。每组样品按照预实验方法各进行3次重复实验。大致步骤如下:HPLC-MS/MS数据,采用shotgun analysis蛋白质鉴定,选用Swissport数据库,物种选小鼠,设定好筛选参数,利用Bioworks Bioworks 3.1 software(Thermo)软件中的Turbo SEQUEST程序,将MS/MS蛋白表达谱自动在小鼠数据库(IPI MOUSE v3.29)进行检索,合并输出每组样品蛋白鉴定列表。
1.2.4 生物信息学分析 鉴定出的蛋白质的生物信息学注释和KEGG分析均采用DAVID生物信息学在线分析工具完成(https://david.ncifcrf.gov/geneReport.jsp),具体操作见网站指南。脂筏蛋白组的细胞定位分析,采用DAVID网站的GO注释工具;脂筏蛋白组的代谢网络分析,勾选KEGG选项。
1.2.5 小鼠Morris水迷宫动物行为学分析 Morris水迷宫隐蔽平台测试具体方法见文献[5]。整个测试为期5 d,方法简述如下:每次测试时,先将小鼠轻轻放入水中,面朝池壁,再打开行为学软件,记录小鼠的游泳路线,统计小鼠从入水到找到平台的长度和时间(逃避潜伏期,escape latency);待小鼠在平台上休息20 s后再次测试。如果小鼠120 s内没找到平台,潜伏期成绩记为120 s。每天在2个入水点各测试1次,以2次潜伏期的算术均值作为这一天的成绩,进行统计分析。
1.2.6 海马组织线粒体提取 采用Clark方法[6],在0~4℃环境下进行。完整海马组织用分离介质洗去表面血迹后,置于预冷的玻璃匀浆器中,加入2 mL预冷的分离介质液(0.025 mmol/L蔗糖,0.075 mol/L甘露醇,1 mmol/L EGTA),手动充分匀浆。匀浆液离心3 min(4℃,2 000×g),取上清液再次离心8 min(4℃,12 500×g)。弃上清,沉淀加入3%的Ficoll液5 mL(3%Ficoll,0.12 mol/L蔗糖,0.03 mol/L甘露醇,25 μmol/L EDTA-K,Tris调整pH=7.4)中悬浮,仔细分层入6%Ficoll液10 mL(6%Ficoll,0.12 mol/L蔗糖,0.03 mol/L甘露醇,25 μmol/L EDTA-K,Tris调整pH=7.4),10 400×g离心30 min,沉淀,用分离介质悬浮,12 100×g离心10 min,所得沉淀即为线粒体。稀释后马上用于线粒体功能检测。
1.2.7 线粒体膜电位检测 使用线粒体膜电位检测试剂盒(JC-1)和流式细胞仪检测线粒体膜电位。以BCA方法定量线粒体浓度,再把线粒体悬浮液调整到统一浓度,按照试剂盒说明,试管中加入JC-1荧光试剂及线粒体常温孵育30 min,以流式细胞仪(BD)检测红色荧光和绿色荧光值,JC-1单体检测设置激发光波长为490 nm,发射光为530 nm;JC-1聚合物检测设置激发光波长为525 nm,发射光为590 nm。对捕获的红色和绿色荧光信号进行分析,红、绿荧光值的比值代表膜电位的高低。
1.3 统计学方法 应用SPSS 13.0软件进行数据统计分析,符合正态分布的变量以均数±标准差(±s)表示,Morris水迷宫数据组间均数比较采用具有一个重复测量的双因素方差分析(Two-way ANOVA),线粒体膜电位数据组间均数比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
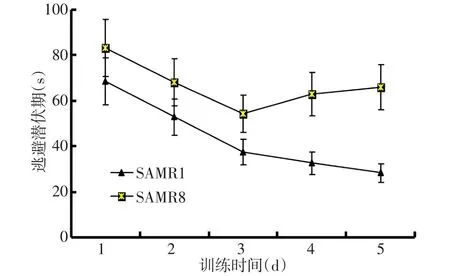
Fig.1 Results of performance of the aged SAMP8 and the control SAMR1 mice during the five training days of a hidden platform图1 SAMP8老年组和SAMR1老年组小鼠在5 d的隐藏平台成绩测试中的表现
2.1 Morris水迷宫动物行为学检测 图1显示了在5 d训练期内各老年组小鼠Morris水迷宫逃避潜伏期的学习成绩曲线。在Morris水迷宫测试中,SAMP8老年组和SAMR1老年组小鼠在5 d的训练中逃避潜伏期均显著缩短,小鼠品系之间的逃避潜伏期成绩差异有统计学意义(F品系=9.283,P<0.01)。成年SAMR1小鼠的逃避潜伏期在5 d的训练中一直在减少,但SAMP8小鼠仅在最初3 d内发现隐藏平台在减少,最后2 d不再减少,这与SAMR1小鼠明显不同,提示SAMP8老年组小鼠出现明显的学习记忆障碍。
2.2 海马组织中脂筏蛋白质组的鉴定和注释 采用定性分析的shotgun蛋白质组学技术,鉴定出各组脂筏样本的蛋白质种类。对蛋白质组进行注释,发现最大的功能群体是线粒体蛋白质,提示线粒体对神经元的功能非常关键。结果显示,SAMP8和SAMR1小鼠海马组织脂筏募集的蛋白质种类和数目均随月龄增加而减少,提示老化因素引发海马组织细胞生命活动的明显衰退,见表1。
2.3 老年组SAMP8小鼠海马组织脂筏蛋白质组的GO富集分析 以幼年组小鼠的脂筏蛋白质组为背景,对老年组小鼠的海马组织脂筏蛋白质组的富集分析,结果见表2。正常老化的SAMR1小鼠海马组织脂筏蛋白质组细胞定位富集度前10的词条中,排在前4的均是线粒体相关词条,其中,线粒体排在第2位,提示老化过程中线粒体功能在神经元细胞功能中的关键作用。
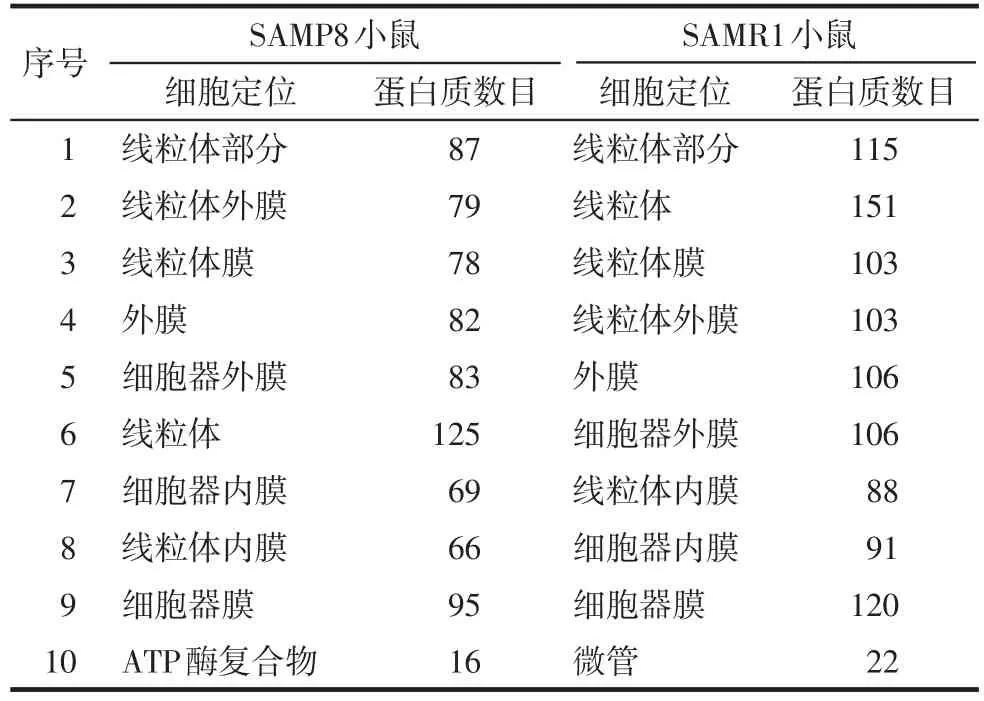
Tab.2 Top 10 term s that aging factors affect the enrichment of lipid rafting proteome in hippocampus表2 老化因素影响海马组织脂筏蛋白质组细胞定位的富集度排名前10词条
快速老化的SAMP8小鼠海马组织脂筏蛋白质组细胞定位富集度前10的词条中,排在前3的均是线粒体相关词条。与正常老化对照组SAMR1比较,SAMP8有两个明显不同:线粒体从第2降到第6位;线粒体相关词条的蛋白数目均大幅度减少。结果提示,老化过程中,对比SAMR1小鼠,SAMP8小鼠海马神经元细胞功能中发生的关键性变化可能是线粒体功能的显著衰退。
2.4 老年组SAMP8小鼠海马组织脂筏蛋白质组的KEGG代谢网络途径分析 对小鼠海马组织脂筏蛋白质组进行KEGG代谢网络途径分析,结果显示,对照组SAMR1小鼠有统计学意义的关键KEGG代谢网络途径有4个,排在首位的是线粒体的氧化磷酸化(Oxidative phosphorylation)通路,其余3个均为神经退行性病变相关代谢途径。与SAMR1不同,快速老化SAMP8小鼠有统计学意义的6项代谢途径中,排在前2位的是亨廷顿病和AD代谢途径,线粒体的氧化磷酸化代谢途径排在第3位,该途径的蛋白数目大幅度减少。结果提示,老化过程中对比对照组SAMR1小鼠,SAMP8小鼠海马神经元线粒体氧化磷酸化代谢功能显著衰退。见表3。
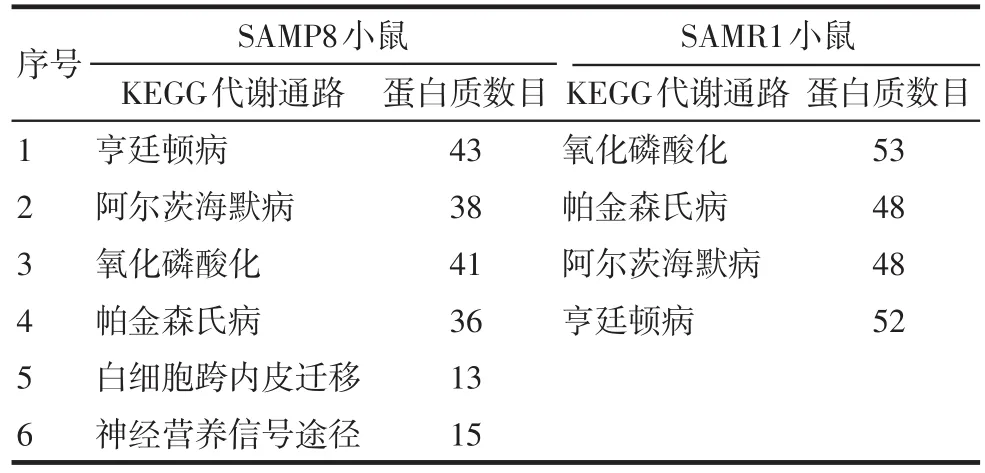
Tab.3 Analysis of KEGG pathway in hippocam pal lipid rafts during aging表3 老化因素对SAMP8海马组织脂筏蛋白质影响的KEGG代谢通路分析
2.5 SAMP8小鼠海马组织线粒体膜电位的检测 如图2示,SAMR1小鼠老化过程中线粒体膜电位显著下降(92.77%±10.05%vs.84.52%±10.37%,t=3.350,P<0.01),提示在老化过程中线粒体氧化磷酸化功能也显著下降;SAMP8小鼠老化过程中线粒体膜电位也显著下降(90.12%±12.93%vs.68.34%±11.42%,t=4.509,P=0.001)。与 SAMR1小鼠不同的是,SAMP8小鼠线粒体膜电位下降幅度远远超过SAMR1小鼠。线粒体膜电位的下降反映线粒体氧化磷酸化功能的衰退,结果提示,在老化过程中SAMP8小鼠海马组织线粒体氧化磷酸化功能过度衰退。
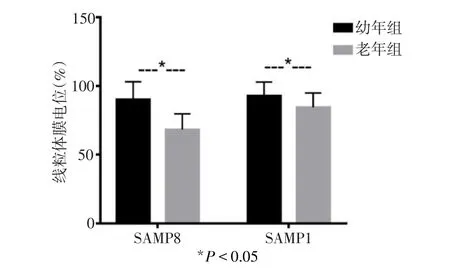
Fig.2 Mitochondrial membrane potential in hippocampal tissues of SAMP8 mice during aging图2 老化因素对SAMP8小鼠海马组织线粒体膜电位的影响
3 讨论
本研究以SAMP8小鼠为老年痴呆动物模型,以SAMR1小鼠为正常老化动物模型,分析了老化过程中SAMP8小鼠海马组织的关键生物学变化。利用海马组织脂筏蛋白质组的生物信息学分析,发现SAMP8小鼠海马组织在老化过程中最关键的细胞变化是线粒体氧化磷酸化功能的过度衰退,这可能是其痴呆发生的重要细胞学机制。
3.1 脂筏是膜蛋白募集平台 研究显示,脂筏在细胞跨膜信号传导过程中起关键作用。随着跨膜信号的活化,脂筏会募集大量相关功能蛋白到脂筏平台,组装成脂筏上的蛋白质功能复合体[7]。通过检测脂筏募集的蛋白质种类能观察到细胞活动的关键变化。本研究采用定性蛋白组学技术鉴定脂筏募集的蛋白质种类,试图阐明老化过程中关键的细胞学变化。
3.2 线粒体氧化磷酸化功能 本研究显示,正常老化的SAMR1小鼠中,海马组织脂筏蛋白质组的GO分析和KEGG分析均显示,线粒体功能相关蛋白被脂筏大量募集,提示线粒体功能的活化对维持老年小鼠神经元细胞功能有关键作用;而快速老化的SAMP8小鼠中,GO分析显示,与对照小鼠比较,脂筏募集的线粒体相关蛋白大幅度减少,富集度大幅度降低,提示老化痴呆的SAMP8小鼠线粒体活动过度衰退。KEGG分析和线粒体膜电位检测则进一步证实,线粒体的氧化磷酸化功能过度衰退是SAMP8小鼠快速老化进程海马神经元细胞的关键变化。
3.3 SAMP8小鼠线粒体功能障碍 线粒体是真核生物细胞的能量工厂,通过电子传递链发生氧化磷酸化过程,为细胞合成大量三磷酸腺苷(ATP),在能量代谢中发挥关键作用。敏感药物、细胞内理化变化以及凋亡相关的跨膜信号途径的激活均会抑制线粒体功能,引起细胞内ATP合成减少,使细胞处于能量缺乏状态。线粒体功能对各种类型的细胞应激反应是高度敏感的,细胞氧化应激、内质网应激也会引起线粒体分裂减少,降低线粒体数量,引发线粒体功能衰退。线粒体功能衰退对人类衰老起着推动作用,随年龄增长,线粒体功能下降成为细胞衰老的标志[8-9]。线粒体功能异常在神经退行性疾病的发生和进展中起着关键作用,目前已知帕金森病(PD),AD以及亨廷顿病(HD)等衰老相关的神经退行性疾病均与线粒体功能障碍相关[10-11]。介导线粒体自噬过程的PINK1和Parkin信号通路障碍是PD的关键发病因素,该信号通路障碍会导致缺陷线粒体不能及时被消除,最终导致黑质多巴胺能神经元的进行性缺失,引发PD。本研究发现,老化的SAMP8小鼠海马神经元线粒体的氧化磷酸化功能过度衰退,线粒体膜电位大幅度下降,提示AD海马神经元的功能障碍与PD和HD的细胞机制相似,均是由神经元线粒体能量代谢过度衰退导致ATP的合成障碍引发的。
3.4 SAMP8小鼠线粒体氧化磷酸化功能与痴呆 线粒体对维持神经元的正常功能十分关键。人体中枢神经系统质量虽然占全身的比重很小,但耗氧量占的比重却很大。在神经元中,线粒体产生的ATP,一部分用来保证神经元正常生命活动的需要,另一部分用于维持神经元的细胞电位,更重要的是,神经元的短途物质运输和长途物质运输均需要线粒体参与。在神经元突起中,线粒体以细胞骨架微管为导轨,依靠马达蛋白的ATP酶提供动力,大量向突触前膜区域迁移聚集,依靠细胞骨架蛋白的支撑,参与到神经递质囊泡的转运和分泌过程,维持神经元正常的神经递质信号传递功能[13]。要满足这种对能量的巨大需求,中枢神经神经元需要大量正常功能的线粒体。Morris水迷宫检测显示老化的SAMP8小鼠出现明显学习记忆障碍,笔者推测随着快速老化过程中线粒体氧化磷酸化功能的过度衰退,细胞内ATP会减少,SAMP8小鼠海马组织神经递质的分泌和信号传递过程以及突触功能均产生异常,使小鼠的学习记忆和认知功能均出现障碍,从而在行为学上出现明显的痴呆表型。本研究结果提示,线粒体氧化磷酸化功能的过度衰退可能是其痴呆发生的重要细胞学机制。
