基于液相色谱-质谱技术的乳腺癌转移相关代谢标志物的筛选
2018-10-19吴静杨睿张磊康华范志娟刘树业
吴静,杨睿,张磊,康华,范志娟,刘树业△
乳腺癌是女性常见的恶性肿瘤之一,发病率和死亡率居妇女各类恶性肿瘤之首,严重威胁着女性的身体健康[1-2]。尽管近年来乳腺癌的诊断方法和治疗技术不断提高[3],但乳腺癌患者的死亡率仍然高居不下。乳腺癌转移是患者死亡的最主要原因[4],而目前针对乳腺癌转移的治疗仍没有进展。
表观遗传学突变导致的代谢表型异常是乳腺癌发生的重要因素。代谢组(即小分子代谢物群)是某一生物、系统或细胞在特定状态下的所有代谢产物的集合,也是基因组、转录组和蛋白组综合作用下的最终产物[5]。在乳腺癌发生、发展和转移的各个阶段,构成代谢组的小分子代谢物的种类或浓度均会发生相应的变化[6]。乳腺癌转移早,发展迅速,甚至在乳腺癌发展初期就已出现微小转移灶。因此,如能筛选出与乳腺癌转移密切相关的代谢物作为生物标志物,对及时判断乳腺癌的转移趋势、把握患者治疗时机和提高生存率有重要意义。因此,本研究应用基于高分辨率的高效液相色谱-轨道离子阱质谱联用(HPLC-LTQ Orbitrap XL MS)分析平台的代谢组学技术,对乳腺癌未转移和已发生转移的血清样本进行代谢轮廓差异分析,并从中筛选出与乳腺癌转移相关的代谢标志物,为乳腺癌的早期诊断、预后评估以及药物靶点的研究等提供理论依据。
1 材料与方法
1.1 实验材料 收集2015年1月—2017年9月天津市第三中心医院检验科100例乳腺癌患者的血清标本,包括未转移组50例,年龄33~64岁,平均(54±9)岁;转移组50例,年龄37~66岁,平均(58±14)岁,转移组中肝转移19例、肺转移22例、骨转移9例。入选标准:自愿进入本研究并签署书面知情同意书;病理组织学或细胞学上明确诊断为乳腺癌;体力状态Karnofsky评分≥60分,预计生存期在3个月以上。未转移组:原发乳腺癌,伴有邻近组织浸润,无淋巴结转移和远处脏器转移。转移组:原发乳腺癌,经检查示有远隔淋巴结、肝、肺或骨转移;既往接受过1或2个标准化疗方案,但治疗无效或复发进展。收集同期50例健康志愿者,年龄30~59岁,平均(50±16)岁,收集血清作为对照标本。所有标本经过收集分装后-80℃保存,分析前室温解冻。3组年龄差异无统计学意义(F=3.856,P=0.051)。
1.2 仪器与试剂 LTQ Orbitrap XL质谱仪和Accela高效液相色谱仪(HPLC)购自美国Thermo Fisher Scientific公司;甲酸(HPLC纯)购于上海南翔人民化工厂;乙腈(HPLC纯)购于德国Merck公司;蒸馏水经Milli-Q系统(美国Millipore公司)过滤后使用;实验所需标准品均购自美国Sigma-Aldrich公司。
1.3 方法
1.3.1 样本预处理 取解冻后的血清标本100 μL与400 μL甲醇混合,剧烈震荡30 s,4℃静置5 min后4℃、15 000×g离心30 min,取上清液,真空离心蒸干得干粉。将干粉用等样本体积的水与乙腈混合溶液(V/V=95/5)重溶,再以4 ℃、15 000×g离心30 min取上清液,将上清液用0.22 μm孔径滤膜过滤后进行上样检测。以各标本上样液等体积混合后的溶液(Pool溶液)作为质控品(QC)参与分析。
1.3.2 样品分析 HPLC的色谱柱为Thermo Hypersil GOLD柱(50 mm×2.1 mm×1.9 μm);流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的乙腈溶液,流速为200 μL/min。梯度洗脱程序:0~3 min,5%B;3~10 min,5%B线性增加至50%B;10~13 min,50%B 线性增加至 95%B;13~17 min,95%B;17~21 min,95%B~5%B;21~25 min,5%B,平衡色谱柱。进样量为10 μL;自动进样器的温度维持在4℃。LTQ Orbitrap XL质谱系统配有电喷雾离子源(ESI);采用正离子Centroid模式进行扫描检测;毛细管电压7 V,锥孔电压50 V,离子源电压4.8 kV;数据采集范围质荷比(m/z)50~1 000,分辨率为60 000。质量校正使用厂家提供的校正液,并根据用户手册说明进行。整个实验过程中共检测24个质控溶液:样品分析前连续分析10个质控溶液,其余14个随机插入到所有样品的分析序列中。样品分析的先后顺序由Excel自带函数随机产生。每个样品(包括质控溶液)分析后均插入空白分析,避免交叉污染。
1.3.3 数据处理和分析 将HPLC-LTQ Orbitrap XL平台分析得到的数据导入到MZmine 2.7.2软件进行数据前处理[7],包括滤噪、峰识别、重叠峰解析、峰对齐、峰补齐和标准化(以每个样品的总峰面积作为标准化因子)等。去除缺失值≥80%的变量,然后采用MZmine自带方法给缺失值少的变量赋值。分析得到一个二维(i×j)峰表,每一行(i)代表一个样本,每一列(j)代表一个变量,数值则表示相应的离子强度。将得到的数据导入到SIMCA 14.1软件(瑞典Umetrics公司)进行分析。
为找到鉴别乳腺癌转移与否和进展程度的特异性代谢标志物,按照“健康对照组-乳腺癌未转移组-乳腺癌转移组”的顺序,将“健康对照组和乳腺癌未转移组”、“乳腺癌未转移组和乳腺癌转移组”进行两两组合对比。通过SIMCA14.1软件构建主成分分析(PCA)模型,并对以上2个组合分别构建正交偏最小二乘判别分析(OPLS-DA)[8]和S-plot模型,通过S-plot模型筛选出差异表达代谢物(其中蓝点代表差异表达代谢物,对模型的贡献大和稳健性强)。随机选取各组的80%样本作为训练集建立OPLS-DA模型,剩余20%的样本作为检测集评价模型的准确性。潜在标志物根据变量重要性(variable importance in the projection,VIP)预测值、VIP置信区间进行初步筛选,然后利用SPSS 16.0软件(美国)对所得代谢物进行独立样本非参数检验,排除P≥0.05的代谢物。
1.3.4 潜在代谢标志物的鉴定 首先根据筛选出的变量重新设定仪器参数,对质控溶液进行二级质谱(MS/MS)扫描,获得代谢物的二级质谱图;然后利用精确质荷比(m/z)和二级质谱图搜索Mass Frontier 6.0自带数据库、Medlin数据库、KEGG数据库以及HMDB数据库,经过结构推导得出初步结果;最后通过与标准品的MS/MS质谱图对比得到鉴定结果。
2 结果
2.1 HPLC-LTQ Orbitrap XL分析系统的稳定性 采用HPLC-MS平台对获取的乳腺癌未转移患者、乳腺癌转移患者和健康人血清样品分析后的总离子流图(TIC)如图1所示。对24个质控溶液数据进行PCA分析后发现,HPLC-MS系统在整个分析过程中均比较稳定,见图2。
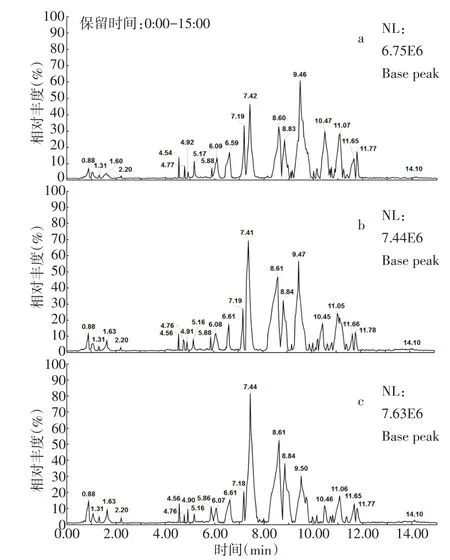
Fig.1 Total ion chromatograms of(a)a healthy person,(b)a breast cancer patient without metastasis and(c)a breast cancer patient with metastasis图1 典型(a)健康人、(b)乳腺癌未转移患者和(c)乳腺癌转移患者的总离子流图
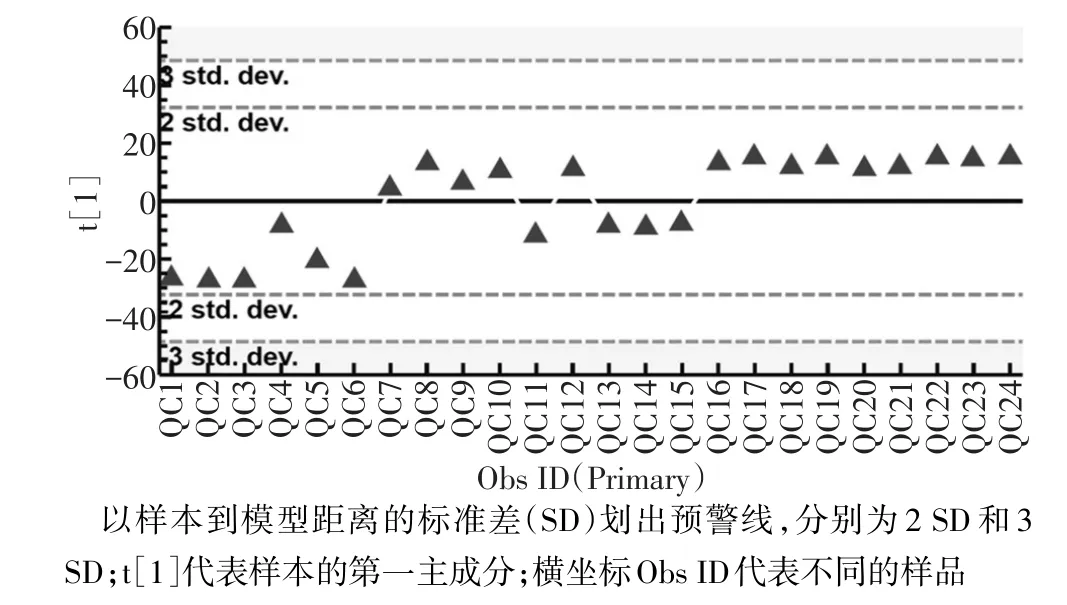
Fig.2 PCA score plot(t[1]/sample)of the quality control(QC)samples图2 质控溶液样本PCA打分线性图
2.2 代谢轮廓分析对疾病状态的区分能力 对样本进行PCA分析后结果如图3所示,健康对照组得到了区分,而乳腺癌未转移组和乳腺癌转移组未能区分开。为其构建OPLS-DA模型,结果显示健康对照组、乳腺癌未转移组、乳腺癌转移组样本得到了很好的区分,并且该模型具有很好的拟合性(R2=95.2%)和预测能力(Q2=86.7%),见图4。为进一步检测该模型的可靠性,随机选取每组80%样本作为训练集构建OPLS-DA模型(R2=93.5%,Q2=79.8%),用剩余的20%样本作为检测集检验模型的区分能力,预测正确率达95.62%,见图5。
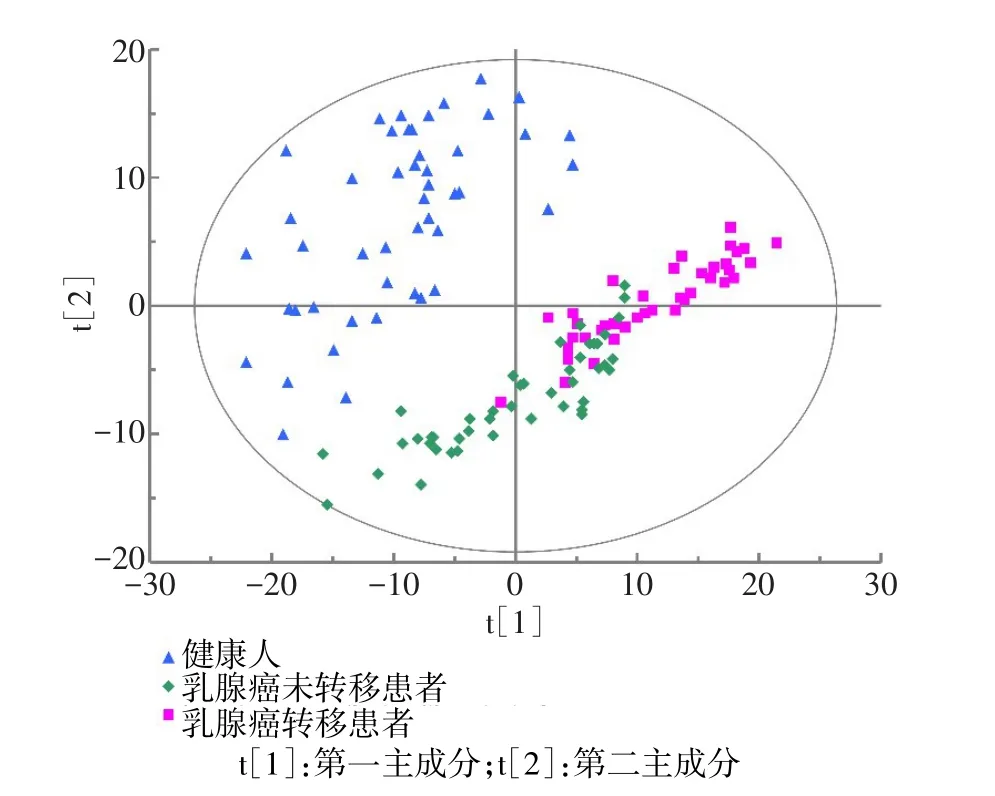
Fig.3 PCA score plot for all samples图3 基于所有样本的PCA打分图

Fig.4 OPLS-DA score plot for all samples图4 基于所有样本的OPLS-DA打分图
2.3 潜在代谢标志物的筛选和鉴定 对“健康对照组和乳腺癌未转移组”、“乳腺癌未转移组和乳腺癌转移组”2个组合分别构建的OPLS-DA模型见表1,通过构建S-plot模型(图6)筛选出差异表达代谢物(蓝点),并对筛选出的代谢物进行非参数检验,进一步排除P≥0.05的代谢物,而P<0.05的代谢物则可能是潜在的代谢标志物,见表2。
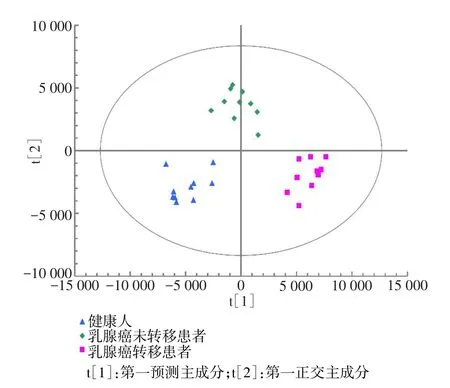
Fig.5 OPLS-DA scores plot for testing group图5 基于检测组样本的OPLS-DA打分图

Tab.1 Two OPLS-DA models constructed by two different com binations of the sam p les表1 不同样本组组合构建的2个OPLS-DA模型 (%)
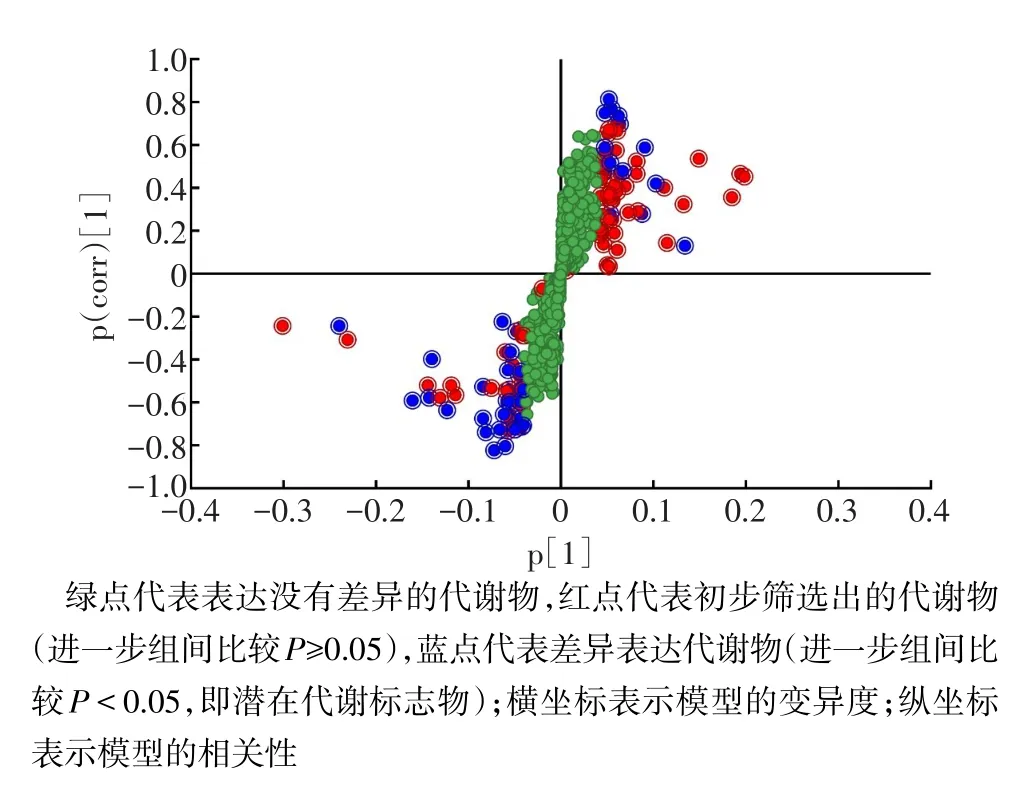
Fig.6 S-plot model constructed by healthy persons and breast cancer patients without metastasis图6 基于健康对照组和乳腺癌未转移组构建的S-plot模型图
筛选出来的潜在代谢标志物按照1.3.4所述进行鉴定,通过二级质谱图搜索和标准谱图比对,健康对照组和乳腺癌未转移组共筛选出31个差异表达代谢物(P<0.05),其中24个得到了初步鉴定。乳腺癌未转移组和乳腺癌转移组共筛选出23个差异表达代谢物(P<0.05),其中15个得到了初步鉴定(表2)。在鉴定出的39个代谢物中,有8个代谢物[包括溶血磷脂酸(18∶1)、溶血磷脂酰胆碱(18∶0)、溶血磷脂酰胆碱(20∶3)、胆碱、磷酸二羟丙酮、番石榴酸、芥酸、L-氢化乳清酸]的表达水平随着乳腺癌的进展(从健康人到未转移的乳腺癌再发展到已转移的乳腺癌)是逐渐升高的。
3 讨论
3.1 代谢组学是研究生物体内所有代谢物的一种新兴技术 代谢组学作为后基因组时代的一种全新的组学技术,利用高分离效率、高敏感度、高通量及极低检测限的仪器,以生物体内小分子化合物的动态规律变化来表征生物体的生理病理变化趋势,从而揭示疾病发生和发展过程中的异常的代谢机制[9]。因此,代谢组学被广泛应用于疾病诊断[10]、新药研究与开发[11]、药物作用机制研究[12]等多个领域。
3.2 代谢组学技术在筛选乳腺癌标志物方面的意义 研究证实,乳腺癌的发生和进展与代谢异常密切相关[13],而常规检测与研究中又缺乏高敏感性和高特异性的肿瘤标志物。因此,代谢组学作为一种新型的研究技术,可以分析乳腺癌发生发展中产生的所有代谢物的变化,识别有价值的潜在标志物,为肿瘤的早期诊治开辟新途径。近年来,应用代谢组学技术在乳腺癌标志物的筛选方面也取得了很大的进展[14]。然而针对乳腺癌转移代谢标志物的筛选和研究甚少,因此还无法完满地解释乳腺癌转移的机制。
3.3 应用代谢组学技术筛选出与乳腺癌转移相关的潜在代谢标志物 基于此,本研究应用代谢组学技术分析了健康对照组、乳腺癌未转移组和乳腺癌转移组患者血清样本的代谢轮廓差异,初步筛选和鉴定了可能与乳腺癌转移和进展相关的8个代谢物,包括溶血磷脂酸(18∶1)、溶血磷脂酰胆碱(18∶0)、溶血磷脂酰胆碱(20∶3)、胆碱、磷酸二羟丙酮、番石榴酸、芥酸、L-氢化乳清酸。这些代谢物的表达水平随着乳腺癌进展逐渐升高,它们参与的代谢过程包括磷脂代谢[15](如溶血磷脂酰胆碱、胆碱)、脂质代谢(如溶血磷脂酸)、核苷酸代谢(如L-氢化乳清酸)、脂肪酸代谢(如芥酸)、糖代谢(如磷酸二羟丙酮、番石榴酸)等,而涉及的生物学过程则包括了能量代谢、蛋白质的合成和降解、细胞凋亡、神经递质的合成与降解等。
3.4 潜在代谢标志物的生物学意义 本研究发现,乳腺癌在发展进程中的代谢变化主要表现为磷脂代谢的紊乱。溶血磷脂酰胆碱是卵磷脂在磷脂酶A2作用下的水解产物,参与体内的磷脂代谢。在正常情况下,人体内的卵磷脂可以从动植物中获取,也可以通过胆碱在体内合成。研究发现,肿瘤的发生与溶血磷脂酰胆碱[16]、胆碱[17]的含量升高相关,而乳腺癌患者中胆碱水平的升高又与Wnt/β-caternin通路发生异常有关[17]。本研究也发现乳腺癌在转移进展的过程中溶血磷脂酰胆碱和胆碱的含量均明显高
于正常人(表2),其内在的发生机制有待进一步探讨。Conceição等[18]发现,与良性乳腺疾病患者相比,乳腺癌患者的血清和组织样本中的芥酸水平显著增加,这一结果与本研究结果一致,说明在乳腺癌进展过程中也可能发生了脂肪酸代谢的紊乱。溶血磷脂酸是脂质代谢的重要中间产物,多项研究发现其可以促进肿瘤的生长增殖[19]、迁移[20]、血管生成[21]和转移[16]。而本研究也证实乳腺癌在转移过程中的溶血磷脂酸水平升高。因此通过拮抗溶血磷脂酸的合成、阻断其代谢途径和抑制其信号传导可望成为抗肿瘤生长和转移的新方向。
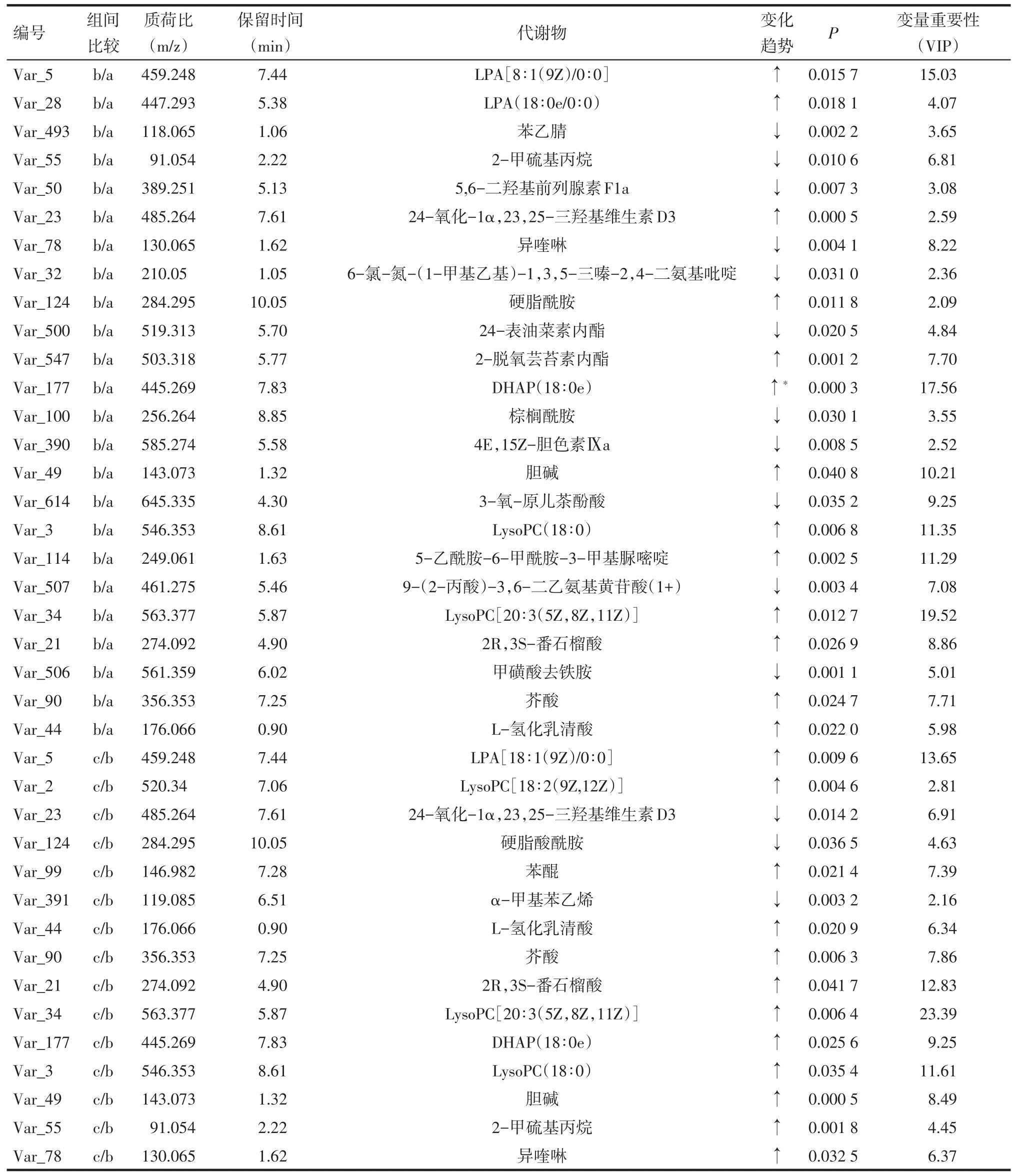
Tab.2 Selected and identified potential metabolic biom arkers associated with breast cancer metastasis表2 乳腺癌转移相关潜在代谢标志物的筛选及初步鉴定结果
总之,由以上结果可以看出,应用代谢组学技术可以很好地区分乳腺癌转移患者、乳腺癌未转移患者和健康人的代谢轮廓,并且成功地发现并初步鉴定出与乳腺癌转移和进展相关的代谢标志物,为乳腺癌的早期诊治、预后评估和药物治疗靶点的选择提供新的思路和方法。下一步我们将对乳腺癌发生转移的机制和相关代谢通路做进一步研究。
