肾康灵对TGF-β1干预的肾小管上皮细胞的α-SMA和E-cadherin表达的影响
2018-10-16卢小露艾斯郑健
卢小露 艾斯 郑健
原发性肾病综合征(PNS)是一种常见儿科肾脏疾病,患病率为16/10万[1],占小儿肾病综合征的90%左右[2]。PNS也常伴有肾小管间质的变形、萎缩、坏死,最终诱发肾间质纤维化[3],肾间质纤维化是衡量PNS病情进展关键指标之一[4]。我院选用激素联合肾康灵治疗PNS,有效率达88.89%左右,相比单纯激素治疗,有效率提升显著[5]。本研究以TGF-β1干预的肾小管上皮细胞为实验模型,选取α-SMA、E-cadherin为研究指标,探讨肾康灵改善肾间质纤维化的作用机制。
1 实验材料
1.1 实验细胞
大鼠肾小管上皮细胞(贝尔曼公司)。
1.2 药品和试剂
肾康灵(福建中医药大学附属人民医院院内制剂,闽药批号Z06106049;由黄芪、山药、三七、绣花针等药物组成);转化生长因子 -β1(transforming growth factor-beta1,TGF-β1)(PEPROTECH);β-肌动蛋白(b-actin)和上皮钙黏蛋白(Epithelial-cadherin,E-cadherin)的PCR引物(武汉生工生物工程公司);anti-E-cadherin和鼠抗α-平滑肌肌动蛋白(anti-αsmooth muscle actin,anti-α-SMA)(Cell Signaling)。
1.3 主要仪器
CO2培养箱(Thermo Forma);PCR扩增仪、凝胶成像系统和转膜装置、垂直电泳装置和转移电泳装置(Bio-Rad);RNA定量仪(PE生物系统公司)。
2 实验方法
2.1 细胞培养、分组
用含10%胎牛血清的1 640培养液培养肾小管上皮细胞,待生长融合至70时,以每孔板1×104/ml密度种至培养皿内,于37℃、5%CO2培养箱中培养,用0.25%胰酶消化,培养7 d以1 : 2传代。按1×105个/ml密度在25 cm2培养瓶内接种细胞,达到60%左右融合时,使细胞同步化生长24 h后分组。分组情况:正常培养液(空白组)、TGF-β110 ng/ml(TGF-β1组)、肾康灵25 μg/ml+TGF-β110 ng/ml(肾康灵组),分别给药48 h。
2.2 Western bloting法
细胞用预冷的PBS洗3次,加入含PMSF的裂解液,冰上裂解30 min,4℃、12 000 rpm、10 min离心,提取总蛋白并测定蛋白浓度。蛋白质变性后经电泳、转印、封闭,加入抗α-SMA和抗β-actin的一抗中,4℃孵育过夜;洗膜后再加入二抗,室温孵育1 h;洗膜后加入ECL显色液,静置1 min,用凝胶图象处理系统分析目标条带的光密度值。
2.3 RP-PCR法
总RNA的提取可根据TRIzoI试剂说明书进行,依照逆转录扩增试剂盒操作程序采取cDNA的合成。经对Primers软件的利用,对目的基因引物予以设计。E-cadherin mRNA引物序列为:5’-GCTGGACCGAGAGAGTTTCC-3’,5’-CAAAATC CAAGCCCGTGGTG一3’,长度155 bp。扩增反应条件:95℃进行预变性15 min,95℃变性45 s,95℃退火10 s,60℃延伸30 s,共45个循环,最后一次,72℃延伸5 min。反应结束后,实施专用凝胶成像仪成像。实施Image-Lab软件光密度值统计扫描图像的目的条带,分析比较内参基因和目的基因PCR产物的光密度,得出mRNA的相对含量。
3 统计学处理
4 结果
4.1 Western bloting法检测α-SMA
TGF-β1组α-SMA蛋白的表达相对于空白组明显上调(P=0.018<0.05),而肾康灵组α-SMA蛋白的表达水平低于TGF-β1组,与之比较,差异具有统计学意义(P=0.023<0.05)。结果见图1。
4.2 RP-PCR法检测E-cadherin
与空白组比较,TGF-β1组E-cadherin表达降低(P=0.001<0.05),而肾康灵组E-cadherin表达水平高于TGF-β1组,差异具有统计学意义(P=0.043<0.05)。结果见图2。
5 讨论
PNS属于祖国医学“水肿”“尿浊”范畴[6],其根本病机为本虚标实,虚实夹杂[7]。肾康灵具有益肾滋阴、行气化瘀之效。临床研究证实[8-9],肾康灵可以改善PNS患儿高凝状态,又可以调节机体免疫功能,降低感染率,减少PNS的复发。动物实验发现[5,10],肾康灵能改善阿霉素大鼠肾脏局部毛细血管通透性与血流动力学,溶解血栓,修复足突,实现保护肾小管间质的效果。PNS频复发、激素耐药或病情长期不能缓解时,可刺激促纤维化相关因子和炎性趋化因子释放,刺激间质成纤维细胞活化,分泌大量细胞外基质成分,形成肾间质纤维瘢痕,最终致肾间质纤维化。TGF-β1是目前最关键的促纤维化因子之一,TGF-β1的表达和肾脏纤维化的严重程度呈正相关性。在激素耐药性肾病病理类型为膜增殖性肾病、局灶阶段肾小球硬化或最终发展为终末期肾病的病例中,TGF-β1增加[11]。转分化过程中,肾小管上皮细胞逐步向间质细胞转化,随着肾间质纤维化的不断进展,作为公认的肌成纤维细胞的特征性标志蛋白α-SMA的表达不断升高[12]。与之相反,E-cadherin广泛存在于正常的肾小管上皮组织中,而当出现细胞损伤的情况时,其含量则不断减少。
本实验中,TGF-β1组α-SMA表达增加,同时E-cadherin mRNA的表达下降,说明其成功诱导了肾间质纤维化的发生。而肾康灵可抑制α-SMA的表达,增加E-cadherin mRNA的表达,证明了肾康灵能够拮抗TGF-β1引起的肾小管上皮转分化,减少TGF-β1对肾小管上皮细胞的损伤。
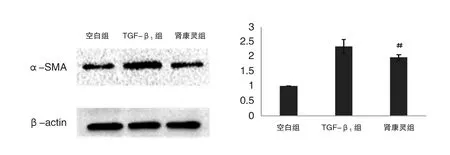
图1 Western blot法检测α-SMA
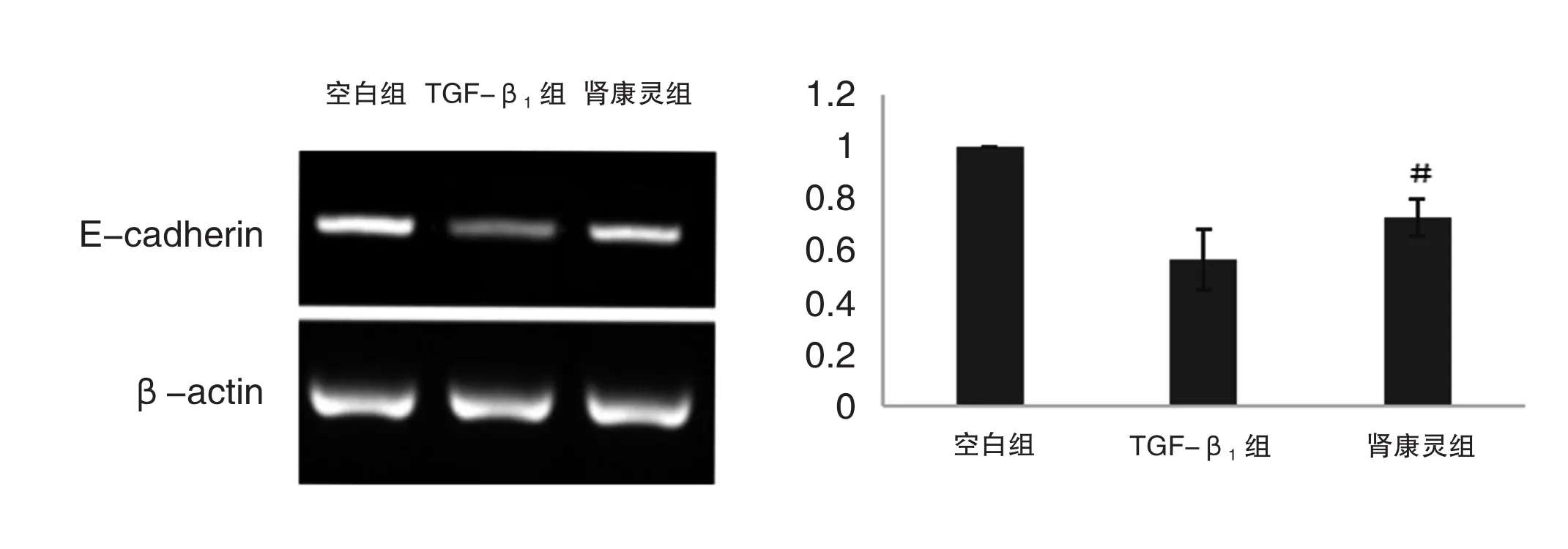
图2 RP-PCR法检测E-cadherin
综上所述,肾康灵能够通过抑制肌成纤维细胞的特征性标志蛋白α-SMA的表达,增加肾小管上皮细胞分泌的上皮细胞标记物E-cadherin mRNA的表达,抑制转分化的发生,减轻TGF-β1对肾小管上皮细胞的损害,改善肾脏纤维化,从而达到了保护肾脏的效果。
