PPARγ与MSX2在甲状腺肿瘤术后患者骨代谢的作用机制研究
2018-10-15余昌文
邹 勇,余昌文
(湖北省汉川市人民医院肿瘤科 431600)
甲状腺癌是内分泌系统最常见的恶性肿瘤,近年来,由于疾病诊断技术的提高以及公众对疾病认识的改善,大多数地区甲状腺癌发病率呈持续上升趋势[1-2]。手术治疗是目前甲状腺癌常用的治疗方式之一[3],而术后并发症的预防与治疗,是患者预后的关键因素。骨质疏松症是甲状腺手术术后常见的并发症,可以引起骨折,严重影响患者生活质量与预后。
甲状腺激素对于骨代谢的影响是多通路进行的。适量的甲状腺激素可以通过胰岛素样生长因子-Ⅰ(IGF-Ⅰ)等途径促进骨形成[4],而过量的甲状腺激素将影响正常骨代谢,导致骨量丢失[5]。有研究证明,过氧化物酶增殖物激活受体γ(PPARγ)以及wnt通路中的MSX2/Hox8.1蛋白(MSX2)在骨代谢的过程中起到重要作用[6-8]。本文将对PPARγ、MSX2在甲状腺癌术后患者骨代谢中的作用进行探讨,为甲状腺癌术后骨质疏松的研究以及患者的治疗选择提供支持。
1 资料与方法
1.1一般资料 选择2010年1月至2015年12月于本院行甲状腺癌切除术患者纳入治疗组。入组标准:(1)甲状腺癌全切术或次全切术患者;(2)使用稳定剂量左甲状腺素钠片治疗,抑制目标为促甲状腺激素(TSH)<0.5 mU/L者;(3)规律随访,签署知情同意书行相关检查者。排除标准:(1)绝经期女性;(2)伴随骨转移的患者;(3)伴有甲状旁腺损伤的患者;(4)伴随其他骨代谢疾病患者;(5)应用影响骨代谢药物的患者。对照组为1∶1匹配经病理科(由于病情需要进行骨髓穿刺术,术后保留病理切片)诊断排除甲状腺癌,并且通过临床病历系统查询,排除其中具有影响骨代谢疾病、接受影响骨代谢治疗、绝经及肿瘤的患者。治疗组共29例患者,其中男13例,女16例;平均年龄(36.4±6.9)岁;病理分型:乳头状癌17例,滤泡样癌6例,髓样癌5例,未分化癌1例;患者平均左甲状腺素钠片治疗时间(4.62±1.83)个月。对照组匹配患者29例,其中男11例,女18例,平均年龄(31.7±8.3)岁。两组患者使用左甲状腺素钠片的例数与剂量差异无统计学意义(P>0.05),具有可比性。
1.2仪器与试剂 自动包埋仪、石蜡切片机、乙二胺四乙酸二钠、4%多聚甲醛、苏木素、伊红、二甲苯、乙醇、盐酸、氨水、PPARγ抗体(Santa Cruz Biotechnology公司)、MSX2抗体(Abcam公司)、浓缩型二氨基联苯胺(DAB)试剂盒(北京中山生物技术有限公司)、光密度图像分析仪(德国Leica Q550CW)、Qwin图像分析软件。
1.3方法 两组患者行骨髓穿刺术+活检术,留取骨组织标本,脱钙,石蜡包埋。
1.3.1HE染色流程 切片脱蜡至水化,染色、分化、反蓝:苏木精液染色5 min→自来水洗1 min→1%盐酸乙醇1~2 s→水洗1 min→1%氨水返蓝10~30 s(以镜下观察为准,因多次使用,氨水水平降低,时间增加)→蒸馏水过洗1 min→0.5%~1.0%乙醇伊红液染色2 min。
1.3.2免疫组织化学流程 (1)石蜡包埋的骨组织常规切片(防脱玻片),60 ℃烤箱l h,静置30 min;(2)梯度乙醇脱蜡水化;(3)抗原修复2 min;(4)3%H2O2封闭内源性过氧化物酶;(5)加1∶100稀释一抗4 ℃孵育过夜;(6)磷酸盐缓冲液(PBS)浸洗后加生物素化二抗;(7)PBS浸洗后DAB显色;(8)苏木素复染;(9)脱水、封片。阴性对照采用0.01 mol/L的PBS代替一抗,其他步骤不变。
1.3.3图像分析 HE染色:对切片使用全自动图像数字化分析仪进行检测,测量及计算静态参数指标包括骨小梁面积百分数、骨小梁厚度。每张切片测量整个标本,在10×10倍镜下进行。免疫组织化学:在相同光源强度、10×40倍镜下,采用盲法对免疫组织化学图片随机取图,4张/标本。通过Image Pro-Plus(IPP6.0)分析每张图片阳性区域吸光度(A)值,取其平均值代表该样本的A值。
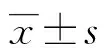
2 结 果
2.1HE切片结果 切片染色后,骨小梁被染成红色,细胞核被染成蓝色,脂肪细胞由于脂滴溢出,表现为圆形空泡,见图1。治疗组脂肪面积明显增多,骨小梁面积及厚度均减少,对照组与其相反,见表1。
图1 骨组织HE染色(10×10倍)
表1 两组骨小梁面积、厚度比较
2.2PPARγ免疫组织化学结果 骨组织中PPARγ蛋白呈棕褐颗粒,主要位于细胞核,因PPARγ蛋白表达量的多少,而呈现棕褐色颗粒多少不同及染色深浅不同。PPARγ蛋白表达量多者,平均积分光密度大,反之则平均积分光密度小,见图2。治疗组PPARγ平均积分光密度为(83.953±10.611)×105,高于对照组的(73.624±10.766)×105,差异有统计学意义(t=2.232,P<0.05)。
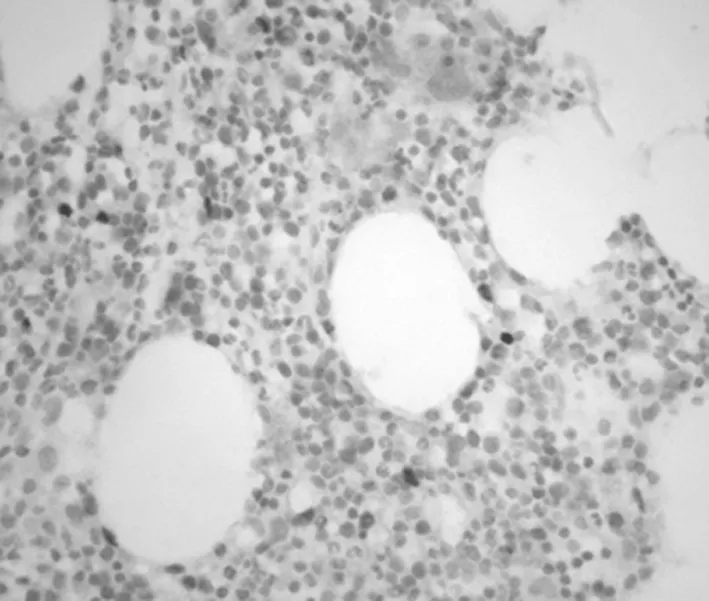
图2 PPARγ免疫组织化学结果(10×20倍)
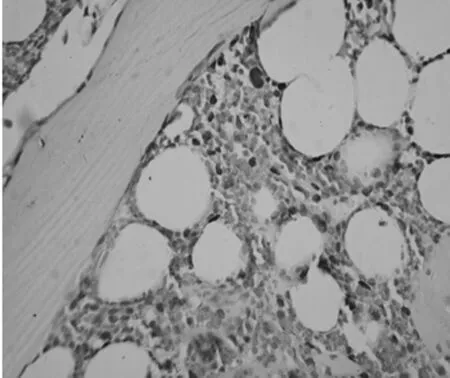
图3 MSX2免疫组织化学结果(10×20倍)
2.3MSX2免疫组织化学结果 骨组织中MSX2蛋白与PPARγ相似,也呈棕褐颗粒并位于细胞核,见图3。治疗组MSX2平均积分光密度为(41.053±9.602)×105,低于对照组的(52.179±9.240)×105,差异有统计学意义(t=1.581,P<0.05)。
3 讨 论
骨髓基质干细胞(BMSC)具有多向分化潜能,在不同诱导体系中可分化为成骨细胞、软骨细胞、脂肪细胞等多种细胞[9]。正常骨代谢中存在着成骨和破骨之间的动态平衡,当破骨因素所起作用相对固定时,成骨作用的强弱决定了骨质疏松发生与否。而BMSC可以分化为成骨细胞,也可以分化为脂肪细胞,当成脂肪作用增强时,骨髓腔内脂肪细胞增多,势必引起髓腔内缺血缺氧,从而导致局部骨坏死、骨质疏松、骨折。PPARγ是PPARs的一个亚型,由配体启动后参与调节细胞的分化、增殖及凋亡,是脂肪分化的主要调控因子,可以促进BMSC向脂肪细胞分化[10]。结合本研究中骨组织HE染色结果可以发现,脂肪空泡的面积增加,免疫组织化学中PPARγ的表达增高,推测在甲状腺肿瘤术后患者的骨代谢过程中,BMSC向脂肪细胞分化作用加强,这可能是导致患者后续发生骨质疏松的重要原因之一。
在骨形成的过程中wnt与BMP两大通路起到了重要作用,MSX2可以抑制MSCs向成脂肪方向分化,上调wnt及其配体的表达,从而促进成骨、抑制成脂,双向上调该通路的成骨作用[11]。结合本研究免疫组织化学结果可以发现,甲状腺肿瘤术后患者骨组织中MSX2的表达下降,并且低于对照人群,一定程度上可以推测,患者术后骨代谢的过程中成骨作用受到了抑制。
在甲状腺肿瘤术后患者中,成骨作用受到了一定程度上的抑制,而成脂肪作用则得到了一定的促进,这两方面综合因素可能是患者发生骨质疏松的重要原因,而PPARγ和MSX2在此过程中起到了重要的作用。这两个蛋白表达的改变,提示甲状腺癌术后患者骨质疏松的发生,可能是骨代谢的动态平衡中成脂肪途径过度表达,成骨途径受到抑制的结果。这也提醒临床,患者在甲状腺手术后的治疗,可以从改善患者成脂肪途径和成骨途径动态平衡的药物着手。
当然,由于免疫组织化学检测更倾向于定性研究,近年来电脑软件的发展,可以通过光密度法对试验结果进行分析,但是其结果的精确性可能与绝对的定量研究存在一定程度上的差别。如果通过免疫组织化学法与定量聚合酶链反应(PCR)相结合,结果一致的话,可能更能使人信服。但是由于骨髓活检术所取得的标本量特别少,骨组织含有大量细胞外基质,如钙、胶原等,有效细胞很少,使骨组织mRNA的量以及纯度不能满足进一步检测的要求,故没有进行定量PCR的研究。后续也将进行更准确的定量研究进一步探讨该方面的机制。
