唾液miRNA-205检测在喉鳞状细胞癌中的诊断价值
2018-10-15罗彬瑞郭天虹黄远帅
罗彬瑞,郭天虹,黄远帅△
(西南医科大学附属医院输血科,四川泸州 646000)
头颈癌是全世界第六大常见肿瘤,其中喉癌是头颈部最常见的恶性肿瘤之一,而喉鳞状细胞癌(LSCC)是喉癌中最常见的组织学类型[1-2]。目前喉癌的治疗方法主要包括外科手术切除、放疗和化疗,这些治疗方法对早期喉癌患者效果较好,但对晚期患者的治疗效果欠佳,因此,其5年生存率也不理想[3]。因此,发现喉癌的早期诊断标志物显得尤为重要。微小核糖核酸(miRNA)参与了人体细胞多种重要的调节过程[4],而miRNA的异常表达与肿瘤发生、发展的关系已成为目前研究的热点。miRNA-205作为miRNA家族中重要的一员已被发现在许多类型的肿瘤中呈异常表达,包括前列腺癌、膀胱癌和头颈部癌(口咽癌、鼻咽癌、喉癌等)等[5-7]。
目前,已有多项研究发现LSCC患者中有特别的miRNA表达谱(包括miRNA-205)[7-9],并能提示LSCC的诊断,但这些研究都是基于患者的组织或血液标本(血清或血浆)。组织和血液标本都不是适合广泛筛查的标本类型:首先肿瘤组织标本的收集是侵入性、有创性的操作,且肿瘤组织的出现说明患者已出现了癌变,不适用于广泛人群的早期大规模的普查;其次,血液标本的收集繁琐,且也属于有创性操作,并有感染的风险,对于普查项目而言大众接受度不高。因此,找到一种合适、方便易获取、无创的标本类型作为筛查项目显得尤为重要。目前有研究发现,miRNA存在于多种体液中[10],包括血液、尿、乳汁、泪液、唾液等12种人体体液,其中唾液是所有体液中miRNA含量最为丰富的组织,且很多血液中的miRNA也同样存在于唾液中。人体每天都要分泌大量唾液,唾液标本收集方便且为非侵入性,对于LSCC患者,唾液比血液更邻近病变组织。因此,以唾液miRNA作为生物标志物对LSCC的诊断和预后判断是非常值得探讨的[11]。目前唾液miRNA在头颈部鳞癌中的研究仍是热点,其中口咽癌、食管癌等都有单独的研究并发现有特征的唾液miRNA变化谱[12-13],而单独的miRNA在LSCC患者唾液中的表达水平以及其对早期LSCC的诊断价值如何,国内外鲜见报道。本研究初步探讨唾液miRNA-205对LSCC早期诊断的临床价值,现报道如下。
1 资料与方法
1.1一般资料 本研究的患者唾液取自本院初诊的15例LSCC患者、10例喉声带息肉(VCP)患者及10例体检中心的健康体检者。LSCC患者均为男性,汉族,平均年龄(60.40±8.39)岁,纳入LSCC组。所有LSCC、VCP患者入院后均经病理活检(金标准)证实,且无伴发其他慢性病、传染性疾病、口腔疾病,如糖尿病、结核、口腔溃疡等。LSCC患者手术前均未接受放化疗等治疗。以年龄、性别(均为男性)、种族(均为汉族)匹配且无其他疾病的VCP患者、健康体检者分别纳入VCP组、健康对照组,每组10例。所有纳入的研究个体均签署了知情同意书。
1.2仪器与试剂 miRNA-205引物委托上海生工生物工程有限公司合成(F:5′-AGCGTAGCTTATCAGACTGATGTTGA -3′;外参引物包含在德国凯杰公司的miRNeasy Serum/Plasma试剂盒中);提取试剂选择德国凯杰公司的miRNeasy Serum/Plasma试剂盒(规格型号:217184);外参是德国凯杰公司的miRNeasy Serum/Plasma Spike-In Control(cel-39)(规格型号:219610);反转录为德国凯杰公司的miScriptⅡ RT试剂盒(规格型号:218161);扩增选择德国凯杰公司miScript SYBR Green PCR试剂盒(规格型号:218073)。PCR扩增仪选用ABI-7500荧光定量PCR仪;凝胶成像系统采用GBOX-CHemi-XR5(英国Syngene公司)。
1.3方法
1.3.1唾液采集 唾液收集前,所有研究个体需禁食、禁饮2 h以上。收集时使用50 mL无菌无酶离心管,采用非刺激性的收集方法使唾液自然流出,收集量需达3 mL。唾液收集完后,4 ℃、1 900 r/min离心10 min取上清液至1.5 mL EP管,再以4 ℃、16 000 r/min离心10 min后再弃沉淀取上清液,将所获上清液至1.5 mL EP管置-80 ℃保存。标本收集好后需2 h内作出上述处理。LSCC患者手术前和手术后6个月各采集1次唾液标本;VCP患者术前采集1次唾液标本;健康体检者采集1次唾液标本。
1.3.2临床资料收集 收集LSCC患者的临床资料,包括性别、年龄、个人史(吸烟、饮酒史)、肿瘤生长部位、分化程度、临床病理分期。肿瘤临床分期根据肿瘤的生长范围及扩散程度,按2002年国际抗癌联盟(UICC)喉癌TNM分期方案分为Ⅰ~Ⅳ期。
1.3.3RNA提取及反转录 按照试剂盒说明书提取RNA:取唾液上清液200 μL,加入1 mL QIAzol混匀孵育后,加入1 mL氯仿进行萃取,离心后,上清液经离心柱过柱,洗脱获得miRNA。加入氯仿前加入3.5 μL德国凯杰公司的miRNeasy Serum/Plasma Spike-In Control(cel-39)作为外参。使用Nanodrop ND-1000检测提取总RNA的质量,总RNA的A260/A280值在1.8~2.1为合格的RNA样品(说明样品RNA制备较纯,无蛋白质污染),可进行下一步操作。
取12 μL提取合格的RNA按照试剂盒说明进行反转录。反应体系组成:2 μL miScript Reverse Transcriptase Mix(一种经优化的poly(A)聚合酶和反转录酶混合物)、2 μL 10× miScript Nucleics Mix(包括dNTPs、rATP、oligo-dT引物等)、4 μL 5× miScript HiSpec Buffer、12 μL miRNA,然后进行反转录。反应条件为37 ℃ 60 min,95 ℃ 5 min。反转录反应完成后cDNA用无酶水以1∶10稀释后置-20 ℃保存。
1.3.4运用反转录聚合酶链反应(RT-PCR)检测唾液中miRNA-205的相对表达量 反转录产物使用德国凯杰公司miScript SYBR Green PCR试剂盒联合miRNA特异性前向引物进行RT-PCR检测,以Cel-miRNA-39作为外参miRNA。反应体系组成:2.5 μL RT产物、2.5 μL特异前向引物、2.5 μL通用的反向引物、12.5 μL 2×QuantiTect SYBR Green PCR Master Mix、5 μL无酶水。反应条件:95 ℃ 15 min后,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,40个循环。同时做溶解曲线判断基因扩增的特异性。RT-PCR检测在ABI-7500荧光定量PCR仪上完成,试验结果使用2-ΔΔCt法对目的基因进行相对定量。
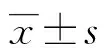
2 结 果
2.1各组唾液中miRNA-205的相对表达水平 采用RT-PCR定量检测15例LSCC患者和10例VCP患者以及10例健康者唾液中的miRNA-205表达水平,发现与健康对照组(2.33±0.97)相比,LSCC组患者(11.73±4.53)及VCP组患者(9.72±5.12)唾液中miRNA-205的表达水平均上调,LSCC组患者上调更明显,且差异有统计学意义(P=0.036)。10例VCP患者唾液中的miRNA-205的表达水平相比于健康对照组也呈上调趋势,但差异无统计学意义(P>0.05)。见图1。
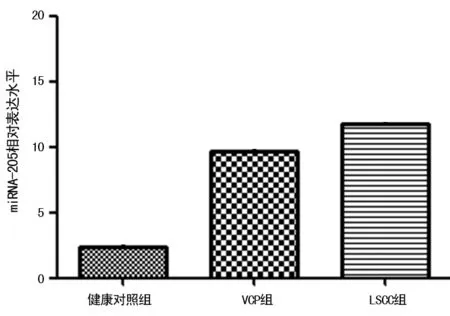
图1 3组唾液中的miRNA-205表达水平
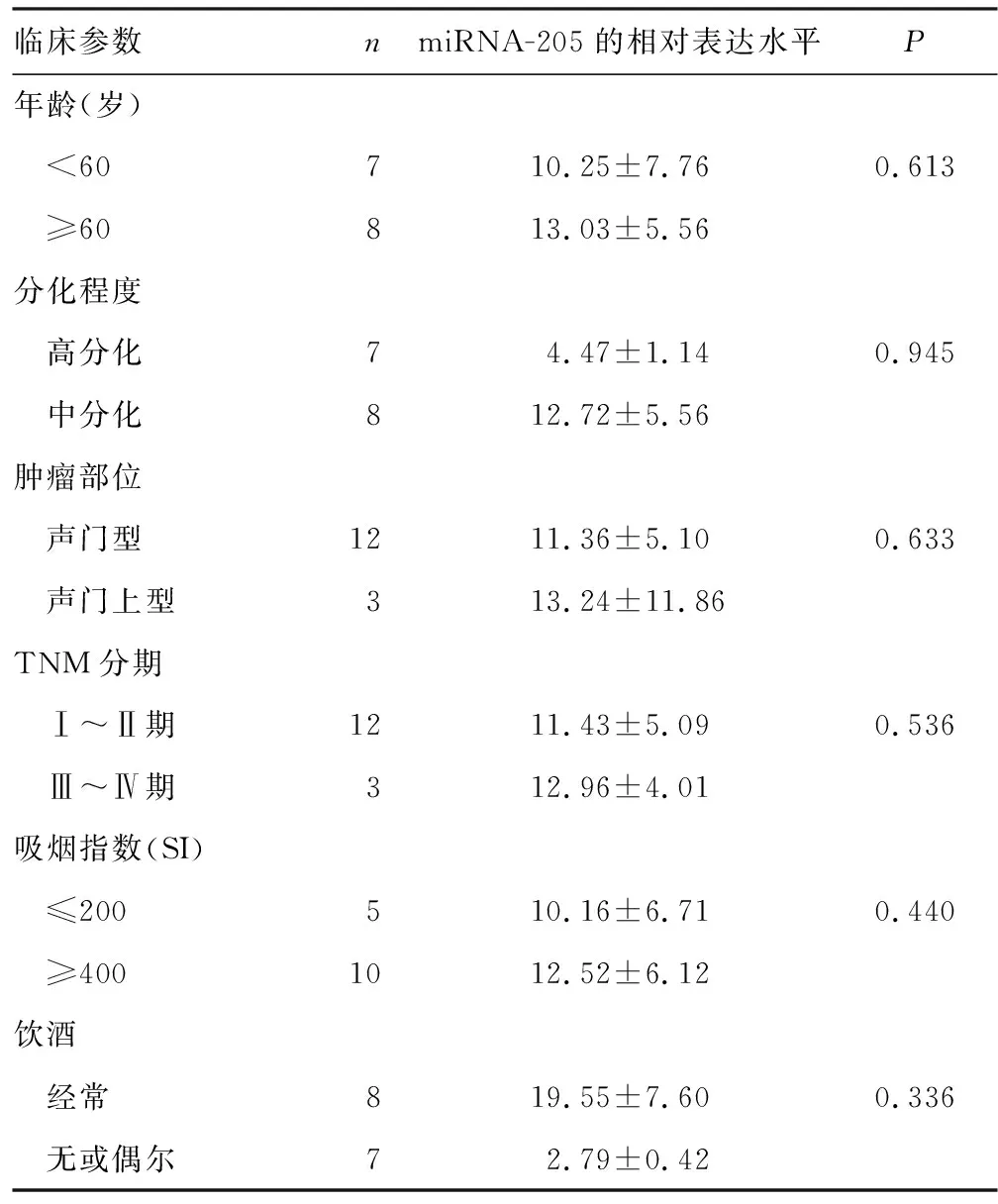
表1 LSCC患者唾液中miRNA-205的相对表达水平与临床参数的相关性
注:吸烟指数(SI)=每日吸烟支数×吸烟年数;SI<200为轻度吸烟,200~400为中度吸烟,>400为重度吸烟;本研究中无中度吸烟者
2.2LSCC患者唾液中miRNA-205的相对表达水平与临床参数的相关性 采用Mann WhitneyU检验分析发现,肿瘤中分化者较肿瘤高分化者唾液中miRNA-205的相对表达量高,Ⅲ~Ⅳ期的LSCC患者唾液中miRNA-205的相对表达量也高于Ⅰ~Ⅱ期的患者,但差异均无统计学意义(P=0.945、0.536)。其他临床参数(患者年龄、吸烟史、饮酒史、肿瘤的生长部位)与miRNA-205的表达水平均无关。见表1。
2.3LSCC患者唾液中miRNA-205对LSCC的诊断价值 采用ROC曲线分析miRNA-205对LSCC的诊断价值发现,唾液中miRNA-205区分LSCC患者与健康者的曲线下面积(AUC)为0.753 0(95%CI:0.546 0~0.961 0,P=0.036),截断值取1.617 4时,灵敏度与特异度分别为86.7% 与70.0%。说明唾液中的miRNA-205检测可作为LSCC诊断的生物标志物。见图2。
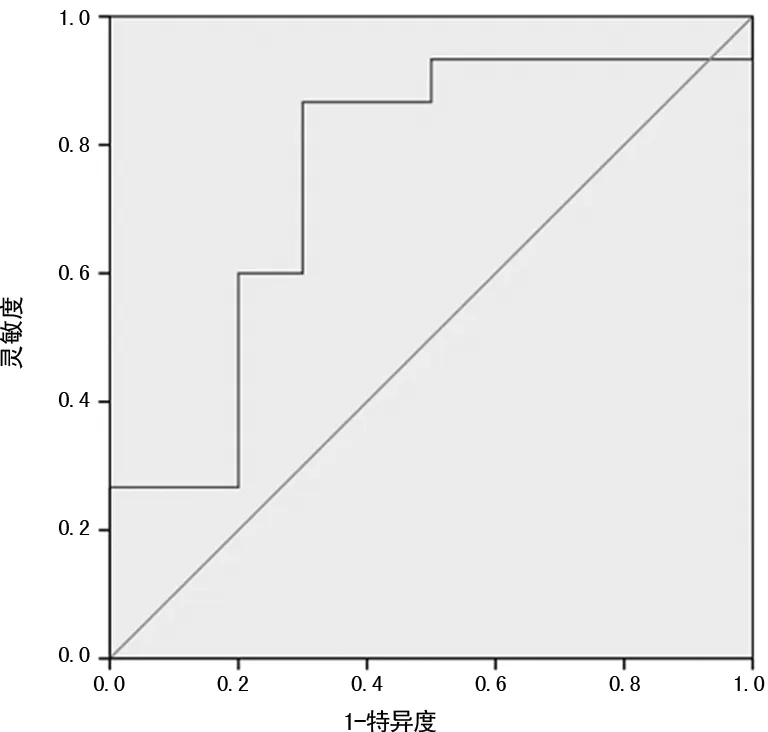
图2 ROC曲线
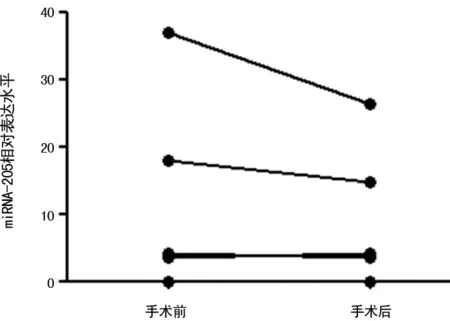
图3 LSCC患者术前、术后唾液中的miRNA-205表达水平
2.4LSCC患者唾液中miRNA-205术前、术后的变化 为了评价LSCC患者唾液中miRNA-205术前、术后的动态变化,监测了5例LSCC患者手术前和手术后6个月的miRNA-205的变化,这5例患者手术后的miRNA-205相对表达水平(9.75±4.82)较手术前(12.53±6.83)有下降的趋势,但差异无统计学意义(P=0.841)。研究再比较了手术后与健康对照组的miRNA-205的表达量发现,手术切除肿瘤组织后,miRNA-205的表达水平与健康对照组差异无统计学意义(P=0.440)。见图3~4。
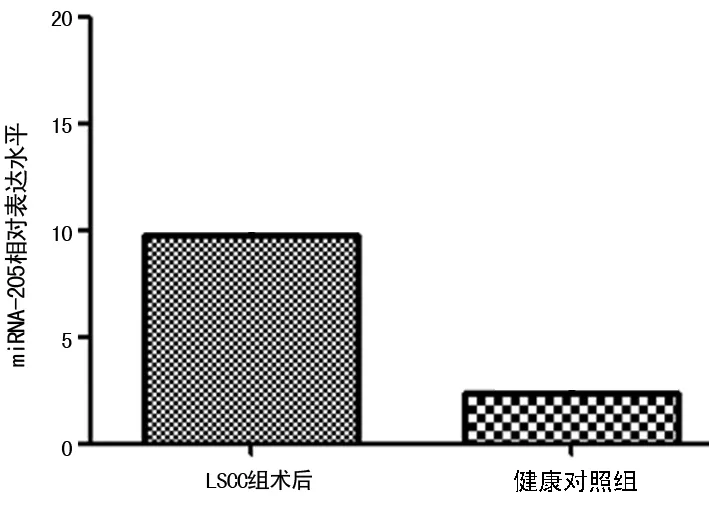
图4 LSCC患者术后与健康对照者唾液中的miRNA-205表达水平
3 讨 论
miRNA的发现为肿瘤的诊断、发生和发展机制,以及治疗的研究开启了新的方向。近年来,越来越多的研究发现miRNA在肿瘤中的表达量有异常改变,这使得miRNA可能成为肿瘤诊断的新的生物学标志和治疗药物作用的靶标。CAO等[7]应用miRNA芯片的方式筛选了6对LSCC及其邻近正常组织中差异性表达的miRNA,发现了29个差异表达的miRNA(包括26种上调的和3种下调的miRNA),如上调的miRNA-21、miRNA-93、miRNA-205,以及下调的miRNA-708、miRNA-125b、miRNA-145等。这些差异表达的miRNA可能在LSCC的发生和发展中起到关键作用,这也为进一步研究miRNA的功能提供了一个新的视角。AYAZ等[9]采用高通量实时定量聚合酶链反应筛选LSCC患者与健康对照者血浆中差异表达的miRNA,发现了17种上调的miRNA和9种下调的miRNA,其中有5种miRNA是从未在其他疾病中发现的,属于LSCC特异性的miRNA(miRNA-603、miRNA-1303、miRNA-660-5p、miRNA-331-3p和miRNA-212-3p)。唾液作为血液循环的末端产物,与血液中的很多物质都有相同的表达谱,这使其成为很多疾病早期诊断和治疗的特异性生物标志物[11-14]。
本研究以LSCC患者和VCP患者、健康者的唾液为出发点,检测唾液中的miRNA-205的表达情况,探讨其对LSCC早期诊断的临床价值发现:LSCC患者的唾液中miRNA-205的表达水平相比健康者显著上调,而与LSCC早期症状相似的VCP患者唾液中miRNA-205的表达水平相比健康者也有上调,但差异无统计学意义(P>0.05)。同时本研究采用了ROC曲线分析了唾液中miRNA-205的诊断效能,结果显示其AUC为0.753 0,截断值取1.617 4时,灵敏度与特异度分别为86.7%与70.0%,这说明了唾液中的miRNA-205检测可作为LSCC诊断的生物标志物且诊断性能良好。同时,本研究中LSCC患者唾液中miRNA-205的显著上调的变化趋势与之前研究提示的肿瘤组织中的miRNA-205的变化趋势一致[6],这说明了唾液中的miRNA-205可能是肿瘤组织细胞的释放,这与目前许多研究者认为的循环中核酸起源的假设一致[15]。但其真正的来源与机制还需要进一步的研究。
本研究还比较了5例LSCC患者手术前和手术后唾液中miRNA-205的动态变化,发现LSCC患者手术后唾液miRNA-205的水平有下降趋势,但差异无统计学意义(P>0.05)。同时分析了一些基本临床参数与miRNA-205表达水平的关系,虽然结果显示肿瘤中分化者较肿瘤高分化者唾液中miRNA-205的相对表达量高,Ⅲ~Ⅳ期的LSCC患者唾液中miRNA-205的相对表达量也高于Ⅰ~Ⅱ期的患者,但差异均无统计学意义(P>0.05)。这可能与本研究所纳入的研究样本较少、组间差异大有关,其中的相关性尚需进一步深层次的研究。
综上所述,本研究检测了LSCC患者唾液中miRNA-205的表达水平,并发现唾液中miRNA-205存在高表达,可作为LSCC早期诊断的标志物。miRNA-205作为miRNA家族的成员,其在恶性肿瘤组织和细胞中的表达对指导肿瘤的早期诊断和及早干预、治疗都有着重大的意义[6,16-17]。如果唾液中的miRNA-205能够成为一种无创、可行性高、方便的检测手段,将对miRNA的临床应用有重大意义。本研究由于是初步的探讨性研究,样本数量较少,且可能由于地域差异,于本院就诊的LSCC患者均为男性,因此结果存在一定的局限,所以更多样本、不同的地域的研究将是下一步要做的工作。
