靶向HER2/EGFR分子双特异性单链抗体的构建及其体内外抗乳腺癌的研究
2018-10-15张长庆
郭 艳,张长庆
(内蒙古医科大学附属人民医院乳腺肿瘤科,呼和浩特 010020)
据统计,全球因乳腺癌死亡的人数达到每年46万[1]。乳腺癌成为严重危及女性健康甚至生命的恶性肿瘤。如今对于乳腺癌的治疗仍以手术切除和化疗、 放疗、 内分泌治疗的联合治疗为主[2-3],但不良反应多、患者依从性差、复发率高等问题仍然没有得到很好解决。而近些年分子靶向药物的发展明显改善了乳腺癌的治疗效果,单克隆抗体药物作为最为主要的靶向药物,其通过与受体的结合激活下游信号通路或者下调受体表达,达到促肿瘤细胞凋亡或抑制的作用[4-6]。其中最为有效的抗体治疗药物为靶向人类表皮生长因子受体2(HER2)的曲妥珠单抗和靶向表皮生长因子受体(EGFR)的西妥昔单抗[7-8]。HER2与EGFR都属于酪氨酸激酶EGFR家族,在多种乳腺癌的发生、发展过程中过度表达或激活。针对HER2与EGFR靶点的单克隆抗体可以很好地阻断肿瘤细胞的信号传导,抑制酪氨酸激酶的活性,从而抑制肿瘤的发生、发展[9]。
研究发现,当长期使用单一靶向HER2或EGFR的药物抑制某一通路时,在给药一段时间后会造成肿瘤细胞的代偿,产生耐药性,致使药效明显降低。而同时靶向HER2和EGFR两个靶点则可以抑制多条细胞信号传导通路,避免单一抑制的代偿,降低耐药性和不良反应[9]。基于这一理论,本文提出一种同时靶向HER2和EGFR双特异性单链抗体的研究方案。其相较于单克隆抗体含有两种特异性抗原结合位点,在肿瘤细胞的不同靶点之间同时发挥效应功能,产生协同抑制的效果,解决了抗体单独使用疗效不佳且易产生耐药性的问题[10-13]。并且双特异性单链抗体相对于双特异性抗体相对分子质量更小,肿瘤组织渗透能力更强,免疫原性更低,为肿瘤的临床治疗提供新的方案和思路[14-15]。
1 材料与方法
1.1材料来源 DMEM培养基购自美国Invitrogen公司;蛋白标志物购自美国热电公司;鼠抗His抗体、FITC偶联的羊抗鼠IgG-Fc单克隆抗体购自南京赛博生物公司;西妥昔单抗购自德国默克公司;曲妥珠单抗购自瑞士罗氏公司;胎牛血清(FBS)购自美国Invitrogen公司;Balb/c裸鼠购自扬州大学动物中心;免疫组织化学试剂盒DAB显色剂购自DAKE公司;细胞培养瓶及相关培养耗材购自美国热电公司。
1.2方法
1.2.1双特异性单链抗体表达及纯化 通过DrugBank数据库搜索曲妥珠单抗和西妥昔单抗的轻链与重链可变区蛋白序列,使用柔性肽(G4S)将其连接在一起,并在C端引入6个组氨酸作为His标签。双特异性单链抗体序列经过毕赤酵母偏爱密码子优化后送公司合成,并导入工程质粒中。采用毕赤酵母X-33表达系统进行检测。发酵液经硫酸铵沉淀法初步提取后采用镍柱进一步分离纯化得到电泳纯蛋白,最后利用蛋白印迹法(western blot)对纯化得到的蛋白进行鉴定,以期获得高产量、高纯度的双特异性单链抗体[16]。
1.2.2流式细胞术 制备乳腺癌BT474单细胞悬液,细胞密度为每毫升107个。分为曲妥珠单抗组、西妥昔单抗组,双特异性单链抗体组和脱脂牛奶空白对照组。在每组中分别加入250 μL相应的抗体或脱脂牛奶,抗体水平为100 nmol/mL,冰上孵育1 h,洗涤,孵育鼠抗His抗体,洗涤,再孵育FITC-偶联的羊抗鼠IgG抗体,洗涤,上机检测。使用FlowJo 7.6.1对流式数据进行处理。
1.2.3细胞增殖抑制实验(MTT法) 制备BT474单细胞悬液,铺板,用培养基将细胞水平调整至每毫升3×104个,以每孔100 μL接种于96孔细胞培养板,设置只有培养基不含细胞的空白对照组。用含2%FBS的相应培养基将曲妥珠单抗、西妥昔单抗以及等量双特异性单链抗体以每孔50 μL的量加入96孔板中,每个水平设置3个复孔,37 ℃培养箱中静置培养1 h。按照每孔50 μL的量加入含20 ng/mL表皮生长因子(EGF)和血管内皮细胞生长因子(VEGF)的2%FBS-1640培养基,使每孔中EGF和VEGF的终浓度均为10 ng/mL;培养72 h后每孔加入11 μL的MTT溶液(5 mg/mL),37 ℃培养箱中继续培养4 h,弃上清液,每孔加入150 μL DMSO后将96孔板放于微量振荡器上振荡1 min。最后用酶标仪检测57 nm处和63 nm处的吸光度,将A570~A630作为每个孔的吸光度。抑制率按此计算公式:抑制率=(对照组吸光度-实验组吸光度)/对照组吸光度×100%。
1.2.4体内抗肿瘤活性检测 制备BT474单细胞悬液,细胞数在每毫升106个,取200 μL细胞悬液接种于裸鼠右侧腋皮下,观察移植瘤生长情况。并随机分组,每组8只,共分为以下5组:阴性对照组[磷酸盐缓冲液(PBS)组]、抗HER2的曲妥珠单抗组(10 mg/kg)、抗EGFR的西妥昔单抗组(10 mg/kg)、同时靶向HER2与EGFR的双特异性单链抗体高剂量组(10 mg/kg)、双特异性单链抗体低剂量组(5 mg/kg)。待瘤体积达到50~100 mm3时开始尾静脉给药(记为day1),每两天给一次药并且对肿瘤体积进行测量,按以下公式计算肿瘤体积:V=L×W2/2(其中V代表肿瘤体积,L代表肿瘤最长径,W代表肿瘤垂直方向的最大横径),绘制肿瘤生长曲线。在第19天结束给药,并计算各组体内肿瘤抑瘤率,抑瘤率=(对照组平均体积-实验组平均体积)/对照组平均体积×100%。
1.2.5免疫组织化学检测瘤内指标 将肿瘤切取合适大小的组织块用于固定,组织块用PBS洗涤两遍,迅速浸入4%多聚甲醛固定液中固定24 h。之后浸入70%乙醇30 min(重复3次),80%乙醇30 min(重复2次),85%乙醇30 min,90%乙醇30 min,95%乙醇30 min,100%乙醇30 min(重复2次)。乙醇∶二甲苯(1∶1) 30 min,二甲苯10 min,二甲苯∶石蜡(1∶1) 30 min,石蜡2 h。将浸好蜡的肿瘤组织于包埋机内进行包埋。将蜡块置于切片机上进行切片,片厚4 μm。切片漂浮于摊片机,40 ℃温水上将组织展平,用载玻片将组织捞起,放进60 ℃烘箱内烤片。切片脱蜡后将修复盒盛满EDTA抗原修复缓冲液(pH9.0),然后将组织切片置于其中并放入微波炉内加热,进行抗原修复,自然冷却后将玻片置于PBS,摇洗3次。3%H2O2溶液室温避光孵育20 min,PBS中洗涤3次。5%~10%的山羊血清室温孵育10 min以封闭切片,去封闭液后,滴加适量5%BSA稀释好的一抗,4 ℃孵育过夜。PBS洗涤3次,将组织切片稍甩干后,滴加适当比例稀释的HRP偶联的二抗,37 ℃孵育2 h,PBS洗3遍。DAB试剂盒显色。用梯度乙醇将切片脱水干燥,吹风机吹干玻片后二甲苯透明,中性树胶封片,最后拍照。
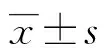
2 结 果
2.1获取双特异性单链抗体 搜索曲妥珠单抗和西妥昔单抗的轻链与重链可变区蛋白序列,通过Overlap PCR技术将其通过G4S连接在一起,并在C端引入6个组氨酸作为His标签(图1A),导入工程质粒中,毕赤酵母X-33进行表达。经过硫酸铵沉淀法和镍柱纯化得到双特异性单链抗体。在双特异性单链抗体的示意图(图1B)可以看出,其具有同时靶向HER2和EGFR的双特异性。双特异性单链抗体的相对分子质量为55×103,western blot验证了双特异性单链抗体装配的正确性(图1C)。研究获得了纯度较高且装配正确的双特异性单链抗体。
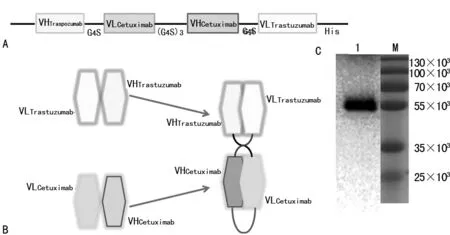
图1 双特异性单链抗体的基因设计、结构示意图及western blot验证
注:A为双特异性单链抗体基因设计;B为双特异性单链抗体结构示意图;C为western blot验证抗体相对分子质量;VHTrastuzumab为曲妥珠单抗重链可变区;VLCetuximab为西妥昔单抗轻链可变区;VHCetuximab为西妥昔单抗重链可变区;VLTrastuzumab为曲妥珠单抗轻链可变区;1为纯化的双特异性单链抗体;M为蛋白标记物
2.2流式细胞术结合实验结果 双特异性单链抗体能有效结合到乳腺癌BT474细胞表面。结果显示,曲妥珠单抗与BT474细胞的结合率为69.0%,西妥昔单抗为60.3%,双特异性单链抗体为53.3%,表明制备的双特异性单链抗体仍然保留母体抗体的结合活性,并没有因为抗体改造造成结合能力的降低。同时也从另一个方面说明乳腺癌BT474细胞株是HER2阳性,同时也是EGFR阳性的细胞株,证明了模型选择的正确性。见图2。
2.3MTT法分析双特异性单链抗体对乳腺癌BT474细胞增殖的抑制作用 实验结果表明,与PBS组相比,曲妥珠单抗组、西妥昔单抗组与双特异性单链抗体组(包括高剂量组和低剂量组)对BT474细胞均有抑制效果,且抑制作用呈浓度依赖性。在抗体水平达到400 nmol/L时,双特异性单链抗体高剂量组抑制增殖率可以达到(65.19±4.21)%,明显强于曲妥珠单抗组[(40.67±1.78)%]和西妥昔单抗组[(32.20±2.94)%]。通过MTT法可以进一步确定双特异性单链抗体设计的优势与效果。见表1。
2.4体内抗肿瘤实验检测结果 在体外细胞活性实验中,双特异性单链抗体展现出良好的抗肿瘤活性,其抑制BT474肿瘤细胞增殖的能力强于曲妥珠单抗和西妥昔单抗。进一步研究了其体内抗肿瘤活性,实验结果表明,单独抑制HER2或EGFR均能有效抑制肿瘤的生长,同时抑制HER2和EGFR的作用效果更加明显。双特异性单链抗体能显著抑制BT474细胞裸鼠移植瘤的生长,其抗肿瘤作用效果呈现浓度依赖性,高浓度抗体给药组的活性比低浓度给药组强。在第19天给药结束,通过肿瘤体积的测量发现,双特异性单链抗体高剂量组在体内发挥较强的抗肿瘤效果,该给药组的肿瘤体积明显低于其他各组(图3)。与PBS组相比,双特异性单链抗体高剂量组肿瘤抑制率可以达到(74.32±4.37)%,明显优于双特异性单链抗体低剂量组[(57.76±3.98)%]、曲妥珠单抗组[(44.83±6.02)%]、西妥昔单抗组[(39.44±8.75)%],差异均有统计学意义(P<0.05)。
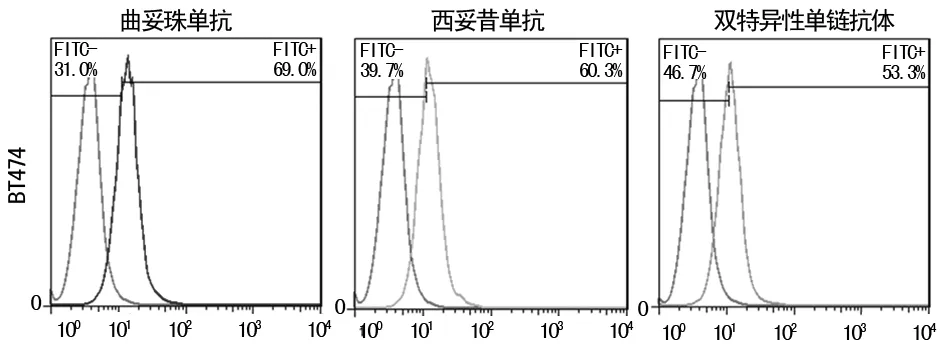
图2 曲妥珠单抗、西妥昔单抗、双特异性单链抗体与BT474细胞的结合
注:A为曲妥珠单抗与BT474细胞的结合;B为西妥昔单抗与BT474细胞的结合;C为双特异性单链抗体与BT474细胞的结合
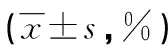
表1 MTT法检测各组细胞抑制率
注:与双特异性单链抗体高剂量组比较,*P<0.05
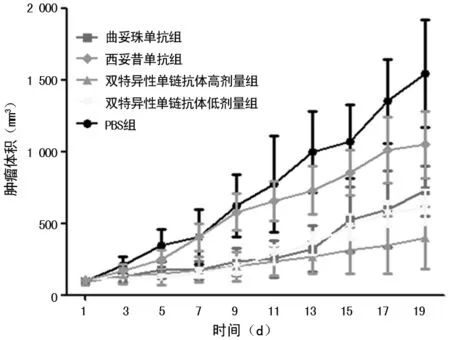
图3 不同给药组19 d内荷瘤裸鼠的瘤体积变化
2.5免疫组织化学法检测结果 在BT474细胞裸鼠移植瘤模型中,双特异性单链抗体显示出比其他抗体更强的抗肿瘤活性。通过进一步的免疫组织化学法检测发现,在BT474细胞裸鼠移植瘤模型中,双特异性单链抗体不仅能抑制EGFR的磷酸化,还能抑制肿瘤细胞的增殖。与PBS组相比,双特异性单链抗体高剂量组可以明显抑制BT474皮下移植瘤组织中p-EGFR、Ki-67的表达量。p-EGFR和Ki-67表达量的减少说明靶向HER2/EGFR的抗体可以抑制裸鼠肿瘤细胞表面EGFR的磷酸化,抑制肿瘤细胞的增殖。进一步说明联合靶向HER2/EGFR 比单靶向在抗肿瘤方面更有前景。见图4。
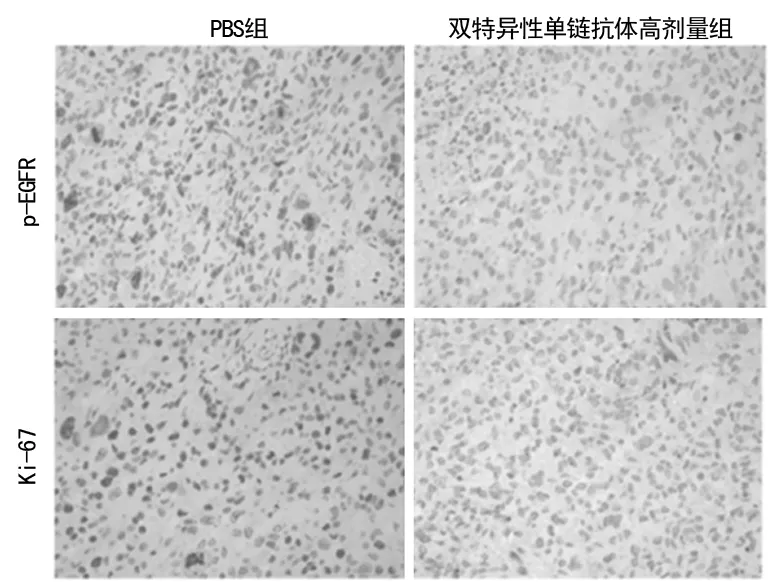
图4 免疫组织化学法检测BT474裸鼠皮下移植瘤组织中p-EGFR及细胞增殖指标Ki-67的表达
3 讨 论
HER2和EGFR都为乳腺癌研究的热门靶点,其在乳腺癌肿瘤细胞表面高表达,与肿瘤的发生和发展有关。但是多项研究表明单独抑制某一条通路,在乳腺癌治疗前期有较好的效果,但一段时间后治疗效果逐步降低,肿瘤产生耐药,无法进行下一步治疗。耐药的产生与肿瘤的代偿机制有关,当抑制一条通路后,另一条相关通路就会代偿性地被激活,故造成肿瘤的耐药。基于此,本研究设计出双特异性单链抗体,其有两种特异性抗原结合位点,在肿瘤细胞的不同靶点之间同时发挥效应功能,产生协同抑制的效果,更好地发挥靶向抑制的功能;并且其相对于全长抗体的优势在于,其相对分子质量较小和生产成本较低,拥有更好的体内外渗透性,故在抗肿瘤领域拥有较好的应用价值[10,13,17]。
本研究以双靶向HER2和EGFR的双特异性单链抗体为研究对象,考察其在体内外抑制乳腺癌BT474细胞的活性,获得增强的抗肿瘤功能,可以为双靶向抑制HER2和EGFR通路的乳腺癌治疗策略,以及新型抗乳腺癌药物的开发提供一定的经验和理论基础。首先设计并表达双特异性单链抗体,流式细胞术结合实验验证了改造的双特异性单链抗体保留了其原有的乳腺癌细胞靶向性。MMT法验证了双特异性单链抗体较其他抗体更为有效的体外抗肿瘤活性。最后,利用BT474细胞裸鼠移植瘤模型对双特异性单链抗体体内的抗肿瘤活性进行研究,实验表明相比于其他抗体,双特异性单链抗体可以显著抑制小鼠体内移植瘤的生长,抑制EGFR的磷酸化和肿瘤细胞的增殖。
综上所述,双特异性单链抗体双靶向HER2和EGFR信号通路,对乳腺癌BT474细胞的体内外抗肿瘤作用效果优于单靶向的抗体,可以为HER2和EGFR信号通路联合治疗提供一种新的临床治疗思路和经验。
