377例儿童畸胎瘤临床特征及病理结果分析∗
2018-10-15吕孟兴阿智祥李霁伟
吕孟兴,高 燕,周 军,阿智祥,李霁伟
(云南省昆明市儿童医院病理科 650228)
畸胎瘤是儿童最常见的生殖细胞肿瘤,分为成熟性畸胎瘤和未成熟性畸胎瘤,未成熟性畸胎瘤具有恶性潜能。现对377例儿童畸胎瘤病例的临床资料及病理特征进行回顾性分析,总结和探讨儿童畸胎瘤的发病特点及基本生物学特征,提高临床医师对该病的认识,为指导治疗和判断预后提供理论基础。
1 资料与方法
1.1一般资料 收集2006年1月至2016年12月昆明市儿童医院资料完整的儿童畸胎瘤患儿共377例,年龄2 d至14岁;男158例,女219例;发现包块者202例,腹痛及腹部不适者65例,头疼、鼻塞者16例;经B超、CT等发现94例。所有患儿术前均征得其家属同意,并签署知情同意书后手术切除肿瘤。
1.2方法 377例畸胎瘤标本均经10%甲醛固定、常规取材、石蜡包埋、4 μm厚连续切片、HE染色、光镜观察。切片由两位病理医师阅片,结合临床资料进行分析总结。
1.3诊断标准及病理特点 成熟性畸胎瘤包含两个及以上胚层的成熟组织成分,一般常见3个胚层:(1)外胚层通常包括皮肤及其附属器、神经上皮组织及脉络丛等;(2)中胚层的脂肪、骨及软骨组织、结缔组织和肌肉等,部分卵巢畸胎瘤中可见到牙齿;(3)内胚层成分包括呼吸道和(或)消化道上皮及各种胚胎性分泌腺体,有时也可见到岛状的胎儿样肝组织、胰腺组织及肾组织。未成熟性畸胎瘤是畸胎瘤中含有数量不等的不成熟组织,主要为原始的、胚胎性的神经外胚层组织(图1)。根据神经来源组织的分化成熟程度的不同,世界卫生组织制定的卵巢肿瘤诊断标准(2003)[1],成熟性畸胎瘤分为3级:1级为肿瘤组织中罕见未成熟神经上皮组织,任何切片不超过一个低倍视野(×40);2级为未成熟神经上皮组织在任何切片内1~3个低倍视野(×40)中见到;3级为肿瘤中含大量的未成熟神经上皮组织,在任何切片中>3个低倍视野(×40)。

注:A为向脑皮质发育的成分(×40);B为鳞状上皮与消化道成分(×40);C为脉络丛与神经胶质成分(×40);D为呼吸道上皮(×100);E为原始神经管(×40);F为原始神经管(×100)
2 结 果
2.1发病年龄及部位 本组病例发病率女性大于男性,男女比为1∶1.38。患儿发病中位年龄为27.12个月,1岁以内的患儿共206例,占54.64%。单纯性畸胎瘤发生于骶尾部占31.56%(119/377),腹腔占22.55%(85/377),睾丸占17.24%(65/367),卵巢占15.91%(60/367),发生于鼻咽部、中枢神经、盆腔、纵隔、胃及胸腔等部位的共48例。发病部位以骶尾部最常见,其次为腹腔、睾丸、卵巢、鼻咽部及中枢神经等。见表1、2。
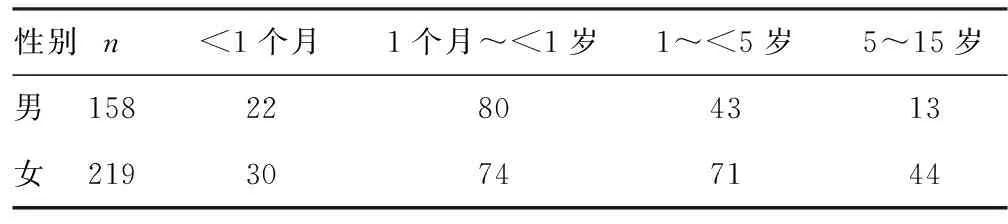
表1 发病年龄统计(n)
2.2治疗及随访 377例畸胎瘤标本中成熟性畸胎瘤333例,未成熟性畸胎瘤34例,畸胎瘤合并卵黄囊瘤10例。(1)本组333例成熟性畸胎瘤均手术完整切除肿瘤,共2例患儿复发,其中1例复发后再次切除发现卵黄囊瘤成分,另1例复发后仍然为良性肿瘤,再次手术完整切除后完全缓解;331例成熟性畸胎瘤术后随访1~10年,B超及CT复查未见异常复发。(2)未成熟性畸胎瘤有24例无瘤存活,5例死亡,5例失访;死亡病例中4例为病理分级3级,1例为2级;并且其中4例未加做化疗,1例复发并死亡,5例失访。(3)畸胎瘤合并卵黄囊瘤的7例为手术完整切除加做化疗,2例单纯切除,1例放弃治疗;经随访6例健在,2例死亡(包括1例未做化疗,1例放弃治疗),2例失访。(4)畸胎瘤恶变者1例在2年后死亡;复发者2例其中1例死亡,另1例目前仍健在。
3 讨 论
本研究中以成熟性畸胎瘤最多,占88.32%(333/377),未成熟性畸胎瘤占9.01%(34/377),畸胎瘤合并卵黄囊瘤的10例占2.65%(10/377);畸胎瘤恶性变者1例(伴甲状腺乳头状腺癌),复发者2例(2例第1次就诊均为成熟性畸胎瘤,其中1例复发后仍然为成熟性,另1例复发后合并卵黄囊瘤)。本组333例完整切除肿瘤的成熟性畸胎瘤,术后复发率仅为0.60%,预后好。未成熟性畸胎瘤随病理分级增加,生存时间明显下降(34例病例有5例死亡),但本研究样本量较少,还需要扩大样本量进一步研究。
一般认为,在人体胚胎发育过程中的胚胎后期,原始生殖细胞在向生殖嵴移行过程中可分化成胚内型或胚外型结构,或二者均有,如果分化成胚内型即成为畸胎瘤,如果分化成胚外结构则形成卵黄囊瘤或由滋养层衍化成绒毛膜癌,因此可以在一些畸胎瘤中发现有卵黄囊瘤成分或绒毛膜癌成分。畸胎瘤几乎可以发生在身体的任何部位,但最常见于躯体中线部位或中线两侧,松果体、骶前或骶尾部、前纵隔、腹膜后及性腺均为好发部位。尾骨为原结所在处,为多能干细胞集中的地方,所以以骶尾部畸胎瘤最多见,卵巢、睾丸有始基组织,也是畸胎瘤的好发部位,本组亦是以骶尾部最多见(31.56%),腹腔(22.55%)、睾丸(17.24%)、卵巢(15.91%)次之。发病部位与文献[2]报道相符。
合并卵黄囊瘤的畸胎瘤预后明显变差,所以将具有卵黄囊形态的畸胎瘤单独区分出来是十分必要的,本组混合卵黄囊瘤的病例有2例死亡。在混合性生殖细胞肿瘤中卵黄囊瘤成分极少时容易漏诊,用标本做免疫组织化学甲胎蛋白(AFP)检测有助于发现成分极少的卵黄囊瘤成分。有研究报道,对含灶状卵黄囊瘤成分患者,术前检查血清AFP,当血清AFP值明显升高时,能提示有卵黄囊瘤成分存在。值得注意的是,2、3级单纯的未成熟性畸胎瘤AFP值可以升高,但通常低于混合有卵黄囊瘤成分者。如果病理科医师取材量少,就很有可能漏掉其伴有的卵黄囊瘤或未成熟神经上皮成分,从而导致病检结果完全不同。这就要求病理科医师对于畸胎瘤具有高度的警惕性,认真观察大体标本切面情况,广泛取材,防止漏取,以确保畸胎瘤的正确诊断,这一点对于儿童更为关键。需要注意的一点是在新生儿及婴儿中AFP值可以生理性升高,随年龄增加AFP值逐渐降低,直到出生后8个月达到正常[3]。本组有1例由成熟性畸胎瘤复发后为畸胎瘤伴卵黄囊瘤,有可能是第1次取材时未取到卵黄囊瘤部分所造成的结果。建议平均1 cm直径取2块,重点区域增加取材数量(灰粉或灰白色质地软嫩的区域可以适当增加取材数量)。
未成熟性畸胎瘤在镜下可见到数量不等的原始神经管、菊形团或神经毡样结构,可见典型的未成熟原始神经管上皮组织及弥漫成片呈巢状分布的原始神经外胚层小圆细胞。细胞较小、核深染、细胞质少,易看到凋亡和核分裂。混合以不同比例的成熟或未成熟组织,常出现未成熟的间叶组织,多为原始间叶细胞或不成熟的软骨小岛,少数情况下可出现未成熟的内胚层结构,如不成熟肝组织、胚胎型肠腺体或胚胎型肾组织。需要注意的是,凡有组织结构、向脑皮质发育的成分应视为成熟组织,而不是原始神经成分。一项对卵巢畸胎瘤的研究发现,在卵巢未成熟性畸胎瘤中血清糖类抗原(CA)125水平及阳性率高于成熟性畸胎瘤,成熟性畸胎瘤患者有53.7% CA199升高,该研究认为CA199是诊断卵巢成熟性畸胎瘤的重要指标[4]。
儿童未成熟性畸胎瘤中不同分化程度的神经上皮组织具有一定的增殖、分化、侵袭、转移能力,神经上皮组织细胞增殖旺盛,生长潜力较大,但在良恶性指标方面仍接近成熟性畸胎瘤的分子生物学特点,偏向良性或交界性肿瘤。目前,临床常将1级未成熟性畸胎瘤视为良恶性交界性肿瘤,2级未成熟性畸胎瘤视为明显恶性肿瘤,3级未成熟性畸胎瘤视为高度恶性肿瘤[5]。在儿童病例中,通常仅将3级未成熟性畸胎瘤归入恶性肿瘤[6]。但近年来一些学者认为儿童未成熟性畸胎瘤有别于成人同类肿瘤,倾向于在儿童病例中将所有未成熟性畸胎瘤都纳入良性肿瘤,即使是3级未成熟性畸胎瘤也有良好的预后,在肿瘤完整切除后不做化疗,以减少化疗对患儿带来的长期不良反应。有学者观察到未成熟性畸胎瘤中的神经组织可以自然分化成熟,呈现良性行为[7]。但也有多例未成熟性畸胎瘤术后复发、有的甚至进展为神经母细胞瘤而发生多处转移的报道,所以应将未成熟性畸胎瘤作为恶性肿瘤看待,术后应化疗并进行长期监测[8]。有研究报道畸胎瘤可向卵黄囊瘤恶性转化[9],故采取了类似卵黄囊瘤的化疗方案。还有研究报道颅内成熟性畸胎瘤复发后转变成未成熟性畸胎瘤[10]。
儿童畸胎瘤临床生物学特性尚不十分清楚,许多问题仍面临争议,而瘤体内神经组织的成熟与否在畸胎瘤的诊断和分级中占有重要的地位。手术能否完整、完全切除肿瘤是影响预后的重要因素之一。BARKSDALE等[11]指出,儿童畸胎瘤的预后与诊断和发现及治疗的时间有密切关系,早期的干预可改善预后。儿童畸胎瘤中不成熟的肝组织、内胚层腺体及不成熟的脉络丛等成分对于患儿预后的重要性还不清楚。本组有1例成熟性畸胎瘤复发后仍然是成熟性畸胎瘤,该例肿瘤中见大量神经胶质成分,因此对于肿瘤中含有大量神经胶质成分的病例应该加强随访。
肿瘤生物学行为及其发生机制的进一步研究将为临床诊疗、随访、预后评估提供更多的客观指标,更全面地了解肿瘤的发生、发展过程。内源性的启动和控制畸胎瘤分化的因素很复杂,目前还未研究清楚。由于畸胎瘤成分复杂,对其成分的研究需要更大量的样本和更全面深入的分析,以全面了解畸胎瘤发生、发展和生物学行为变化,从而使畸胎瘤的治疗获得更好的效果。
